Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Следовательно, оксиды – это бинарные соединения.
По агрегатному состоянию они бывают жидкими, примером такого оксида является вода, или оксид водорода, примером твердого оксида является уже известный вам оксид кремния (IV), или песок, а также различные разновидности кварца; примером газообразных оксидов являются углекислый газ, или оксид углерода (IV), а также угарный газ, или оксид углерода (II).

По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Несолеобразующие оксиды не реагируют с кислотами и основаниями, а также не образуют солей. К несолеобразующим оксидам относятся такие оксиды, как оксид углерода (II) – CO, оксид азота (I) – N2O и оксид азота (II) – NO. К солеобразующим оксидам относятся основные, амфотерные и кислотные.
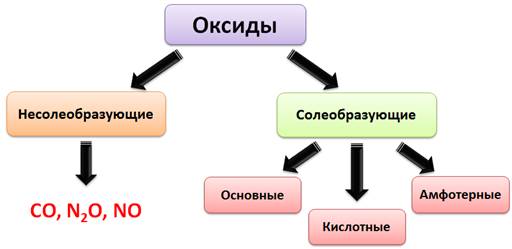
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов I и II A группы, а также оксиды металлов с небольшими степенями окисления (+1, +2). Кроме того, все основные оксиды являются твёрдыми веществами. Например, оксид магния (MgO) – это основный оксид, потому что магний – металл II A группы, ему соответствует основание Mg(OH)2. CrO – тоже основный оксид, т.к. у хрома степень окисления в данном случае +2, этому оксиду соответствует основание – Cr(OH)2. Na2O – основный оксид, т.к. натрий – металл I A группы, ему соответствует основание NaOH.

Основные оксиды вступают в реакции обмена с кислотами. При этом образуется соль и вода. Для того чтобы в этом убедиться, проведём эксперимент: поместим в пробирку немного порошка оксида меди (II), как видите, он чёрного цвета, в эту пробирку нальём раствора серной кислоты и слегка нагреем. Постепенно проходит реакция, т.к. порошок начинает растворяться. Чтобы убедиться в том, что в результате реакции образуется соль, несколько капель содержимого пробирки поместим на предметное стекло и выпарим, после чего на стекле появляются кристаллы соли.


CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Основные оксиды вступают в реакции соединения с кислотными оксидами, при этом образуются соли. Например, при взаимодействии оксида натрия с оксидом фосфора (V) образуется соль – фосфат натрия, в результате взаимодействия оксида магния с оксидом серы (VI) образуется соль – сульфат магния, а при взаимодействии оксида кальция с оксидом углерода (IV) образуется соль – карбонат кальция.

3Na2O + P2O5 = 2Na3PO4
MgO + SO3 = MgSO4
CaO + CO2 = CaCO3
Основные оксиды вступают в реакции соединения с водой с образованием щелочей. Если образуется нерастворимое основание, то такая реакция не идёт. Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция, а в другую оксид меди (II), то реакция у нас идёт только в первой пробирке, т.к. образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.
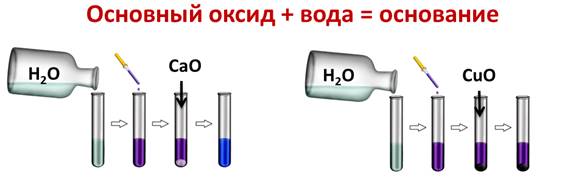
CaO + H2O = Ca(OH)2
CaO + H2O = Ca2+ + 2OH-
CuO + H2O ≠
Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов и оксиды металлов с большими степенями окисления. Например, оксиду азота (V) соответствует азотная кислота, оксиду фосфора (V) – фосфорная кислота, оксиду серы (IV) – сернистая кислота, оксиду серы (VI) – серная кислота, оксиду кремния (IV) – кремниевая кислота, оксиду углерода (IV) – угольная кислота, оксиду хрома (VI) – хромовая кислота, оксиду марганца (VII) – марганцевая кислота.
N2O5 → HNO3
P2O5 → H3PO4
SO2 → H2SO3
SO3 → H2SO4
SiO2 → H2SiO3
CO2 → H2CO3
CrO3 → H2CrO4
Mn2O7 → HMnO4
Кислотные оксиды вступают в реакции обмена с основаниями, при этом образуется соль и вода. Если через пробирку с известковой водой пропустить углекислый газ, то известковая вода мутнеет, следствие образования соли – карбоната кальция.

CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
Кислотные оксиды вступают в реакции соединения с основными оксидами, при этом образуются соли. Например, в результате взаимодействия оксида серы (IV) и оксида калия образуется соль – сульфит калия, в результате взаимодействия оксида кремния (IV) с оксидом натрия при нагревании, образуется соль – силикат натрия, при взаимодействии оксида азота (V) с оксидом бария, образуется соль – нитрат бария.

SO2 + K2O = K2SO3
SiO2 + Na2O = Na2SiO3
N2O5 + BaO = Ba(NO3)2
Кроме этого, кислотные оксиды вступают в реакции соединения с водой, при этом образуются кислоты, однако эти реакции возможные, если оксид растворим в воде. Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в другую – раствор углекислого газа (газированной воды). В первую пробирку добавим оксида кремния (IV). А затем в каждую из пробирок добавим несколько капель лакмуса. В первой пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит, во второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что оксид кремния (IV) не растворим в воде.

SiO2 + H2O ≠
CO2 + H2O ↔ H2CO3

 Получите свидетельство
Получите свидетельство Вход
Вход




 1
1 15643
15643


Добрый вечер! Сегодня видеоурок "Оксиды, их классификация. Свойства оксидов в свете ТЭД" опять недоступен. Учащиеся не смогли дистационно освоить тему. Можно это как то исправить, так как видеоуроки часто бывают недоступны.
С уважением учитель химии Ирина Николаевна.