Это вещество так необходимо человеческому роду, что даже
духовные удовольствия не могут быть лучше выражены,
как словом «…» - таково имя, данное всем проявлениям острого ума.
Плиний-Старший
В древней раздробленной Германии наличие соляных источников на той или иной территории считалось вполне достаточным и убедительным поводом для военного вторжения соседей.
Легионерам Древнего Рима часто платили жалование не деньгами, а солью. Слово «солдат» и английское слово “salary” (жалованье) родились благодаря такому «жалованью».
В XIII в., по свидетельству Марко Поло, в Тибете монетой служила лепёшка из соли с оттиснутым на ней изображением «великого хана», а по словам М. В. Ломоносова, ещё и в его время за 4-5 плиток «Горной соли» в Абиссинии можно было купить раба.
Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Соли – это твёрдые вещества, они отличаются между собой окраской и растворимость в воде.

Ещё в начале XIX в. шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте на металл. По этим признакам соли делят на средние, кислые и основные.

Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Именно эти соли вам уже известны. Например,
Na2CO3 – карбонат натрия
Al2(SO4)3 – сульфат алюминия
Ba(NO3)2 – нитрат бария
CaCl2 – хлорид кальция
K3PO4 – фосфат калия
Эти соли диссоциируют на катионы металла и анионы кислотного остатка. Так, карбонат натрия диссоциирует на катион натрия и карбонат-ион, сульфат алюминия диссоциирует на катион алюминия и сульфат-ион, нитрат бария диссоциирует на катион бария и нитрат-ион, хлорид кальция – на катион кальция и хлорид-ион, а фосфат калия диссоциирует на катион калия и фосфат-ион.
Na2CO3 = 2Na+ + CO32-
Al2(SO4)3 = 2Al3+ + 3SO42-
Ba(NO3)2 = Ba2+ +2 NO3-
CaCl2 = Ca2+ + 2Cl-
K3PO4 = 3K+ + PO43-
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.


К кислым солям относят такие соли как NaHSO4, KHCO3, CaHPO4. Название этих солей складывается из названий средних солей с прибавлением слова «гидро». Назовём наши соли:
NaHSO4 – гидросульфат натрия
KHCO3 – гидрокарбонат калия
CaHPO4 – гидрофосфат кальция
Эти соли диссоциируют ступенчато. На первой ступени образуется катион металла и анион кислотного остатка, содержащий ион водорода, а на второй ступени отщепляется ион водорода и кислотный остаток.
NaHSO4 = Na+ + HSO4-
HSO4- ↔ H + SO42-
Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
К таким солям относится малахит, формула которого (CuOH)2CO3. Как видите, это соль состоит из двух гидроксокатионов CuOH+ и двухзарядного аниона кислотного остатка СО32-. Если подсчитать сумму зарядов ионов, то получается, что эта соль электронейтральна. Названия основных солей складывается из названия средней соли с добавлением слова «гидроксо». Например, назовём соли: (CuOH)2CO3, Mg(OH)Cl.

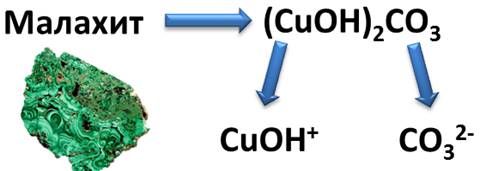
(CuOH)2CO3 – гидроксокарбонат меди (II)
Mg(OH)Cl – гидроксохлорид магния
Эти соли также диссоциируют ступенчато: сначала отщепляется катион металла, содержащий гидроксогруппу и анион кислотного остатка, а затем отщепляется катион металла и гидроксогруппа.
Mg(OH)Cl = MgOH+ + Cl-
MgOH+ ↔ Mg2+ + OH-
Соли реагируют с кислотами, но только в том случае, если образуется осадок, или выделяется газ. Этот тип реакций относится к реакциям обмена. Проведём эксперимент. В одну пробирку нальем силиката натрия и серной кислоты, во вторую – карбонат натрия и азотную кислоту, а в третью нитрат натрия и серную кислоту. В результате у нас получается, что в первой пробирке выпал студенистый осадок, во второй пробирке мы можем наблюдать выделение газа, а в третьей изменений нет. Следовательно, химические реакции прошли только в двух пробирках.
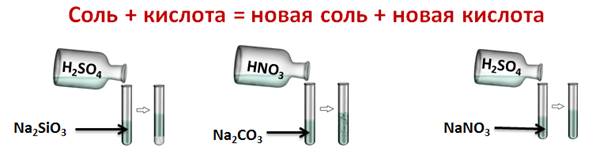
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
NaNO3 + H2SO4 ≠
Соли вступают в реакции обмена со щелочами, при этом образуется новая соль и новое основание. Для этого нальём в первую пробирку раствор сульфата железа (III) и добавим гидроксида натрия, во вторую сульфата аммония и гидроксида калия, слегка нагреем содержимое пробирки, а в третью нальём раствор нитрата бария и добавим гидроксида калия. В первой пробирке мы наблюдаем осадок бурого цвета, во второй пробирке образуется газ с резким запахом, в третьей пробирке изменений не наблюдаем. Поэтому, можно говорить о том, что соли реагируют с основаниями в том случае, если образуется слабое основание или нерастворимое в воде основание.
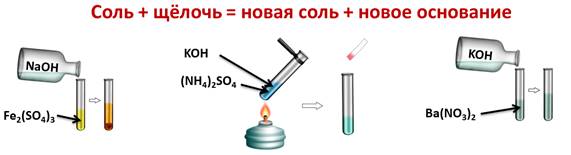
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Fe3+ + 3OH- = Fe(OH)3↓
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O
NH4+ + OH- = NH3↑ + H2O
Ba(NO3)2 + KOH ≠
Соли могут реагировать между собой. Эти реакции относятся к реакциям обмена. При этом образуется две новые соли, одна из них должна быть нерастворимой. Например, если мы к раствору хлорида бария добавим раствор сульфата натрия, то у нас образуется осадок белого цвета. Т.о. в результате данной реакции образовалось две соли, причём одна выпадает в виде осадка.
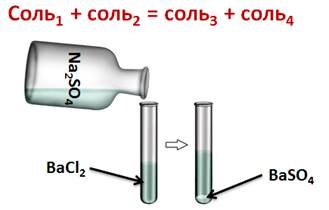
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + SO42- = BaSO4↓
Соли могут вступать в реакции замещения с металлами. При этом образуется другая соль и другой металл. Однако для прогнозирования протекания этих реакций необходимо использовать ряд активности металлов. Впервые этот ряд составил Н.Н. Бекетов, который расположил металлы и водород по способности вытеснять друг друга из растворов солей. Этот ряд он назвал вытеснительным рядом металлов. Вытеснительный ряд металлов называют ещё электрохимическим рядом напряжений металлов. Более активные металлы находятся вначале ряда, а неактивные – в конце. Поэтому, этот вытеснительный ряд металлов используют для определения протекания реакций между солями и металлами. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в ряду напряжений. При этом должны соблюдаться условия: обе соли (и реагирующая, и образующаяся) должны быть растворимыми, металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).

Для подтверждения этих правил проведём опыт. Для этого в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II), а в третью – раствор сульфата железа (II). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.

Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
Cu + FeSO4 ≠

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 12185
12185

