Она жжётся и кусается,
Если к нам на руки проливается.
Дырки в брюках оставляет
И бумагу прожигает.
Вот такая вот она –
Эта наша …!
Кислоты – это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются ионы водорода. Именно наличие ионов водорода обуславливает общие свойства всех кислот.
Рассмотрим свойства, характерные для всех кислот.
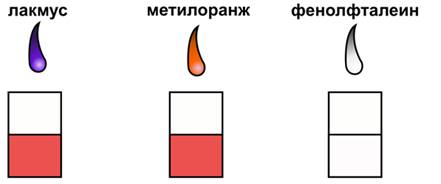
Все растворы кислот изменяют окраску индикаторов. Изменение окраски индикаторов связано с наличием у кислот ионов водорода, образующихся при диссоциации кислот.
HCl = H+ + Cl-
HNO3 = H+ + NO3-
HNO2 ⇆ H+ + NO2-
Если мы в раствор кислоты добавим несколько капель лакмуса, то раствор окрасится в красный цвет, т.е. в кислотах лакмус изменяет окраску с фиолетовой на красную, если мы в раствор кислоты добавим несколько капель метилового оранжевого, то раствор кислоты станет тоже красного цвета, т.е. и метиловый оранжевый в кислотах изменяет свою окраску с оранжевой на красную. Фенолфталеин не изменяет свою окраску в присутствии кислот.
Действие кислот на индикаторы
Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
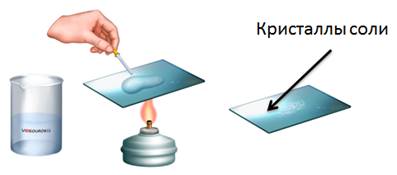
NaOH + HCl = NaCl + H2O
ОН- + Н+ = Н2О
Аналогично кислоты реагируют с нерастворимыми основаниями. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).
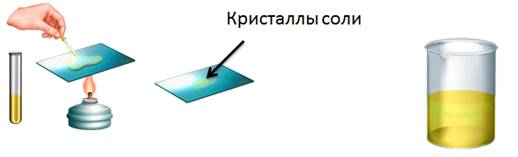
Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Кислоты также вступают в реакцию обмена с оксидами металлов. В результате реакции образуется соль и вода.
Кислота + оксид металла = соль + вода
Поместим в пробирку оксид металла – оксид меди (II), он чёрного цвета, нальём в эту же пробирку раствор серной кислоты и слегка нагреем содержимое пробирки. У нас протекает реакция, в результате которой образуется соль – сульфат меди (II) и вода. Доказать, что в реакции образовалась соль можно так же, как и в предыдущих опытах, для этого следует несколько капель раствора поместить на предметное стекло и выпарить.
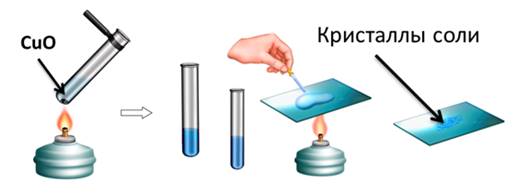
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для того чтобы реакция между кислотой и металлом прошла, необходимы следующие условия:
· Металл должен находиться в ряду напряжений до водорода.
· Должна получиться растворимая соль.
· Нерастворимые кислоты не вступают в реакцию с металлами.
· Концентрированный раствор серной и растворы азотной кислоты иначе реагируют с металлами.
Для этого подтверждения поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую – алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты, во вторую и четвёртую – раствора соляной кислоты. Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
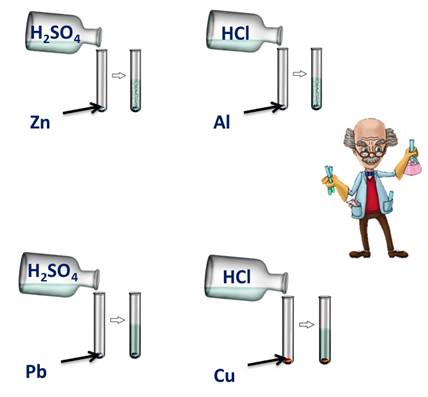
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H20↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠
Реакция кислот с солями относится к реакциям обмена, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.

Кислота + соль = новая кислота + новая соль
Проведём опыт: для этого в первую пробирку нальём соляной кислоты и силиката натрия, во вторую – серной кислоты и карбоната калия, в третью – соляной кислоты и хлорида бария. Посмотрим за изменениями: в первой пробирке мы наблюдаем образование студенистого осадка, во второй – выделение газа, а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
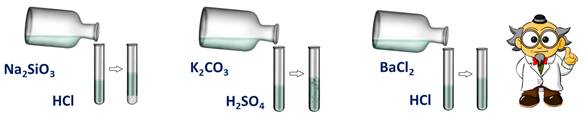
2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
2H+ + SiO32- = H2SiO3↓
H2SO4 + K2CO3 = K2SO4 + CO2↑ + H2O
2H+ + CO32- = CO2↑ + H2O
HCl + BaCl2 ≠
Подведем итог. Кислоты изменяют окраску индикаторов, реагируют с основаниями, оксидами металлов, при определённых условиях реагируют с металлами и солями.

 Получите свидетельство
Получите свидетельство Вход
Вход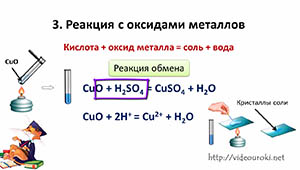



 0
0 16251
16251


