Все белки построены из 20 α-аминокислот. В белках есть пептидные или амидные связи, которые образуются за счёт карбоксильной группы одной кислоты и аминогруппы другой.

Неподелённая пара электронов атома азота вступает в сопряжение с π-электронами карбонильной группы, электронная плотность смещается к атому кислорода, потому что он более электроотрицательный. Затрудняется свободное вращение вокруг пептидной связи, а пептидная группа приобретает плоское строение.

Таким образом, белки – это высокомолекулярные природные полимеры, построенные из остатков α-аминокислот.
Молекулы белков имеют не только большое значение молекулярной массы, но и большие размеры.
Например, белок коллаген имеет молекулярную массу 350 000, фиброген – 450 000, пепсин – 35 000, а белок рибонуклеаза – 13 000.
Огромный вклад в изучение строения и обмен белков внёс русский учёный А. Я. Данилевский.
С помощью специальных методов было установлено, что существуют следующие уровни организации белковых молекул: первичная, вторичная, третичная и четвертичная структуры белка.
Первичная структура белка представляет собой строгую последовательность аминокислотных остатков в полипептидной цепи.
H2N – Gly – Ala – Phe – Glu – Cys – COOH
Вторичная структура белка представляет собой пространственное расположение полипептидной цепи в виде спирали. Несмотря на то, что эта устойчивая пространственная конформация, в этой полипептидной цепи есть места, где допускается свободное вращение вокруг одинарных связей. В этой полипептидной цепи есть и водородные связи, которые направлены вдоль оси спирали. В одном витке спирали находится около 4 остатков аминокислот.
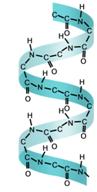
Большой вклад в расшифровку вторичной структуры белка внесли многие учёные, среди которых выделяется Л. Полинг.
Лайнус Карл Полинг – американский химик. Один из авторов α-спирали молекулы белка. Нобелевский лауреат 1954 года, а также Нобелевский лауреат премии Мира в 1962 году.
Третичная структура белка – более сложное закручивание полипептидной цепи, при этом спираль как бы изгибается, происходит стабилизация структуры, она напоминает по форме клубок. Третичная структура обуславливает биологическую активность белковой молекулы.

Четвертичная структура – это несколько полипептидных цепей расположенных в пространстве. Эти полипептидные цепи связаны водородными связями. Примером белка с четвертичной структурой является гемоглобин.

По химическому составу белки делят на простые, которые ещё называются протеины, состоящие только из остатков α-аминокислот, и сложные, которые называют протеиды. Сложные белки могут включать ионы металлов, углеводы, липиды и другие соединения.
Различают твёрдые, жидкие и полужидкие, или студнеобразные белки. Твёрдые белки нерастворимы в воде и солевых растворах. Жидкие и полужидкие белки растворяются в воде и солевых растворах. Белки с небольшой молекулярной массой лучше растворяются в воде. Например, белок яичного белка – альбумин – хорошо растворяется в воде.
По растворимости белки делят на глобулярные (от лат. globulus – «шарик»), растворимы в воде или образуют коллоиды. К таким белкам относятся гемоглобин, ферменты, многие гормоны. Фибриллярные белки (от лат. fibrilla – «волоконце», «ниточка») нерастворимы в воде. К таким белкам относятся коллаген, содержащийся в коже и соединительных тканях, эластин, который содержится в лёгких и артериях, кератин, содержащийся в волосах и ногтях.

Важное химическое свойство белков – гидролиз. В процессе гидролиза разрушаются все пептидные связи. Например, белки пищи в желудке подвергаются гидролизу под действием ферментов и образуются аминокислоты. Таким образом, при гидролизе белка образуется смесь аминокислот.
Второе свойство аминокислот – это денатурация (от лат. denature, de – «отделение», nature – «природа»). Денатурация – разрушение третичной структуры белка при действии кислот, щелочей, солей тяжёлых металлов, радиации, нагревании. Денатурация – это необратимый процесс. Его наблюдал каждый при варке яиц, при этом происходит «свёртывание» яичного белка. При денатурации белок теряет характерные для него свойства.
Кроме необратимой есть и обратимая денатурация – ренатурация – это слабое воздействие на белок (изменение температуры на 1 0C), при этом после снятия воздействия белок вернётся в исходную форму.
При сильном нагревании может происходить не только денатурация, но и разложение молекул белков с образованием летучих веществ со специфическим запахом.
Белки дают ряд цветных реакций. К таким реакциям относится биуретовая реакция. Если к раствору белка в щелочной среде прилить раствор сульфата меди (II), то происходит сине-фиолетовое окрашивание. Эта реакция доказывает наличие пептидных связей в молекуле белка.
Вторая реакция – это ксантопротеиновая. Если раствор белка обработать концентрированной азотной кислотой, а затем добавить раствор щёлочи, то появится сначала жёлтая окраска, а потом оранжевая. Эта реакция доказывает наличие бензольного кольца в остатках аминокислот.
Белки распространены в природе и выполняют важные функции в жизнедеятельности всего живого на Земле. Белки являются биологическими катализаторами – ферментами, которые осуществляют химические реакции в живом организме. При расщеплении белков образуется энергия, которая преобразуется в механическую. Белки входят в состав нуклеопротеидов, которые входят в состав хромосом и рибосом. Белки входят в состав комплексов, регулирующих обмен веществ, работу мышц, желез внутренней секреции. Белки входят в состав костной и соединительной ткани человека и животных, шерсти, роговых образований. Белковая пища должна обязательно входить в рацион питания человека, так как при гидролизе белка образуются аминокислоты, которые служат основой синтеза собственных белков человека.
Таким образом, белки – это высокомолекулярные природные полимеры, построенные из остатков аминокислот. Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой. Различают первичную, вторичную, третичную и четвертичную структуры белков. Белки бывают простыми и сложными. Различают твёрдые, жидкие и полужидкие белки. Белки подвергаются гидролизу, им свойственны «цветные реакции».

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 9954
9954


