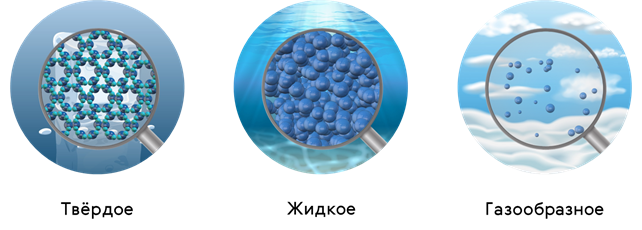
Все вы прекрасно знаете, что вещество может находиться в трёх агрегатных состояниях: жидком, твёрдом и газообразном.
Давайте с вами вспомним, что в веществе, находящемся в газообразном состоянии, взаимодействием между молекулами можно пренебречь. Если оно отсутствует вообще, то мы имеем дело с моделью, которая называется идеальным газом. Одно из главных свойств газа — это возможность занимать весь предоставленный объём.
У жидкости расстояние между молекулами одного порядка сравнимо с размерами самих молекул. Поэтому силы взаимодействия между молекулами начинают играть существенную роль. Это значит, что если мы попытаемся сблизить молекулы жидкости, то возникают мощные силы отталкивания и, как вы помните, это приводит к тому жидкость практически несжимаема. Но с другой стороны, если расстояние между молекулами немножко увеличить, то включаются силы притяжения. И поэтому молекулы не разлетаются, а остаются, как говорят физики, в конденсированной фазе. А раз так, то у жидкости есть свой объём.
Однако почти то же самое можно сказать и о твёрдом теле. У твёрдого тела тоже есть свой объём. Расстояние между молекулами твёрдого тела почти не отличаются от расстояния между молекулами жидкости. А иногда бывает и так, например при плавлении льда, что объём уменьшается. Но жидкости не сохраняют своей формы. А у твёрдого тела своя форма есть. С чем это связано давайте? Попробуем разобраться.
Итак, молекулы жидкости также, как и молекулы твёрдого тела, непрерывно хаотически движутся. Это движение имеет характер колебаний. Но что такое колебание? Колебание — это движение вокруг какого-то положение устойчивого равновесия. То есть молекулу в жидкости можно представить, как молекулу, которая окружена другими молекулами, и которые отталкивают её обратно, если она к ним приближается. В результате и появляется какое-то положение равновесия. Но из-за того, что кинетическая энергия молекул жидкости достаточно большая, молекула может легко выскочить из этого положения равновесия и переместиться в соседние и так далее. В результате этого жидкости приобретают способность течь, то есть обладает текучестью.
А теперь давайте поговорим о том же самом, но на энергетическом языке. Итак, молекула, находящаяся в положении устойчивого равновесия обладает минимальной потенциальной энергией. Чтобы это лучше понять, представим себе такую механическую аналогию. Пусть у нас есть некий сферический сосуд, в который мы опустим шарик. Очевидно, что, через небольшой промежуток времени шарик остановиться, занимая положение равновесия в самой нижней точке сосуда. Этот сосуд (или яма) называется у физиков потенциальной ямой. То есть потенциальная яма — это область пространства, где потенциальной энергии имеет минимум.
И вот точно так же, как у шарика в чаше, у каждой молекулы жидкости и твёрдого тела положение равновесия находится внутри потенциальной ямы, которую создают другие молекулы. Другие молекулы и эта молекула тоже участвуют в создании потенциальной ямы для соседних молекул. Однако если кинетическая энергия данной молекулы больше, чем глубина той потенциальной ямы в которой она оказалась, то она способна покинуть потенциальную яму. Но это значит, что вылетевшая молекула разрушит потенциальную яму для той молекулы, которой была рядом. В результате потенциальные ямы в жидкости всё время рождаются и тут же исчезают.

А теперь представим себе, что мы начали снижать температуру жидкости. Очевидно, что в этом случае кинетическая энергия молекул становится меньше. И вот может сложиться такая ситуация, что молекулы случайно образовали потенциальную яму, в неё попала молекула, а выйти не может. Но для равномерно прогретой или охлаждённой жидкости такие условия выполняются для всех молекул одновременно. Следовательно, при определённом значении температуры могут сложиться такие условия, когда для всех молекул жидкости одновременно появляется возможность засесть в потенциальных ямах, которые образуются другими молекулами. А так как все молекулы одинаковые, то, очевидно, и свойства всех молекул одинаковые и потенциальные ямы, которые они могут создать друг для друга, тоже будут одинаковыми. А это значит что эти ямы должны располагаться на одинаковых расстояниях друга от друга — рядами. То есть структура, которая при этом образуется, обладает пространственной периодичностью. Эта структура получила название кристаллической структуры. А те точки, где такая кристаллическая структура может возникать называются центрами кристаллизации.

Если только появляются такие центры кристаллизации, то происходит превращение жидкости в кристаллическое твёрдое тело. Такой процесс называется кристаллизацией. А температура, при которой происходит кристаллизация данного вещества, как вы помните, называется температурой кристаллизации.
Кристаллы — это такие твёрдые тела, атомы, ионы или молекулы которых совершают тепловые колебания около определённых, упорядоченных в пространстве положений равновесия. Упорядоченное размещение частиц твёрдого кристаллического тела обусловливает его правильную геометрическую форму.
Частицы кристалла удерживаются на определённом усреднённом расстоянии друг от друга (порядка 0,1 нм) силами межатомного и межмолекулярного взаимодействия. И несмотря на тепловые колебания, они образуют упорядоченную пространственную структуру, геометрическим образом которой является кристаллическая решётка. Узлы кристаллической решётки — это положения устойчивого равновесия колеблющихся частиц, из которых состоит кристалл.
Основой строения кристалла служит так называемая элементарная кристаллическая ячейка — многогранник наименьших размеров, последовательным переносом которого вместе с частицами, находящимися внутри этого многогранника, можно построить весь кристалл.

В кристаллических телах упорядоченное размещение частиц повторяется во всём объёме кристалла, поэтому говорят, что в кристалле существует дальний порядок в расположении частиц.
В зависимости от вида частиц и от характера cил взаимодействия между ними, различают четыре основных типа кристаллов: это ионные, атомные, металлические и молекулярные.
В узлах ионной кристаллической решётки размещены положительно и отрицательно заряженные ионы, «связанные» между собой электростатическими силами. Кристаллы с ионной решёткой тугоплавки и обладают высокой твёрдостью. Типичным примером ионного кристалла является кристалл хлорида натрия.

В узлах атомной кристаллической решётки находятся нейтральные атомы. Связь между атомами осуществляется электронными парами — по одному валентному электрону от каждого атома. Примером атомных кристаллов могут служить алмаз и графит.

Эти кристаллы хоть и тождественны по химической природе (они состоят из атомов углерода), но сильно отличаются по своему строению. Так алмаз — это твёрдый минерал, а графит — наоборот, мягкий и хрупкий.
В узлах кристаллической решётки металлов находятся положительные ионы, например, полония, железа или серебра. Между колеблющимися ионами непрерывно движутся свободные электроны.
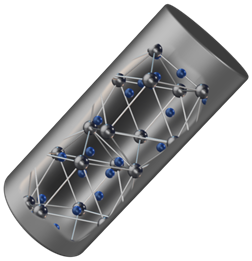
В узлах молекулярных кристаллических решёток находятся молекулы. Большинство простых веществ неметаллов в твёрдом состоянии, например водород, кислород и их соединений друг с другом, а также практически все твёрдые органические вещества образуют молекулярные кристаллы.

Твёрдые тела, имеющие во всём объёме единую кристаллическую решётку, называют монокристаллами. Это одиночные кристаллы, которые могут иметь довольно большие размеры. Например, встречаются кристаллы горного хрусталя, размеры которых соизмеримы с ростом человека.
Характерной особенностью монокристаллов является их анизотропия, то есть зависимость физических свойств (механических, тепловых, электрических и оптических) от направления.
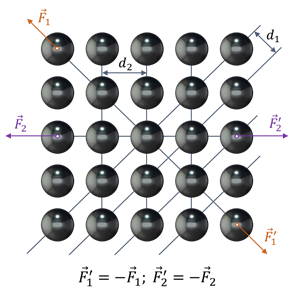
Однако в большинстве своём, твёрдые тела являются поликристаллами, то есть состоят из большого числа сросшихся между собой маленьких монокристаллов. Их легко можно рассмотреть на свежем изломе металла под микроскопом и даже с помощью обычной лупы. Как следствие, поликристаллы изотропны, то есть их свойства одинаковы по всем направлениям.
К поликристаллам относятся не только металлы. Например, кусочек сахара также имеет поликристаллическую структуру.
Кроме твёрдых тел, имеющих кристаллическую структуру, которая характеризуется строгим порядком в расположении атомов, существуют так называемые аморфные твёрдые тела.
Аморфное состояние (от греческого — бесформенный) — это твёрдое некристаллическое состояние вещества, характеризующееся изотропией свойств и отсутствием определённой температуры плавления.
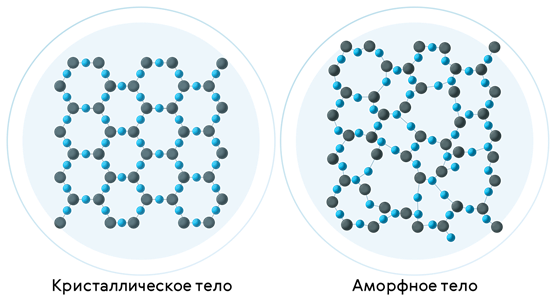
При повышении температуры аморфное вещество размягчается и постепенно переходит в жидкое состояние. В аморфном состоянии вещество не имеет строгого порядка в расположении атомов и молекул. На экране вы видите схематическое изображение строения кристаллического и аморфного кварца.
Аморфное состояние — это бесформенное состояние со слабо выраженной текучестью. Так, если воронку наполнить кусочками воска, то через некоторое время (различное для разных температур) кусочки воска будут “расплываться”. Воск примет форму воронки и начнёт «вытекать» из неё. Текучесть аморфных тел связана с перескоками молекул из одного положения равновесия в другое.
При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства, подобно твёрдым телам, и текучесть, подобно жидкости. Так, при кратковременных воздействиях (ударах) они ведут себя как твёрдые тела и при сильном ударе раскалываются на куски. Но при очень продолжительном воздействии аморфные тела текут.
Аморфные тела при определённых условиях могут кристаллизоваться. Так, например, сахар-песок является кристаллическим телом. Однако если его расплавить, а потом оставить застывать, то он сначала леденец, который являющийся аморфным телом. А спустя ещё некоторое временя леденец «засахаривается», то есть опять становится кристаллическим. Связано это с тем, что внутренняя энергия вещества в аморфном состоянии больше, чем в кристаллическом. Поэтому аморфные тела могут самопроизвольно переходить в кристаллическое состояние (этим, кстати, можно объяснить помутнение со временем стёкол).
Помимо кристаллических и аморфных тел в природе можно встретить вещества, обладающие одновременно анизотропией и текучестью. Их называют жидкокристаллическими (на ум сразу приходит телевизор, неправда ли? И мы сейчас объясним почему).
По структуре жидкие кристаллы представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всём объёме этой жидкости.

Например, если в жидком кристалле, образованном нитевидными молекулами, молекулы расположены параллельно друг другу, однако беспорядочно сдвинуты. При тепловом движении центры этих молекул движутся хаотически, однако ориентация молекул не изменяется.
Строгая ориентация молекул существует не во всём объёме кристалла, а в небольших областях, называемых доменами.
На границе доменов происходит преломление и отражение света, поэтому жидкие кристаллы являются непрозрачными. Однако в слое жидкого кристалла, помещённом между двумя тонкими пластинами, расстояния между которыми 0,01—0,1 мм, с параллельными углублениями, все молекулы будут параллельны и кристалл станет прозрачным. Если на какие-то участки жидкого кристалла подать электрическое напряжение, то жидкокристаллическое состояние нарушается. Эти участки становятся непрозрачными и начинают светиться, а участки без напряжения остаются тёмными.
Вот это явление свечения жидких кристаллов и используется при создании жидкокристаллических экранов.

 Получите свидетельство
Получите свидетельство Вход
Вход




 8284
8284