Периодический закон и Периодическая система химических элементов Д.И. Менделеева
С первых дней изучения химии мы используете периодическую таблицу. Она демонстрирует то, что все химические элементы представляют собой единое целое, т.е. систему. Поэтому периодическую таблицу Д.И. Менделеева называют Периодической системой химических элементов.
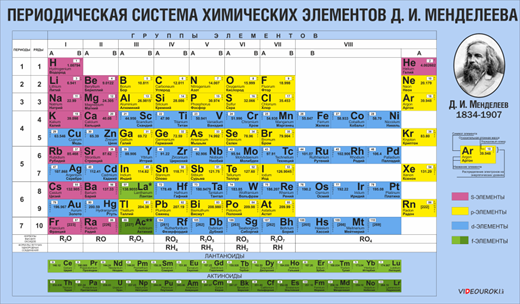
Д.И. Менделеев — выдающийся русский химик, создатель естественной классификации химических элементов – Периодической системы элементов, являющейся выражением периодического закона химических элементов.


Как же он это сделал? Давайте представим себе …
В качестве основы для систематизации химических элементов он выбрал главную количественную характеристику элемента – его относительную атомную массу (в его время её называли атомным весом). Так делали и многие учёные до него: А. Шанкуртуа, Д. Ньюлендс, Л. Мейер. Но Д. И. Менделеев придавал большое значение и химическим свойствам простых веществ и соединений элементов. Главной задачей для него было увидеть естественную связь между элементами, т.е. такую закономерность, которая объединила бы все элементы в единую систему.



А. Шанкуртуа Д. Ньюлендс Л. Мейер
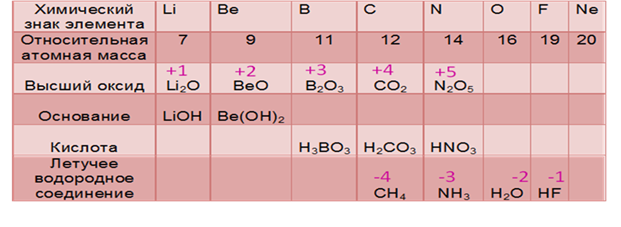
Установить такую закономерность было непросто, ведь в то время было известно ещё не очень много химических элементов, да и атомные массы большинства из них были определены неточно. Но Д .И. Менделеев для каждого химического элемента записал на карточке: символ элемента, значение относительной атомной массы, формулы и характер высшего оксида и гидроксида.

Так было расположено 63 известных, в то время, химических элементов в одну цепочку в порядке возрастания их относительных атомных масс. Проанализировал эту совокупность, была найдена в ней определённая закономерность. В этой цепочке есть интервалы, в которых свойства элементов и их соединений изменяются сходным образом.

Так, через семь элементов (благородные газы тогда были не открыты), если начинать с лития (Li), появляется снова щелочной металл натрий (Na), ещё через семь элементов – следующий щелочной металл – калий (K).
Точно такая же повторяемость обнаружена и у галогенов (элементов VII A группы): через семь элементов после фтора (F) идёт галоген хлор (Cl).
Запомните: в пределах одного периода с увеличением относительных атомных масс металлические свойства ослабевают, а неметаллические свойства усиливаются, увеличивается степень окисления элементов в высших оксидах от +1 до +8, а степень окисления элементов в летучих водородных соединениях увеличивается от -4 до -1. Основные оксиды через амфотерные сменяются кислотными, а гидроксиды от щелочей через амфотерные гидроксиды сменяются кислородсодержащими кислотами.

 Систематизируя
химические элементы на основе их относительных атомных
масс, уделялось большое внимание свойствам элементов и образованных ими
веществ, поэтому и распределялись элементы со сходными свойствами друг
под другом, т.е. в группы. Иногда, приходилось ставить
элементы с большими значениями относительных атомных впереди элементов
с меньшими значениями относительных атомных масс.
Систематизируя
химические элементы на основе их относительных атомных
масс, уделялось большое внимание свойствам элементов и образованных ими
веществ, поэтому и распределялись элементы со сходными свойствами друг
под другом, т.е. в группы. Иногда, приходилось ставить
элементы с большими значениями относительных атомных впереди элементов
с меньшими значениями относительных атомных масс.
Например, кобальт (Co) перед никелем (Ni), теллур (Te) – перед йодом (I). Такой порядок расположения был необходимым потому, что иначе эти элементы попали бы в группу несходных с ними по свойствам элементов. Однако делалось это интуитивно, без возможности объяснить эти исключения из общего правила, как и периодичность изменения свойств элементов и образованных ими веществ. Но уже тогда предполагалось, что эта причина кроется в сложном строении атома.

Вот почему таблицу химических элементов называют «периодической». Т.к. общие закономерности в изменении свойств атомов, простых и сложных веществ, образованных химическим элементами повторяются в этой системе через определённые интервалы – периоды, т.е. изменяются периодически.

Эту закономерность была сформулирована в виде Периодического закона в 1869 году:

Д. И. Менделеев пришёл к открытию Периодического закона. Проведя сопоставление свойств и относительных атомных масс химических элементов и уже тогда, сделал несколько прогнозов о свойствах ещё неизвестных в то время элементов, и указал пути их открытия. Для этих химических элементов он оставил пустые клеточки.

Поэтому, в соответствии с современными представлениями строения атома, основой классификации химических элементов является не относительная атомная масса, а заряд ядра атома. И современная формулировка Периодического закона сейчас звучит иначе:
|
|
|
Периодичность в изменении свойств элементов и их соединений объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число электронов и число электронов на внешнем уровне отражают физический смысл номера периода и группы, порядкового номера. Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в пределах группы и периода.
Периодический закон и Периодическая система:
· обобщают знания о химических элементах и образованных ими веществах
· объясняют периодичность в изменении их свойств
· объясняют причину сходства свойств элементов
· позволяют прогнозировать, т.е. предсказывать свойства и пути открытия новых химических элементов.
Американские учёные, открывшие элемент №101, дали ему название «менделевий» в знак признания заслуг великого русского химика Д.И. Менделеева, который первым применил Периодическую систему элементов для предсказания свойств тогда ещё не открытых элементов.

Учёные-первооткрыватели новых элементов высоко оценили открытие русского учёного.
Например, К. Винклер говорил:

«Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов, чем открытие до сих пор гипотетического экасилиция; оно составляет, конечно, более чем простое подтверждение смелой теории, — оно знаменует собой выдающееся расширение химического поля зрения, гигантский шаг в области познания».

 Получите свидетельство
Получите свидетельство Вход
Вход





 0
0 19939
19939

