Углерод. Оксиды углерода
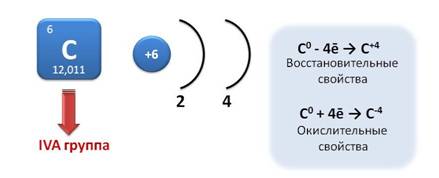
Углерод – элемент IVA группы. На внешнем энергетическом уровне у углерода четыре электрона, которые он может отдавать или присоединять до завершения внешнего слоя. Если углерод отдаёт четыре электрона, то он проявляет восстановительные свойства и приобретает степень окисления +4. Если он присоединяет четыре электрона, то он проявляет окислительные свойства и приобретает степень окисления -4 .
Углерод образует несколько аллотропных модификаций, наиболее распространённые из них – алмаз и графит.
Алмаз – прозрачное кристаллическое вещество. Одно, из самых твёрдых веществ, в природе. Высокая твёрдость алмаза обусловлена строением его кристаллической решётки. Для алмаза характерна атомная кристаллическая решётка, где каждый атом углерода окружён такими же атомами, расположенными в вершинах правильного тетраэдра.

Как правило, алмазы бесцветные, но встречаются синего, голубого, красного и чёрного цвета. Алмаз имеет сильный блеск из-за высокой светопреломляющей и светоотражающей способности.





Алмазы были известны ещё в древности. Слово «алмаз» происходит от арабского алмас, что означает «твердейший», или от греческого слова адамас – «несокрушимый, непреодолимый». Массу алмазов измеряют в каратах, один карат соответствует 0,2 граммам.
Огранённые прозрачные алмазы называют бриллиантами. Они украшают короны царей бывшей Российской империи, орден Святого Андрея Первозванного, который представляет собой восьмилучевую звезду, которая усыпана бриллиантами и украшена тридцатью мелкими сапфирами.


Крупные алмазы имеют имена и свою биографию. Самый крупный из найденных алмазов – это «Куллинан» из Южной Африки, алмаз «Шах», которым расплатилось персидское правительство за жизнь погибшего в Тегеране в 1829 году Грибоедова.


Алмазы применяют не только как украшения, но и для изготовления буров, свёрл, шлифовальных инструментов, резки стекла.



Крупнейшие месторождения алмазов находятся в Южной Африке, в России алмазы добывают в Якутии.
Вторым аллотропным видоизменением углерода является графит, который представляет собой тёмно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском.
Графит, по сравнению с алмазом, мягкий и непрозрачный, хорошо проводит теплоту и электрический ток. Физические свойства графита обусловлены его кристаллической решёткой. Атомы углерода в кристаллической решётке лежат в одной плоскости, образуя правильные шестиугольники. Слоистая структура графита определяет его мягкость: он легко оставляет след на бумаге. Связи между этими слоями мало прочные. Графит тугоплавок.

Из графита делают электроды, твёрдые смазки, замедлители нейтронов в ядерных реакторах, стержни для карандашей. При высоких температурах и давлении из графита получают искусственные алмазы.




Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины. Древесный уголь обладает адсорбцией, то есть он поглощает газы и растворённые вещества своей пористой поверхностью.

Древесный уголь обрабатывают горячим водяным паром для увеличения поглотительной способности. Такой обработанный уголь называется активированным. Активированный уголь используют для изготовления бытовых фильтров, противогазов. Первый противогаз был изобретён выдающимся русским химиком Н.Д. Зелинским.

Н.Д. Зелинский

Если бросить кусочек активированного угля в колбу с бурым газом – NO2, то бурая окраска в колбе исчезнет.

Адсорбция углем
Активированный уголь используют в промышленности для очистки спирта от сивушных масел, сахарного сиропа от окрашенных веществ, для улавливания бензина из природных газов.
Химические свойства углерода
Углерод реагирует с кислородом с образованием оксида углерода четыре (CO2).
С + О2 = СО2 ↑ (t)
Если поместить в ложечку для сжигания веществ кусочек древесного угля и раскалить его на пламени спиртовки, а затем внести в колбу с кислородом, то уголь начинает гореть сверкающим пламенем.

В этой реакции углерод повышает свою степень окисления с 0 до +4, проявляя тем самым восстановительные свойства, а кислород понижает свою степень окисления с 0 до -2 и проявляет окислительные свойства.
C0 + O20 = C+4O2-2↑
C0 – восстановитель, O20 – окислитель, C+4O2-2 – оксид углерода( IV).
Углерод вступает во взаимодействие с металлами при нагревании, при этом образуются карбиды. Например, в реакции алюминия с углеродом образуется карбид алюминия.
4Al0 + 3C0 = Al4+3C3-4
Al0 – окислитель, Al4+3C3-4– карбид алюминия.
В данной реакции углерод понижает свою степень окисления с 0 до -4, поэтому здесь он проявляет окислительные свойства.
Углерод реагирует с водородом с образованием метана. В этой реакции углерод понижает свою степень окисления с 0 до +4, а водород повышает с 0 до +1, поэтому углерод окислитель, а водород – восстановитель.
t, Ni
С0 + Н20 = С+4Н4-1
В-ль ок-ль метан
C0 – восстановитель, Н20 – окислитель, С+4Н4-1 – метан.
Если в пробирке прокалить смесь чёрного порошка оксида меди два (CuO) с порошком древесного угля, то смесь приобретает красный цвет из-за образовавшейся в результате реакции меди (Cu).
В этой реакции углерод повышает свою степень окисления с 0 до +4, поэтому он является восстановителем, а медь понижает свою степень окисления с +2 до 0, поэтому медь – окислитель.
C0 + Cu+2O = C+4O2-2 + Cu0
C0 – восстановитель, Cu+2O – окислитель, С+4Н4-1 – метан.
Применение углерода
Углерод является составной частью крема для обуви, адсорбентом в противогазах, наполнителем при производстве резины, его используют в производстве синтетического бензина, в медицине, для получения карбида кальция (CaC2), для получения искусственных алмазаов, в металлургии для очистки этилового спирта, для приготовления чёрной краски.

Углерод – это основной элемент биосферы Земли. Он входит в состав клеток животных и растений.
В природе углерод встречается в свободном состоянии (алмаз, графит) и в форме соединений, в основном в виде карбонатов, наиболее распространённым из них является карбонат кальция – (CaCO3), который образует известняк, мел и мрамор.
В атмосфере содержится оксид углерода (IV) – CO2 – углекислый газ. Он образуется при дыхании и сгорании топлива, при тлении и гниении органических веществ. Углекислый газ содержится также в водах морей и океанов.
Углерод является составной частью каменного угля, бурого угля, торфа.
Он входит в состав нефти, торфа и природного газа.

В природе постоянно происходит круговорот углерода. Так, из атмосферы и природных вод углекислый газ поглощается зелёными растениями в процессе фотосинтеза, а образующийся в результате дыхания, брожения и гниения углекислый газ снова поступает в атмосферу и воды морей и океанов. Уголь, нефть и другие ископаемые при сжигании выделяют углекислый газ, который поступает в окружающую среду.
При разрушении пород, содержащиеся в них металлы, при действии атмосферного углекислого газа образуют осаждающиеся карбонаты. Большое количество углекислого газа выделяется при извержении вулканов.
Оксиды углерода
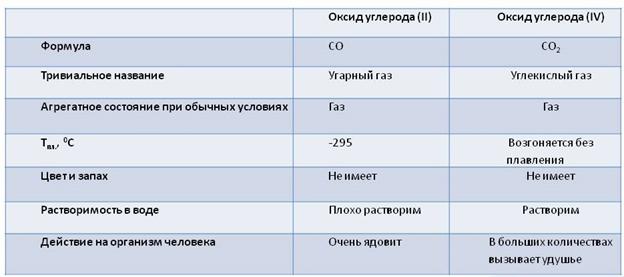
Углерод образует два оксида: оксид углерода (II) – CO и оксид углерода (IV) – CO2. Сравним свойства этих оксидов. Оксид углерода два или угарный газ является бесцветным газом, он не имеет запаха, малорастворим в воде. Ядовит. Температура плавления -205 0C. При дыхании он попадает в кровь и соединяясь с гемоглобином крови образует соединение – карбоксигемоглобин, которое не даёт гемоглобину переносить кислород. При вдыхании воздуха, в котором содержится одна десятая процента угарного газа, человек может потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива.
СО – несолеобразующий оксид. Он обладает восстановительными свойствами, так как углерод здесь находится в промежуточной степени окисления +2.
Оксид углерода два горит в кислороде с образованием оксида углерода (IV).
В этой реакции углерод повышает свою степень окисления с +2 до +4, а кислород понижает с 0 до -2. Поэтому углерод является восстановителем, а кислород окислителем. В этой реакции каждый атом углерода отдаёт по два электрона молекуле кислорода.
2С0 + О2 0(нед) = 2С+2О-2
Кроме этого, оксид углерода (II) восстанавливает металлы из их оксидов. Например, в реакции оксида железа (III) с оксидом углерода (II), СО отнимает кислород от железа, при этом образуется железо и углекислый газ.
Fe2+3O3 + 3C+2O = 2Fe0 + 3C+4O2↑
В этой реакции железо понижает свою степень окисления с +3 до 0, а углерод повышает с +2 до +4, при этом каждый атом углерода отдаёт по два электрона атомам железа. Углерод выступает в роли восстановителя, а железо в роли окислителя.
Оксид углерода (IV) – СО2 – углекислый газ не имеет запаха, бесцветный, в полтора раза тяжелее воздуха, при обычных условиях в одном объёме воды растворяется один объём углекислого газа. При давлении около шестидесяти атмосфер углекислый газ превращается в бесцветную жидкость. При испарении этой жидкости получается снегообразная масса, которую называют «сухой лёд», используемый для хранения пищевых продуктов. В больших количествах он вызывает удушье. Углекислый газ не горит и не поддерживает горение.


Оксид углерода (IV) – кислотный оксид. Он реагирует со щелочами. Например, в реакции с известковой водой (Ca(OH)2), известковая вода мутнеет, потому что образуется соль – карбонат кальция (CaCO3). Эта реакция является качественной реакцией на углекислый газ.
CO2 + Ca(OH)2 = CaCO3↓ + H2O

Оксид углерода четыре взаимодействует и с основными оксидами. Например, в реакции с оксидом магния (MgO) образуется соль – карбонат магния (MgCO3).
CO2 + MgO = MgCO3
При растворении углекислого газа в воде образуется слабая неустойчивая угольная кислота (H2CO3).
CO2 + H2O ↔ H2CO3
Углекислый газ не горит, но магний продолжает гореть в углекислом газе с образованием оксида магния и выделением углерода в виде сажи (C).
CO2 + 2Mg = 2MgO + C
В промышленности углекислый газ получают обжигом известняка (CaCO3):
CaCO3 = CaO + CO2↑ (t)
В лаборатории углекислый газ получают действием соляной кислоты (HCl) на карбонат кальция (CaCO3):
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O

Углекислый газ используют для изготовления шипучих напитков и получения соды, для создания «дыма» на сцене, для хранения мороженого, в пенных огнетушителях.




Сравнительна таблица оксидов углерода
Таким образом, углерод элемент IV A группы, на внешнем энергетическом уровне у него четыре электрона, для углерода характерны степени окисления -4, +2, +4. В реакциях с кислородом и оксидами металлов он проявляет восстановительные свойства, а в реакциях с металлами, водородом – окислительные свойства. Наиболее известными аллотропными модификациями углерода являются алмаз и графит. В природе углерод встречается в свободном виде и в виде соединений, главным образом карбонатов. Углерод образует два оксида – оксид углерода (II) и оксид углерода (IV). Углерод и его соединения находят широкое применение во многих областях народного хозяйства.

 Получите свидетельство
Получите свидетельство Вход
Вход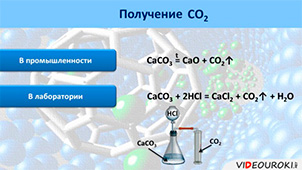



 0
0 17580
17580

