Первые представители класса одноатомных спиртов – жидкости. Начиная со спирта, содержащего 12 и более атомов углерода – это твёрдые вещества. Газы среди спиртов отсутствуют. Низшие спирты обладают характерным алкогольным запахом, спирты, стоящие в середине гомологического ряда, имеют сильный и неприятный запах, высшие спирты, как правило, не имеют запаха.
Спирты, содержащие от одного до трёх атомов углерода, смешиваются с водой в любых соотношениях, средние спирты ограничено растворимы в воде.
С увеличением относительной молекулярной массы растворимость спиртов в воде уменьшается. Большинство спиртов растворимы в органических растворителях.
Спирты имеют более высокие температуры кипения по сравнению с алканами со схожей относительной молекулярной массой. Например, температура кипения этанола 78 0С, а пропана – -42 0С.
Высокие температуры кипения и отсутствие газов среди спиртов можно объяснить наличием межмолекулярных водородных связей. Из-за наличия у одной молекулы спирта частичного положительного заряда на атоме водорода, а на другой молекуле неподелённой пары электронов на атоме кислорода, образуются межмолекулярные водородные связи. Получается, что молекулы спиртов находятся в ассоциированном состоянии. Графически водородную связь изображают в виде трёх точек.
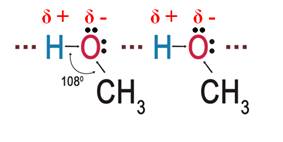
Кроме этого, образованием межмолекулярных связей между молекулами спиртов и молекулами воды, объясняется хорошая растворимость низших спиртов.
Химические свойства спиртов обусловлены также наличием в составе гидроксильных групп. Связь между атомом кислорода и водорода в гидроксильной группе сильно поляризована из-за смещения электронной плотности к кислороду. Атом водорода, при этом, становится более подвижным и легко отщепляется в виде протона. Поэтому спирты проявляют кислотные свойства. Кроме этого, из-за наличия неподелённой пары электронов на атоме кислорода, спирты проявляют свойства оснований. Таким образом, спирты являются слабыми кислотами и основаниями средней силы.
Спирты реагируют с активными металлами с образованием алкоголятов и водорода. Так, в реакции этанола с натрием образуется этанолят натрия и водород. Данная реакция относится к реакциям замещения, при этом происходит замещение атомов водорода на атомы металла.
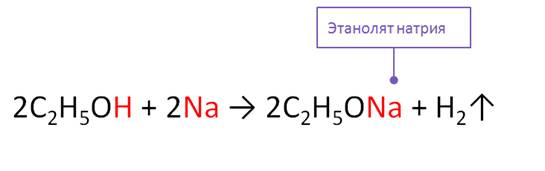
Алкоголята легко разлагаются водой. При взаимодействии этанолята натрия с водой образуется этанол и гидроксид натрия.
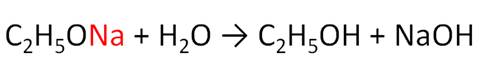
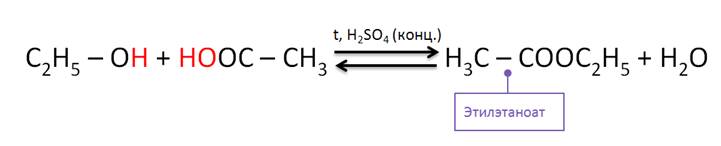
Спирты реагируют с карбоновыми и кислородсодержащими минеральными кислотами. В реакции спиртов с карбоновыми кислотами от молекулы спирта отщепляется атом водорода, а от молекулы карбоновой кислоты – гидроксильная группа. Так, в реакции этанола с уксусной кислотой образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты. Данные реакции являются обратимыми и протекают в присутствии концентрированной серной кислоты при нагревании. Реакции спиртов с карбоновыми кислотами называются реакциями этерификации.
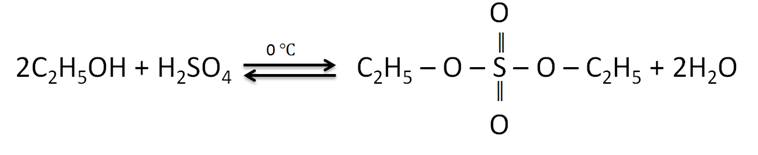
В реакциях спиртов с кислородсодержащими минеральными кислотами образуются сложные эфиры этих кислот. Так, в реакции этанола с серной кислотой образуется диэтилсульфат.
Для спиртов характерно взаимодействие с галогеноводородами с образованием галогеналканов. В этих реакциях в спиртах разрывается связь между углеводородным радикалом и гидроксильной группой. Например, в реакции этанола с бромоводородом образуется бромэтан и вода. Эта реакция является также обратимой. В этой реакции проявляются слабые основные свойства спирта.
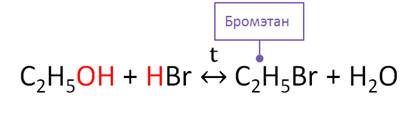
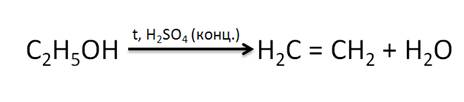
Для спиртов характерна дегидратация под действием концентрированной серной кислоты при нагревании свыше 140 0С, при этом образуются алкены. Так, в результате дегидратации этанола образуется этен.
Для спиртов характерны реакции окисления. Спирты горят на воздухе или в кислороде не коптящим пламенем с выделение большого количества теплоты. При горении этанола образуется оксид углерода (IV) и вода.
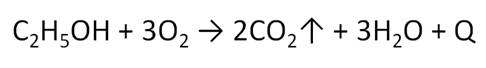
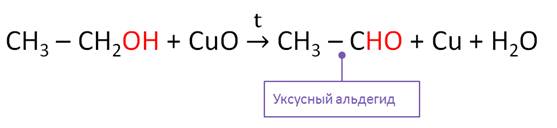
Под действием более слабых окислителей происходит частичное окисление спиртов. Если в пробирку с этанолом опустить спираль, покрытую чёрным налётом оксида меди (II), то чёрный налёт на проволоке исчезнет и в пробирке почувствуется запах образовавшегося альдегида. Так, при окислении этанола оксидом меди (II) образуется уксусный альдегид.
Рассмотрим основные способы получения спиртов. Одним из наиболее важных способов получения спиртов является гидратация алкенов. Например, этанол получают гидратацией этилена при повышенной температуре, повышенном давлении и в присутствии катализатора. Полученный таким образом этанол называют синтетическим.
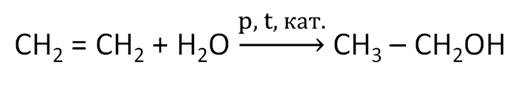
В пищевой промышленности этанол получают при спиртовом брожении глюкозы под действием ферментов. Полученный таким образом этанол используют для изготовления спиртных напитков.
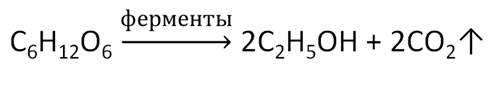
Гидролизный спирт получают из целлюлозы, которую подвергают гидролизу до образования глюкозы, которую затем подвергают брожению.
В промышленности метанол получают из синтез-газа в присутствии катализатора.
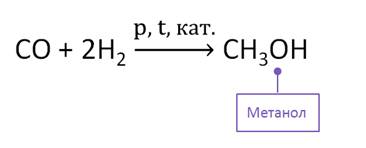
Спирты можно получить и при гидролизе моногалогеналканов с водными растворами щелочей.
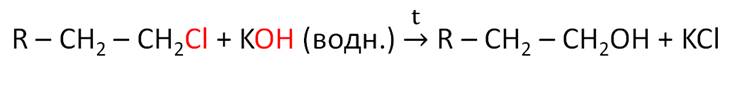
Таким образом, на физические свойства спиртов оказывает влияние водородная связь. Кислотно-основные свойства спиртов обусловлены наличием функциональной группы. Спирты взаимодействуют со щелочными металлами, галогеноводородами, карбоновыми и минеральными кислотами, вступают в реакции дегидратации и окисления. В промышленных масштабах этанол получают гидратацией этена, в процессе спиртового брожения глюкозы. Метанол получают из синтез-газа. В лаборатории спирты получают в процессе щелочного гидролиза моногалогеналканов.

 Получите свидетельство
Получите свидетельство Вход
Вход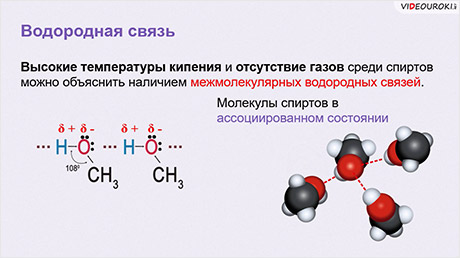



 0
0 7097
7097

