Все химические реакции делятся на обратимые и необратимые. Необратимые реакции – это реакции, которые идут только в одном направлении. Необратимыми являются реакции горения (например, реакция горения метана), большинство реакций тэрмического разложения сложных веществ (например, реакция разложения перманганата калия), необратимыми являются большинство реакций, в результате которых образуется газ (например, реакция карбоната калия с серной кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом серебра один), или если образуется малодиссоциирующее вещество (например, в реакции азотной кислоты и гидроксида натрия).
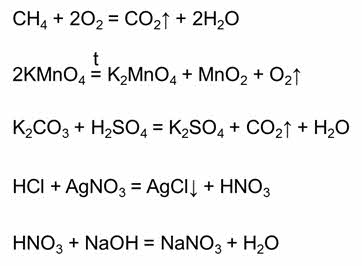
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.
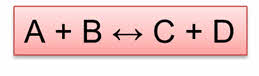
Реакция образования веществ Цэ и Дэ является прямой, а реакция образования А и Бэ является обратной.

Обратимыми являются также реакции этэрификации – это реакции взаимодействия карбоновых кислот со спиртами.
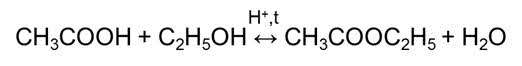
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.
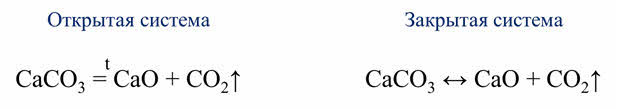
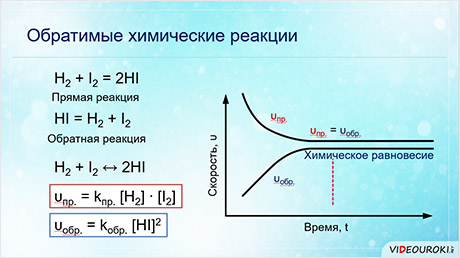
Обратимой является реакции синтеза йодоводорода из водорода и йода.
После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
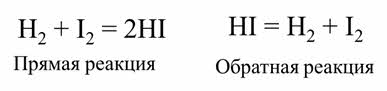
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.
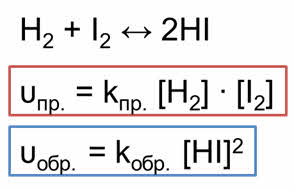
Скорость обратной реакции будет равна концентрации йодоводорода взятой в квадрате.
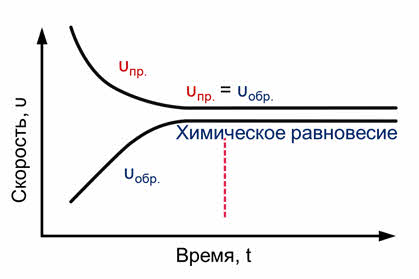
Постепенно скорость прямой реакции уменьшается, потому что водород и йод начинают реагировать и их концентрации уменьшаются.
Скорость же обратной реакции увеличивается, потому что концентрация образующегося йодоводорода увеличивается. Как только скорость прямой реакции окажется равной скорости обратной реакции, наступит химическое равновесие. Это равновесие считается динамическим, так как идут и прямая, и обратная реакции, скорости их также равны, а значит и концентрации веществ не изменяются. То есть их концентрации являются равновесными.
Если рассмотреть реакцию образования веществ Цэ и Дэ из А и Бэ, то скорость прямой реакции будет равна произведению равновесных концентраций А и Бэ с учётом их стехиометрических коэффициентов.
Скорость обратной реакции будет равна произведению равновесных концентраций Цэ и Дэ с учётом их стереохимических коэффициентов.
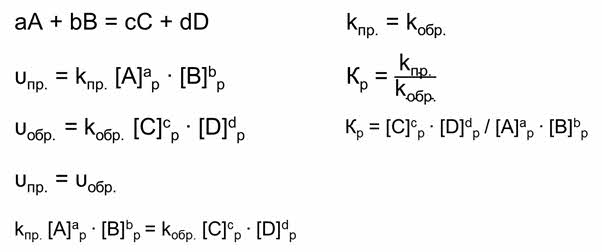
Так как в состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции, то предыдущие выражения можно приравнять.
Константа скорости прямой и обратной реакции является величиной постоянной. А отношение констант скоростей прямой и обратной реакции является величиной постоянной, которая называется константой равновесия.
Константа равновесия зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Катализатор также не влияет на константу равновесия, но уменьшает время достижения равновесия.
Химическое равновесие является подвижным. То есть изменения внешних условий ведёт к смещению или сдвигу химического равновесия. Состояние же химического равновесия при неизменных внешних условиях может сохраняться бесконечно долго. Для многих химических производств состояние равновесия является нежелательным, так как не приводит к нужному выходу продукции. И поэтому для таких химических реакций нужно создавать условия, когда равновесие будет смещаться в нужную сторону.
Направление смещения равновесия определяется принципом, который сформулировал французский учёный Ле Шатэлье в 1884 году.

А. Ле Шателье
(1850–1936)
Согласно этому принципу, если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На смещение химического равновесия влияют такие факторы, как концентрация реагирующих веществ, температура и давление.
Рассмотрим влияние концентрации на смещение химического равновесия. Как правило, при увеличении концентрации исходных веществ, равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции.
Так, в реакции получения оксида серы шесть из оксида серы четыре и кислорода, при увеличении концентрации оксида серы четыре равновесие смещается вправо, то есть в сторону прямой реакции.

Аналогично, при увеличении концентрации кислорода, равновесие смещается в сторону прямой реакции, то есть в сторону образования оксида серы шесть. При увеличении концентрации оксида серы шесть равновесие смещается в сторону обратной реакции, то есть влево.
Следовательно, при уменьшении концентрации оксида серы четыре и кислорода равновесие смещается влево, то есть в сторону обратной реакции, при уменьшении концентрации оксида серы шесть равновесие смещается в сторону образования оксида серы шесть, то есть в сторону прямой реакции.
Рассмотрим пример реакции взаимодействия хлорида железа три и роданида калия. В результате реакции образуется роданид железа три и хлорид калия. Эта реакция является обратимой. Если к хлориду железа три добавить роданид калия, то образуется раствор кроваво-красного цвета.
Разделим этот раствор на три равные части. В первую пробирку добавим роданид калия и раствор приобретает ещё более насыщенный кроваво-красный цвет, так как равновесие сместилось в сторону продуктов реакции. К третьей пробирки добавим твёрдый хлорид калия, раствор стал более светлым, то есть равновесие сместилось, в данном случае, в сторону исходных веществ.
Из этого опыта понятно, что при увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции, равновесие смещается в сторону исходных веществ.
Рассмотрим, как влияет изменение температуры на смещение химического равновесия. Для начала большинства химических реакций необходимо нагреть исходные вещества, чтобы частицы получили необходимую энергию. Однако скорость прямой и обратной реакции зависит от того, являются ли эти реакции экзотэрмическими или эндотэрмическими.
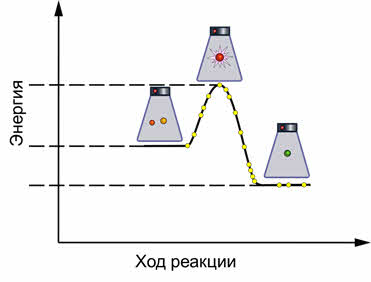
Как правило, увеличение температуры ведёт к увеличению скорости реакции. Для того, чтобы узнать как температура повлияет на смещение равновесия нужно знать тепловой эффект реакции. Так реакция превращения оксида азота четыре в его димер, является экзотэрмической.
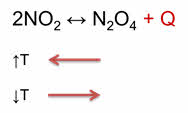
При увеличении температуры равновесие смещается в сторону эндотэрмической реакции, а при уменьшении температуры равновесие смещается в сторону экзотэрмической реакции.
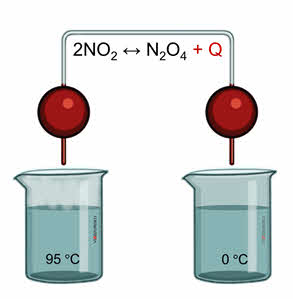
Для подтверждения этого проведём следующий эксперимент. В одну ёмкость нальём горячую воду, в другую – холодную. Опустим в две ёмкости колбы с бурым газом – оксидом азота четыре. Во второй колбе, которая опущена в холодную воду, газ бледнеет, так как оксид азота четыре переходит в его димер, который является бесцветным.
Как же влияет давление на смещение химического равновесия? Давление газов в системе при постоянной температуре определяется числом молекул газообразных веществ, или химическим количеством этих веществ. Поэтому для оценки влияния изменения давления необходимо подсчитать число молей газообразных веществ в левой и правой частях уравнения. При увеличении давления увеличивается концентрация газообразных веществ.
Например, в реакции синтеза аммиака из азота и водорода образуется 2 моль аммиака из исходных четырёх моль азота и водорода. Следовательно, было 4 объёма исходных веществ и образовалось 2 объёма аммиака. При увеличении давления объём уменьшается, поэтому идёт реакция образования аммиака. При уменьшении давления, объём увеличивается, что способствует реакции разложения аммиака на исходные вещества.
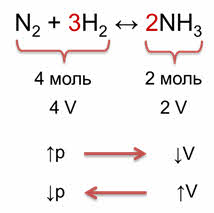
Таким образом, при увеличении давления равновесие смещается в сторону той реакции, при которой объём образующихся газообразных веществ уменьшается, и, наоборот, при уменьшении давления равновесие смещается в сторону той реакции, которая приводит к увеличению объёма. То есть, при увеличении давления равновесие смещается в сторону образования аммиака (вправо), а при уменьшении давления равновесие смещается в сторону исходных веществ (влево).
Катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакцию. То есть катализаторы только ускоряют наступление химического равновесия. Например, дрова быстрее загораются, если их порубить (то есть увеличить площадь поверхности соприкосновения реагирующих веществ; на сильном огне быстрее закипит вода (потому то увеличивается температура), смазанные маслом детали автомобилей не ржавеют, так как не будет доступа кислорода.

 Получите свидетельство
Получите свидетельство Вход
Вход




 26666
26666

