Водород. Вода
Водород – уникальный элемент: его располагают то в I A группе, где находятся щелочные металлы, то в VII A группе, где расположены галогены. Почему так?

Известно, что на внешнем энергетическом уровне у водорода 1 электрон, который он легко отдаёт, проявляя при этом восстановительные свойства и получая степень окисления +1. Эти особенности внешнего энергетического уровня и сближают водород со щелочными металлами.

![]()
Но атому водорода до завершения внешнего энергетического уровня также не хватает 1 электрона. А вы знаете, что первый энергетический уровень считается завершённым, если на нём 2 электрона. Поэтому водород может присоединить этот недостающий электрон, тогда он получит степень окисления -1 и проявлять он будет, тем самым, окислительные свойства.
![]()
Окислительные свойства водород проявляет в реакциях с металлами.

Молекула водорода двухатомна, как и молекулы галогенов, образована за счёт неполярной ковалентной химической связи.

При обычных условиях водород – газ, как фтор и хлор. Все эти особенности сближает водород с галогенами.
Следовательно, атом водорода в соединениях проявляет степень окисления +1 и -1. Положительная степень окисления характерна в соединениях с более электроотрицательным элементом, например в молекуле фтороводорода или воды.
![]()
А в соединениях с металлами – гидридах – степень окисления атома водорода -1, например в гидриде натрия, гидриде кальция.
![]()
Водород, как вы помните, встречается в природе в виде трёх нуклидов: протия, дэйтэрия и трития, которые отличаются между собой массовым числом.

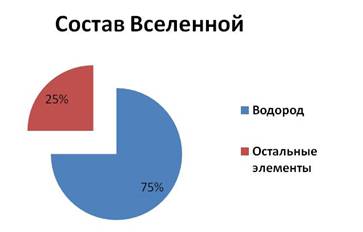
Водород является самым распространённым элементом во Вселенной. На долю этого элемента приходится около 75% массы Вселенной. Он входит в состав Солнца и многих других звёзд, а также туманностей. Большие планеты Солнечной системы Юпитер и Сатурн в основном состоят из водорода.


Среди элементов, существующих на Земле, водород – девятый по распространённости. Наиболее важным его соединением, встречающимся в природе, является – вода. Водород входит в состав природного газа, нефти, а также всех животных и растительных организмов. В виде простого вещества водород встречается крайне редко в вулканических газах.
А теперь о физических свойствах водорода.
· бесцветный нетоксичный газ
· без запаха и вкуса
· в четырнадцать с половиной раз легче воздуха. (Помните, молярная масса воздуха 29 г/ моль, а водорода – 2 г/моль). Поэтому водород собирают в перевёрнутый вверх дном сосуд.

· низкая температуры кипения ( -252,6 0С),
· низкая температура плавления (-259,2 0С).
· незначительно растворим в воде, благодаря этому его можно собирать методом вытеснения воды.
Водород при этом распознают по характерному глухому хлопку при поднесении горящей лучинки к сосуду с чистым водородом.

Помните, что смесь водорода с воздухом или кислородом называют «гремучим газом».
Французский химик Розье заинтересовался, что будет, если вдохнуть водород. Глубоко вдохнув, Розье выдохнул его на огонь свечи. Водород был смешан с воздухом и произошёл взрыв. Розье впоследствии писал: «Я думал, что у меня вылетят все зубы вместе с корнями». Поэтому проводить такие эксперименты опасно для жизни.

Интересно, что на отдельных планетах водород может существовать в твёрдом состоянии. Кристаллический водород получен на Земле, но при сверхвысоком давлении. Твёрдый водород проявляет металлические свойства.


В лаборатории водород получают взаимодействием соляной или разбавленной серной кислот с металлами, которые стоят в ряду напряжений до водорода. Чаще для этих целей используют цинк.
Для этого применяют аппарат Киппа или его аналог – прибор Кирюшкина.

В промышленности водород получают конверсией водяных паров с углём или метаном.

А теперь мы с вами получим водород. Для этого, нальём в пробирку серной кислоты и поместим туда гранулу цинка. При этом, мы можем наблюдать выделение газа.
Закроем отверстие пробирки большим пальцем на несколько секунд, а затем направим пробирку на пламя спиртовки. Мы с вами услышим глухой хлопок. Таким образом, мы доказали, что полученный газ – водород.
Простое вещество водород при взаимодействии с другими веществами может проявлять как окислительные, так и восстановительные свойства.
Водород как восстановитель, проявляет себя в реакции с простыми веществами неметаллами, образуя соединения, в которых его степень окисления равна +1.
Например, в реакции с кислородом, образуется вода. Водород повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2. В этой реакции водород является восстановителем, а кислород – окислителем.

Эту реакцию применяют при сварке и резке металлов из-за высокой температуры, сопровождающей эту реакцию.
Кроме этого, водород реагирует с галогенами. Реакция с хлором идёт при освещении. При этом образуется хлороводород. Водород повышает свою степень окисления с 0 до +1, а хлор понижает свою степень окисления с 0 до -1. Водород выступает в роли восстановителя, а хлор – в роли окислителя.

С азотом водород взаимодействует в присутствии катализатора при повышенной температуре и давлении, образуя аммиак. Здесь тоже водород повышает свою степень окисления с 0 до +1, а азот понижает степень окисления до -3. Поэтому водород – восстановитель, а азот – окислитель.

Восстановительные свойства водород проявляет не только в реакциях с простыми веществами, но и со сложными. Его можно использовать для восстановления металлов из их оксидов. Например, водород восстанавливает медь из её оксида. В этой реакции водород повышает также свою степень окисления до +1, а медь понижает до 0. Водород является восстановителем, а медь – окислитель.

Окислительные свойства водорода проявляются при его взаимодействии с металлами, в результате этих реакций образуются гидриды. В результате взаимодействия лития с водородом образуется гидрид лития. В этой реакции литий повышает свою степень окисления с 0 до +1, а водород, наоборот, понижает свою степень окисления с 0 до -1. Поэтому литий – восстановитель, а водород – окислитель.

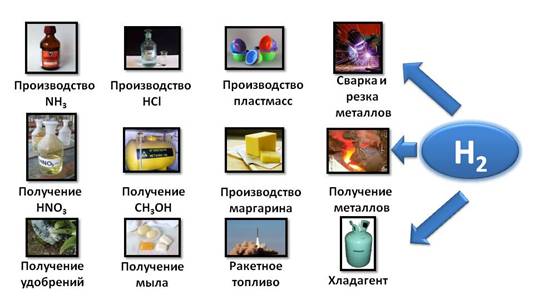
Области применения водорода очень разнообразны. Так, водород используется при производстве аммиака, который является сырьём для получения азотной кислоты и минеральных удобрений; в производстве хлороводорода, метанола, мыла и пластмасс, в пищевой промышленности при производстве маргарина, водород используют в качестве ракетного топлива, при сварке и резке металлов, при получении металлов и как хладагент.
Ещё в шеснадцатом веке было замечено, что при действии кислот на металл выделяется газ, который называли «горючим воздухом». Первооткрывателем водорода считается Кавендиш. Он собрал чистый водород, который получил действием серной и соляной кислот на цинк, железо и олово.

Затем позже Лавуазье доказал, что этот газ – вещество, а не «горючий воздух». Он и дал название этому элементу «водород», что означает рождающий воду.


Таким образом, водород имеет схожее строение с элементами I A и VII A группы, может проявлять как окислительные, так и восстановительные свойства, молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью. Водород находит широкое применение во многих областях промышленности.
А что же мы знаем о таком соединении водорода, как вода?
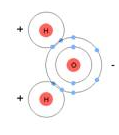
Молекула воды имеет угловое строение, входящие в её состав атомы образуют равнобедренный треугольник, в основании которого находятся два атома водорода, а на вершине – атом кислорода. Угол связи, таким образом, равен 104,5 0С.

В образовании химической связи участвуют по 1 электрону от каждого атома водорода и 2 неспаренных электрона от атома кислорода. Получается, что спаренные электроны у атома кислорода образуют две неподелённые пары электронов.

Связь в молекуле полярная за счёт большей электроотрицательности кислорода, на атоме кислорода появляется частичный отрицательный заряд, а на атомах водорода – частичный положительный заряд. Поэтому молекула воды представляет собой диполь.


Вода при обычных условиях является жидкостью. В такой жидкой воде происходит ассоциация молекул, то есть соединение их в более сложные структуры за счёт водородной химической связи.

Водородная химическая связь возникает между атомами водорода одной молекулы и атомами наиболее электроотрицательных элементов (фтора, кислорода, азота) другой молекулы.
Однако, это очень слабая связь, она в пятнадцать двадцать раз слабее ковалентной. И объясняет высокие температуры кипения воды, спиртов, фтороводорода, аммиака.
Вода может находиться в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Жидкая вода образует реки, моря, океаны, твёрдая вода – лёд и снег, газообразная – входит в состав воздуха.
При обычных условиях вода представляет собой прозрачную жидкость без вкуса и запаха. В тонких слоях она бесцветна, а в толстых имеет голубоватый цвет.
Температура плавления воды 0 0С, а температура кипения – 100 0С. Эта особенность объясняется наличием водородной связи.
Вода способна расширяться при замерзании и имеет максимальную плотность при температуре +4 0С. Поэтому при понижении температуры ниже 4 0С лёд занимает верхнюю поверхность водоёма и препятствует его промерзанию.
Вода обладает высокими значениями теплоты плавления и теплоты парообразования. Поэтому таяние льда и снега связано с большими тепловыми затратами. На испарение воды тоже тратится много энергии, поэтому вода сохраняется на земле в жидком состоянии.
Вода имеет высокую удельную теплоёмкость, то есть для нагревания 1кг воды нужно затратить много энергии. За счёт этого свойства на континентах не бывает резкого перепада температур. Теплоёмкость воды достигает минимального значения при 36-37 0С. Потому что она медленно нагревается и медленно остывает.
Плотность воды при нормальных условиях 1 г/см3, однако при переходе её из жидкого в твёрдое состояние плотность уменьшается. Так, плотность льда 0,91 г/см3 , поэтому он не тонет в воде.
Вода обладает высоким поверхностным натяжением. Благодаря чему она собирается в капли. Это же позволяет жуку-водомерке скользить по поверхности воды.

Исследуем поверхностное натяжение воды. Для этого положим на поверхность воды швейную иголку. Как видите, она находится на поверхности и не тонет. А затем положит её на поверхность воды, где предварительно растворили немного стирального порошка. В этом случае иголка опустилась на дно. Почему? Потому что порошок значительно снизил поверхностное натяжение.
Вода обладает вязкостью, причём с увеличением давления при температуре ниже 30 0С вязкость значительно уменьшается. Поэтому активность организмов, живущих в низкотемпературных средах, не сильно зависит от этих температур.
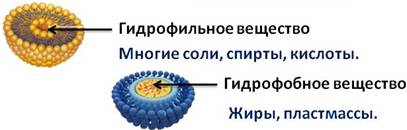
Вода – универсальный растворитель. По отношению к воде вещества делятся на два типа: гидрофильные и гидрофобные. Гидрофильные вещества хорошо растворимы в воде. К ним относятся многие соли, спирты, кислоты. А гидрофобные вещества – это вещества, которые плохо растворимы в воде. Это жиры, пластмассы.
Давайте посмотрим, как растворяется в воде перманганат калия. Для этого возьмём шпателем несколько кристаллов перманганата калия и добавим их в стакан с водой, а затем перемешаем стеклянной палочкой. Как видите, сначала кристаллы соли оказываются в центре «воронки», образуя малиновый смерч, а затем постепенно начинают растворяться.
При диссоциации перманганата калия образуется положительно заряженный ион калия и отрицательно заряженный перманганат-ион.
Перманганату калия соответствует марганцовая кислота (HMnO4), а марганцовой кислоте – оксид марганца (VII) – Mn2O7. В состав марганцовой кислоты входит атом металла – марганца в высшей степени окисления – +7
Рассмотрим химические свойства воды. Вода участвует в процессе фотосинтеза. Таким образом, из углекислого газа и воды, под действием света образуется глюкоза и выделятся в атмосферу кислород.

Вода вступает в химические реакции со щелочными металлами. При этом образуются щёлочи и выделяется водород. Так, в реакции взаимодействия натрия с водой, образуется щёлочь – гидроксид натрия и газ – водород.

Эта реакция замещения, но она также является и окислительно-восстановительной, потому что натрий повышает свою степень окисления с 0 до +1, а водород понижает степень окисления с +1 до 0. Натрий, таким образом, восстановитель, а водород – окислитель.
Вода реагирует с основными и кислотными оксидами, если образуется щёлочь или кислородсодержащая кислота.
Например, с оксидом калия вода образует растворимое основание – гидроксид калия, а с оксидом серы (VI) образует серную кислоту.

Для воды характерна реакция разложения, её еще называют электролизом воды. Она протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород.

 n
n
Эта реакция является окислительно-восстановительной, водород понижает свою степень окисления с +1 до 0 и является окислителем, а кислород, наоборот, повышает свою степень окисления с -1цы до 0 и является восстановителем.
Вода разлагает некоторые неорганические и органические вещества. Этот процесс называется гидролизом. Например, при гидролизе сульфида алюминия образуется гидроксид алюминия – нерастворимое в воде основание и газ – сероводород.
![]()
Интересно, что вода также образует и кристаллогидраты. Например: CuSO4 ∙ 5H2O – это медный купорос, Na2CO3 ∙ 10H2O – это кристаллическая сода, а CaSO4 ∙ 2H2O – гипс.
Проведём лабораторный опыт по гидратации обезвоженного сульфата меди два.
Поместим в пробирки немного обезвоженного сульфата меди (II), а затем прильём сюда немного воды. Постепенно раствор приобретает голубую окраску. Таким образом, негидратированный ион меди (II) бесцветный, а гидратированный ион меди (II) – голубой.
Запомните, что молекула воды имеет угловое строение и представляет собой диполь, она обладает рядом униальных свойств, в химических реакциях проявляет окислительные и восстановительные свойства.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 11289
11289