Ацетилен при обычных условиях – газ, не имеет запаха. Он плохо растворим в воде и в органических растворителях, за исключением ацетона. При увеличении относительной молекулярной массы алкинов идёт увеличение температуры кипения.
Для алкинов характерны реакции присоединения. Это реакции электрофильного присоединения. Они присоединяют галогены. Присоединение идёт в две стадии: сначала разрывается одна π-связь, затем на второй стадии – другая. Так, ацетилен обесцвечивает раствор брома в тетрахлорметане. На первой стадии присоединения образуется 1,2-дибромэтен, на второй – 1,1,2,2-тетрабромэтан.
Присоединение водорода – реакция гидрирования идёт при нагревании и в присутствии катализатора. При присоединении водорода к бутину-1, на первой стадии образуется бутен-1, на второй – бутан.
CH ≡ C – CH2 – CH3 + H2 CH2 = CH – CH2 – CH3 CH3 – CH2 – CH2 – CH3
Присоединение воды к ацетилену идёт в кислой среде и в присутствии катализатора – соли ртути. Эта реакция называется ещё реакцией Кучерова.
В результате реакции гидратации ацетилена образуется неустойчивый виниловый спирт, который затем переходит в уксусный альдегид.
Михаил Григорьевич Кучеров – русский химик-органик, известный своей именной реакцией и сделавший значительные открытия в теоретической и прикладной химии. Химическим отделением Русского физико-химического общества в 1915 году была учреждена «Премия имени профессора М. Г. Кучерова» для начинающих химиков.
В случае алкинов с более длинной цепью в соответствии с правилом Марковникова будет происходить образование енола с гидроксигруппой при менее гидрированном атоме углерода (водород присоединяется к крайнему атому углеродной цепи). Такие енолы превращаются в кетоны:
Для алкинов характерны реакции присоединения галогеноводородов. Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идёт в две стадии, причём на обеих стадиях выполняется правило Марковникова.
Так, в реакции бутина-1 с хлороводородом образуется 2,2-дихлорбутан.
CH ≡ C – CH2 – CH3 + 2HCl → CH3 – CCl2 – CH2 – CH3
При пропускании ацетилена над активированным углём при 500 происходит образование бензола. Впервые подобную реакцию в 1866 году осуществил М. Бертло. При нагревании ацетилена до 600 °С ему удалось получить небольшое количество бензола. Спустя 60 лет русский химик Н. Д. Зелинский обнаружил, что катализатором данной реакции является углерод (активированный уголь). Даже при более низкой температуре в присутствии активированного угля скорость реакции значительно возрастала, а выход бензола увеличивался до 90%. С тех пор эта реакция носит имя Зелинского.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей меди (I) образуется винилацетилен.
При полном окислении – горении ацетилена образуется углекислый газ и вода.
2C2H2 + 5O2 → 4CO2↑ + 2H2O
На этой реакции основано действие кислород-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000 °С), что позволяет использовать её для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, так как содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленный раствор перманганата калия. При этом происходит разрушение кратной связи.
В промышленности ацетилен раньше получали нагреванием метана. В 1868 году французский химик М. Бертло получил ацетилен, пропуская через метан электрический разряд:
2CH4 HC ≡ CH + 3H2↑
В настоящее время ацетилен получают окислительным пиролизом:
6CH4 + O2 2HC ≡ CH + 2CO + 10H2↑
Особенность этого метода состоит в том, что в реактор вводится расчётное количество кислорода. Помимо ацетилена в качестве продуктов реакции образуется оксид углерода (II) и водород, которые могут быть использованы для синтеза спиртов или синтетического бензина.
В лаборатории ацетилен получают обработкой карбида кальция с водой.
CaC2 + 2H2O → HC ≡ CH + Ca(OH)2
Сам карбид кальция получают сплавлением оксида кальция и угля в электропечах. А оксид кальция образуется при обжиге (термическом разложении) карбоната кальция.
CaO + 3C CaC2 + CO
Дегидрогалогенирование. При воздействии на дибромпроизводное, в котором атомы галогенов находятся при соседних атомах углерода (или при одном и том же атоме), спиртового раствора щёлочи происходит отщепление двух молекул галогеноводорода (дегидрогалогенирование) и образование тройной связи:
Ацетилен с кислородом используют для сварки и резки металлов. В настоящее время ацетилен мало используют для получения различных органических веществ. В 40-50-х годах прошлого столетия его заменили на более дешёвый – этилен.
Алкины являются сырьём для производства большого количества органических соединений и материалов: альдегидов, кетонов, растворителей (тетрагалогенэтанов), исходных веществ для получения синтетических каучуков, поливинилхлорида и других полимеров. Ацетилен — ценнейшее горючее с очень высокой теплотой горения.

 Получите свидетельство
Получите свидетельство Вход
Вход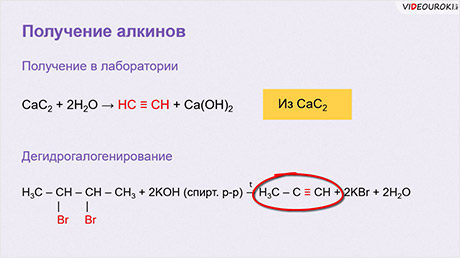



 0
0 8397
8397

