Все растворимые в воде вещества делят на две группы: электролиты и неэлектролиты. Электролиты – это вещества, которые в растворе или расплаве распадаются на ионы. А неэлектролиты – это вещества, которые не распадаются на ионы в растворе или расплаве.
Электролитами являются: KOH, Na2SO4, CH3COOH, HF, CaCl2 и другие. Неэлектролитами являются: метан, ацетон, бензол, этаналь, этанол.
Распад электролитов на ионы при растворении или расплавлении называется электролитической диссоциацией.
Электролиты могут распадаться на ионы полностью или частично. Поэтому количественной характеристикой этого процесса является степень диссоциации. Степень диссоциации (α) равна отношению числа молекул, распавшихся на ионы, к общему числу растворённых молекул:
α = N расп. / N общ..
Степень диссоциации также можно выразить через количество вещества, распавшегося на ионы к общему количеству вещества:
α = n расп. / n общ..
Степень диссоциации выражают в долях единицы или в процентах, поэтому она может быть от нуля (диссоциации нет) до 1 (полная диссоциация).
Степень диссоциации зависит от природы электролита и растворителя, его концентрации в растворе и температуры, стадии процесса диссоциации, добавки электролитов.
Например, сильные электролиты – это вещества с ионным или сильнополярным типом связи, поэтому они хорошо растворяются в таких растворителях, как вода или раствор аммиака.
С ростом температуры степень диссоциации увеличивается. Если рассматривать многоступенчатую диссоциацию, то каждая последующая стадия диссоциации примерно в 1000 раз слабее предыдущей.
Введение в раствор одноименных ионов ослабляет диссоциацию. Так, диссоциация уксусной кислоты ослабится при добавлении сильных кислот (увеличивается количество ионов водорода) или ацетата натрия (повышается концентрация ацетат-ионов):
СH3COOH ↔ CH3COO- + H+
CH3COONa → CH3COO- + Na+
HCl → H+ + Cl-.
Электролиты условно делят на две группы: сильные и слабые.
К сильным электролитам относят кислоты: HCl, HBr, HI, H2SO4 (разб.), HNO3 (разб.), HClO4, HMnO4, щёлочи, растворимые соли. К слабым электролитам относятся все остальные кислоты, нерастворимые основания, NH4OH, Н2О, нерастворимые соли.
Сильные кислоты почти полностью диссоциируют с образованием положительно заряженного иона водорода и отрицательно заряженного иона кислотного остатка:
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-.
Сильные основания (щёлочи) диссоциируют с образованием отрицательно заряженного гидроксид-иона и положительного иона металла:
NaOH → Na+ + OH-
Ba(OH)2 → Ba2+ + 2OH-.
Растворимые в воде соли диссоциируют с образованием положительного иона металла и отрицательного иона кислотного остатка:
Ca(NO3)2 → Ca2+ + 2NO3-
Al2(SO4)3 → 2Al3+ + 3SO42-.
Слабые электролиты обратимо диссоциируют на ионы:
HF ↔ H+ + F-
NH4OH ↔ NH4+ + OH-.
Cлабые многоосновные кислоты отщепляют ионы водорода последовательно и на каждой последующей стадии степень диссоциации намного меньше, чем на предыдущей. Так, при диссоциации фосфорной кислоты образуется три кислотных остатка, а при диссоциации угольной – два. Поэтому фосфорная и угольная кислоты могут образовывать средние и кислые соли:
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
HPO42- ↔ H+ + PO43-
H2CO3 ↔ H+ + HCO3-
HCO3- ↔ H+ + CO32-.
Кислые соли диссоциируют постадийно, первая стадия при этом является необратимой:
NaHCO3 → Na+ + HCO3-
HCO3- ↔ H+ + CO32-.
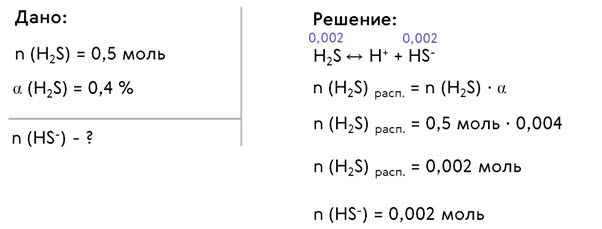
Решим задачи. Определим количество анионов HS- в растворе, содержащем 0,5 моль H2S, если степень диссоциации кислоты по первой ступени равна 0,4 % (диссоциацией по второй ступени можно пренебречь).
Раствор сульфата металла (степень окисления +1) массой 100 г с массовой долей соли 14,2 % содержит в сумме 0,3 моль ионов соли. Считая диссоциацию полной, определите металл.
По условию задачи нам известна масса раствора соли и её массовая доля, а также суммарное количество молей ионов. Определить нужно металл.

Определите степень диссоциации азотистой кислоты в растворе, содержащем 0,3 моль ионов NO2- и 1 моль её молекул.


 Получите свидетельство
Получите свидетельство Вход
Вход




 2964
2964

