Представьте себе электронную структуру атома: область наибольшего вероятного нахождения электрона называется электронным облаком. В каждом электронном облаке может находиться не более двух электронов и обязательно с различными спинами. Электронные облака различаются по размерам, форме и ориентацией в пространстве.
Два атома образуют ковалентную связь, тогда перекрываются их внешние электронные оболочки и суммарная энергия понижается до минимума. Такую связь называют одинарной, или σ-связью.

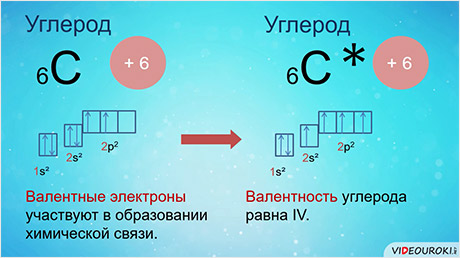
А теперь рассмотрим строение изолированного атома углерода. Представьте, что в начале координат находится ядро. Первая орбиталь, которая начинает заполняться электронами, называется 1s-орбиталью, на ней находится два спаренных электрона. Следующая по энергии 2s-орбиталь, содержит два спаренных электрона, она имеет больший радиус. Далее начинают заполняться р-орбитали, они взаимно перпендикулярны. Таким образом, электронная структура атома углерода 1s2 2s2 2p2.

На внешнем энергетическом уровне у атома углерода 4 электрона, одна р-орбиталь осталась незаполненной. Обратите внимание: электроны внешнего слоя неравноценны. Нас интересуют только валентные электроны, так как только эти электроны участвуют в образовании химической связи. Если атому углерода дать дополнительную энергию, то электроны с 2s-подуровня могут переходить на более высокий 2р-подуровень и у атома углерода появиться 4 неспаренных электрона, и он может проявлять валентность, равную четырём, то есть образовывать 4 химические связи. В органических соединениях атом углерода всегда четырёхвалентен.

Рассмотрим образование молекулы метана. Атом углерода имеет 4 неспаренных электрона, а у каждого атома водорода есть по одному неспаренному электрону. В образовании химической связи участвует 1s-орбиталь атома водорода и 1s- и 3р-орбитали атома углерода. Таким образом, мы получаем 4 связи: одна из них σ-связь образуется s-орбиталью атома углерода и s-орбиталью атома водорода. Оставшиеся связи образуются при перекрывании s-орбитали атома водорода и р-орбиталями атома углерода с образованием σ-связей. Эти связи отличаются по энергии и длине, но в молекуле метана все связи равноценны.

Это можно объяснить гибридизацией электронных облаков. Гибридизация – это выравнивание орбиталей по форме и энергии.
То
есть из s-
и р-орбиталей получается гибридная орбиталь. Гибридная орбиталь при
этом имеет форму неправильной восьмёрки. Таким образом, получается четыре
равноценные связи между s-орбиталями атомов водорода и гибридными орбиталями
атома углерода. Такой тип гибридизации называется sp3-гибридизацией.
Получившиеся гибридные орбитали располагаются под
углом 109 ´
и направлены в вершины тетраэдра. Поэтому молекула метана имеет тетраэдрическое
строение. Этот тип гибридизации характерен для алканов,
или насыщенных углеводородов.
´
и направлены в вершины тетраэдра. Поэтому молекула метана имеет тетраэдрическое
строение. Этот тип гибридизации характерен для алканов,
или насыщенных углеводородов.

Связь между атомом углерода и водорода обозначается либо парой электронов, либо чёрточкой. Если нарисовать образование связей с помощью перекрывания облаков, то получается в центе ядро атома, 4 равноценные гибридные орбитали атома углерода и s-орбитали атома водорода.

Есть
и другие формы гибридизации. Например, sp2-гибридизация.
Если в гибридизации участвует не 3р, а только 2p-электрона и 1s-электрон, то образуется три
равноценных sp2-гибридных
орбитали, которые располагаются симметрично в
плоскости под углом 120 ,
а незатронутое гибридизацией р-облако располагается перпендикулярно этой
плоскости. Эта негибридная орбиталь участвует в
образовании π-связи.
,
а незатронутое гибридизацией р-облако располагается перпендикулярно этой
плоскости. Эта негибридная орбиталь участвует в
образовании π-связи.

Атомы углерода при этом образуют между собой двойную связь: прочную σ-связь и менее прочную π-связь. Этот тип гибридизации есть в молекуле этилена. Таким образом, в молекуле этилена 5 σ-связей. При чём, в двойной связи одна чёрточка обозначает σ-связь, другая – π-связь.

Если
в гибридизации участвует 1s
и
одна р-орбиталь, то образуется 2 равноценные sp-орбитали, расположенные под углом 180 Они
находятся на одной оси. Эти гибридные sp-орбитали
участвуют в образовании σ-связи, две р-орбитали негибридизированы и располагаются во взаимно
перпендикулярных плоскостях. Они перекрываются с такими же орбиталями другого
атома, образуя 2 π-связи.
Они
находятся на одной оси. Эти гибридные sp-орбитали
участвуют в образовании σ-связи, две р-орбитали негибридизированы и располагаются во взаимно
перпендикулярных плоскостях. Они перекрываются с такими же орбиталями другого
атома, образуя 2 π-связи.

Между атомами углерода и водорода образуются σ-связи. Такой тип гибридизации есть в молекуле ацетилена. Здесь 3 σ-связи и 2 π-связи.

Таким образом, sp3-гибридизация атома углерода в молекуле, если он связан с четырьмя атомами, sp2-гибридизация атома углерода в молекуле, если он связан с тремя атомами, при этом есть двойная связь, sp-гибридизация атома углерода, если он образует связь с двумя атомами, при этом есть ещё тройная связь.
Потренируемся определять вид гибридизации. Перед нами молекула углеводорода.
СН ≡ С – СН = С = СН – СН3
Первый атом углерода имеет тройную связь, это значит, что 3 из 4 орбиталей не участвуют в гибридизации, остаётся только 1 гибридная орбиталь, поэтому этот атом углерода находится в состоянии sp-гибридизации. Второй атом тоже имеет 2 π-связи, значит только 2 орбитали гибридизируются и образуется sp-гибридизация. Третий атом углерода имеет двойную связь, значит у него есть π-связь, поэтому только 3 орбитали участвуют в гибридизации, поэтому это sp2-гибридизация. Четвёртый атом углерода имеет 2 π-связи, потому что здесь у него две двойные связи, поэтому этот атом углерода находится в состоянии sp-гибридизации. Следующий атом углерода имеет 1 π-связь, следовательно, 3 орбитали являются гибридными, значит это sp2-гибридизация. Последний атом углерода не имеет π-связей, значит все 4 орбитали участвуют гибридизации, поэтому у него sp3-гибридизация.

Таким образом, в органических соединениях атом углерода четырёхвалентен за счёт перехода электронов с s- на p-подуровень. Атом углерода в органических соединениях может находиться в состоянии sp3-, sp2- и sp-гибридизации.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 13967
13967

