Органические реакции имеют специфические особенности.
Во-первых, большинство реакций в неорганической химии протекают в водных растворах и очень быстро. Органические же реакции идут медленнее, часто требуют более жёстких условий (температура, давление, участие катализатора).
Во-вторых, органические реакции протекают в несколько стадий, из-за чего дают невысокий выход продукта.
В-третьих, в органических уравнениях реакций, вместо знака равенства ставится стрелка, на которой записываются условия протекания реакций.
В-четвёртых, в органических реакциях, которые идут в живых организмах, изменению подвергается не вся молекула, а только её часть, так называемые реакционные центры молекулы.
Любую химическую реакцию можно рассматривать как процесс разрыва химических связей в исходных соединениях и образования новых связей в конечных продуктах. В ходе этого процесса обычно затрагивается не вся молекула, а только её часть – реакционный центр, которым можно считать функциональную группу или кратную связь.
Для написания уравнения органической реакции нужно знать её механизм.
Механизм реакции – это описание её пути, то есть последовательность элементарных стадий, через которые проходят реагенты, превращаясь в продукты реакции.
По механизму разрыва ковалентной связи в исходном соединении различают радикальный (гомолитический) разрыв ковалентной связи и ионный (гетеролитический) разрыв ковалентной связи.
Радикальный (гомолитический) разрыв ковалентной связи (гомолиз) – от греческого homos – «равный», «одинаковый» и lysis – «растворение», «распад» − заключается в том, что происходит симметричный разрыв ковалентной связи, то есть разрывается общая электронная пара и у каждой образующейся частицы остаётся по одному неспаренному электрону. Образовавшиеся частицы называются радикалами. Например, радикалами являются частицы •СН3, •Сl, •СН3СН2 и другие. Такому радикальному, или гомолитическому разрыву обычно подвергаются неполярные или малополярные ковалентные связи (С – С, С – Н, Cl – Cl, N – N, Br – Br).

Радикальный разрыв ковалентной связи осуществляется при определённых условиях (высокая температура, действие света, радиоактивное облучение).
Таким образом, радикалы – это частицы с неспаренными электронами на внешних орбиталях, обладающие высокой реакционной способностью.
Ионный, или гетеролитический разрыв ковалентной связи (гетерозис) от греческого heteros – «другой», «иной» и lysis – «распад» − заключается в том, что происходит несимметричный разрыв связи. Частица А теряет электрон, который был предоставлен ею для образования общей электронной пары, связывающей атомы или частицы, преобретает положительный заряд и превращается в катион А+ (электрофил). Частица В, захватывает чужой электрон и превращается в отрицательно заряженный ион – анион – В- (нуклеофил). Таким образом, происходит гетеролитический разрыв ковалентной связи.

К гетеролитическому разрыву склонны полярные и легко поляризуемые связи, кроме этого, такому разрыву способствуют и полярные растворители. Примером гетерозиса служит разрыв ковалентной связи в молекуле йодметана.
CH3I → CH3+ + I-
Cуществует несколько классификация органических реакций. Перая классификация по механизму реакции, то есть по разрыву ковалентной связи. Это гомолитические, или радикальные реакции, которые идут с образованием радикалов – частиц с неспаренным электроном. Их течение сопровождается гомолитическим разрывом связи.
Например, гомолотической реакцией являетяс реакция хлорирования алканов, которая идёт по свободнорадикальному цепному механизму. Цепной она является потому, что идёт через определённую последовательность стадий, когда каждая последующая стадия инициируется предыдущей.

Гетеролитические, или ионные реакции протекают с образованием катиона и аниона, когда оба электрона переходят на орбиталь одного из атомов продукта реакции. Гетеролитчсекий разрыв ковалентной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов).
В зависимости от природы атакующегог реагента реакции могут быть нуклеофильными и электрофильными.
Нуклеофильными являются реакции, где реагентом является нуклеофил, то есть анион или молекула, которые предоставляют свою пару электронов на образование новой связи.
Например, в реакции бромэтана с гидроксидом натрия гидроксид натрия выступает в роли нуклеофильного реагента.
CH3 – Br + Na+OH- → CH3 – OH + Na+Br-
Электрофильными называются реакии с электрофильными реагентами (электрофилами), то есть катионами или молекулами, которые имеют свободную орбиталь, которая может принять электроны для образования новой связи.
Так, в реакции нитрирования бензола электрофилом является катион нитрония.

По направлению и конечному продукту орагнические реакции делятся на: реакции замещения, присоединения, отщепления (элиминирования), окисления и восстановления.
Реакции замещения протекают с заменой атома или группы атомов на другой атом или группу. В результате данных реакций образуются два различных продукта. Это реакции галогенирования и нитрирования алканов, этерификации и алкилирования карбоновых кислот.
Например, при бромировании этана один атом брома замещает один атом водорода в алкане и образуются два новых продукта – бромэтан и бромоводород. В реакции хлорэтана с гидроксидом натрия ОН группа замещает атом хлора в молекуле хлорэтана и при этом образуется два новых соединения – этанол и хлорид натрия. При хлорировании бензола в присутствии катализатора атом хлора замещает один атом водорода в молекуле бензола и образуются новые вещества – хлорбензол и хлороводород.
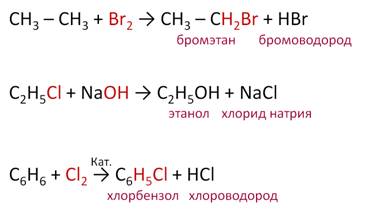
Следующий тип реакций – это реакции присоединения. В результате данных реакций атом или группа атомов присоединяется по месту разрыва π-связи в непредельном соединении. В результате чего, двойные связи превращаются в одинарные, а тройные – в двойные. К таким реакция относятся реакции гидрирования – присоединения водорода, гидртации – присоединения воды, реакции гидрогалогенирования – присоединения галогеноводородов и другие.
Например, реакции бромирования этилена каждый атом брома присоединяется к атому углерода по месту разрыва π-связи. В результате получается одинарная связь и новое вещество назвается 1,2-дибромэтан. Или при присоединении воды к этилену, также разрывается π-связь и к одному атому углерода идёт водород, а к другому атому углерода – ОН группа.

При присоединении водорода к бутаналю в присутствии катализатора, также разрывается π-связь и образуется новое соединение – бутанол-1.
CH3CH2CH2CHO + H2  CH3CH2CH2CH2ОН
CH3CH2CH2CH2ОН
К реакциям присоединения относятся и реакции полимеризации. Например, в реакции полимеризации этилена образуется полиэтилен:
n(CH2
= CH2)  (-CH2 – CH2)n
(-CH2 – CH2)n
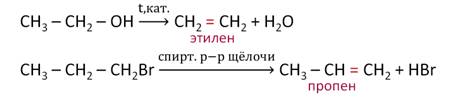
К реакциям отщепления, или элиминирования относятся реакции, в ходе которых происходит отщепление атомов или груп атомов от органических молекул, в результате которых образуются кратные связи. Это такие реакции, как реакции дегидрирования – отщепления водорода, дегидратации – отщепления воды, дегидрогалогенирования – отщепления галогеноводородов и другие.
Например, при отщеплении воды от молекулы этанола образуется этилен, в результате отщепления бромоводорода от 1-бромпропана образуется пропен. Таким образом, в обоих случаях образуются соединения с кратными связями.
Или при действии спиртового раствора щёлочи на галогенпроизводные алканов образуются алкены. Например, при действии спиртового раствора NaOH на 1-бромбутан, образуется бутен-1, бромид матрия и вода.
CH3CH2CH2CH2Br + NaOH  СН3CH2CH=CH2 + NaBr + H2O
СН3CH2CH=CH2 + NaBr + H2O
Реакции поликонденсации тоже относятся к реакциям отщепления. Но они имеют свою специфику. В результате реакций поликонденсации из низкомолекулярного соединения образуется высокомолекулярное (полимер) и ещё побочный низкомолекулярный продукт (вода).
Например, при производстве лавсана от молекул терефталевой кислоты отщепляются ОН группы, а от молекул этиленгликоля – атомы водорода, при этом образуется вода и высокомолекулярное соединение.

Реакции окисления и восстановления сопровождаются изменением степени окисления атомов углерода, которые являются реакционными центрами. Как вам известно, в органических соединениях валентность атома углерода равна IV, а вот степени окисления могут быть различными и не совпадать с валентностью. Например, в реакции окисления уксусного альдегида до уксусной кислоты атом углерода меняет свою степень окисления с +1 до +3. В реакции восстановления этилена до этанола атомы углерода изменяют свои степени окисления с -2 до -3.


 Получите свидетельство
Получите свидетельство Вход
Вход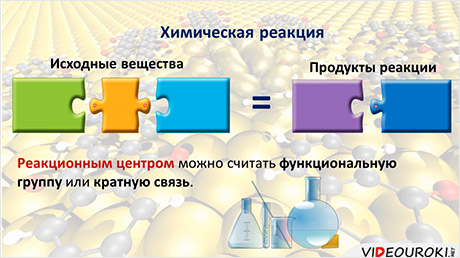



 0
0 10196
10196

