
Педагогический конкурс «Лучшая презентация к занятию»

Краевое государственное бюджетное профессиональное образовательное учреждение «Ребрихинский лицей профессионального образования»
Вода. Растворы. Растворение.
Преподаватель химии
Вовк Оксана Васильевна
Ребриха, 2021

Цели урока:
- Познакомиться с понятиями «раствор», «растворение», «растворимость», «растворитель», «растворенное вещество»;
- Узнать виды классификаций растворов;
- Научиться определять растворимость различных веществ экспериментально и теоретически, влияние различных условий на процесс растворения;
- Осознать необходимость бережного отношения к воде.

План урока :
- Состав воды.
- Нахождение воды в природе.
- Физические свойства воды.
- Растворение. Растворы.
- Значение воды и растворов.

«Воде была дана волшебная власть стать соком жизни
на Земле»
Леонардо да Винчи

Жизнь человека во все времена самым тесным образом была связана с водой, от нее зависело не только благополучие, но и нередко само существование целых народов…

Не случайно большинство крупных поселений – начиная со стоянок древнего человека и заканчивая современными многомиллионными городами – возникли по берегам крупных водоемов: рек, озер, морей.

Что такое вода?
- Вода – одно из начал всего существующего на Земле,- говорили в древности.
- Вода – простое вещество, единое и неделимое, - считали в средние века.
- Нет, - сказал великий А. Лавуазье, - вода состоит из водорода и кислорода, её можно получить с помощью химической реакции.
- Свойства воды во многом определяют свойства растворов, - утверждал Д.И. Менделеев
- Даже этого слишком мало, - говорят в наши дни, - чтобы объяснить аномальные свойства воды и многое другое в её поведении.

Что такое вода? - Минерал не имеющий цвета, Не имеющий запаха, формы, но ты оглянись – Это главное таинство, главное чудо Планеты, Это главный исток, из которого вылилась Жизнь. Без воды на Планете не мыслимо что-то живое И вода вездесуща – и в недрах, и по над землей, И планету Земля, во Вселенной зерно голубое, Было б много точнее назвать не Землёй, а Водой. Океаны и реки, озёра и вечные льдины, Сок деревьев и трав, кровь живущих зверей и людей – Это только вода, это Жизни самой сердцевина, Это плазма Планеты, а может Галактики всей. Мы не ценим её, мы, как дети с игрушкой играем, С этим главным сокровищем, таинством Жизни, водой, Загрязняем её, отравляем её, убиваем… Ну, а если когда-то игра обернётся бедой?

1. Состав воды
эл.ток
2Н 2 О 2Н 2 + О 2
вода водород кислород
2молекулы 2 молекулы 1 молекула
Молекула воды состоит из:
двух атомов водорода и
одного атома кислорода.
Молярная масса 18,01528 г/моль.
Химическая формула - Н 2 О
Вода – это сложное вещество

2. Нахождение воды в природе
Вода- самое распространенное вещество на Земле.
Где она находится?
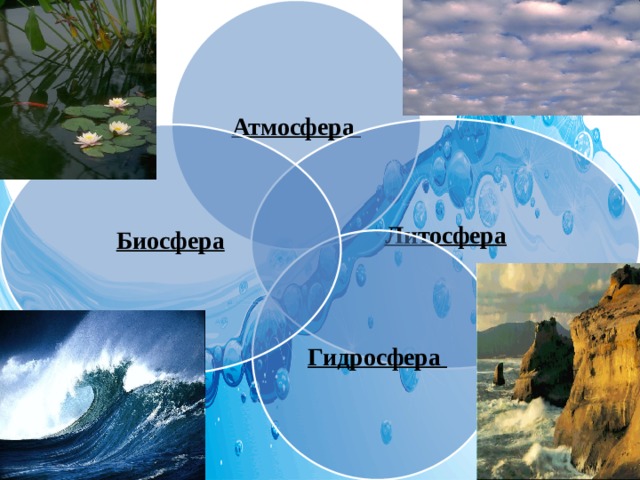
Атмосфера
Литосфера
Биосфера
Гидросфера

Запасы воды на земле
Суша ¼ поверхности. Вода ¾ поверхности

- Более 70 % поверхности Земли покрыто водой. Объем её равен примерно 1,4 миллиардов кубических километров. Наша планета – планета океанов. Три четверти поверхности её заняты морями и океанами. Вода на поверхности планеты бывает двух видов: соленая и пресная. 97 % всех водных ресурсов – запасы Мирового океана, не пригодные для питья. Запасы пресной воды в мире – около 3 % от общего количества воды, из них 2 % воды сосредоточено в полярных льдах и ледниках. Таким образом, только 1% воды на планете пригоден для питья.

3. Физические свойства воды
Агрегатное состояние
твердое(лед) жидкое газообразное
( водяной пар)
- Вкус - без вкуса;
- Цвет - без цвета;
- Запах - без запаха;
- Температура кипения – 99,974 0 С;
- Температура плавления - 0 0 С;
- Плотность воды при 4 0 С – 0,9982г/см 3 ;
- Плотность льда при температуре меньше 0 0 С - 0,92г/см 3 ;
- Теплопроводность и электропроводность – плохая;
- Теплоемкость - исключительно большая (вода медленно нагревается и медленно остывает);
- Способность растворять вещества – хорошая.

4.Вода- растворитель. Растворение. Растворы.
В воде растворяются и твердые вещества, и жидкости и газы.
Например:
Газированная вода – раствор углекислого газа в воде;
Столовый уксус – раствор уксусной кислоты в воде;
Любая природная вода – раствор.
Вода океанов содержит 35 г/л растворенных веществ, главным образом солей (NaCl,…);
Ежегодно с водами Волги в Каспийское море приносится более 60 млн.т растворенных солей
Питьевая вода из разных источников имеет разный химический состав, а значит и разный вкус.
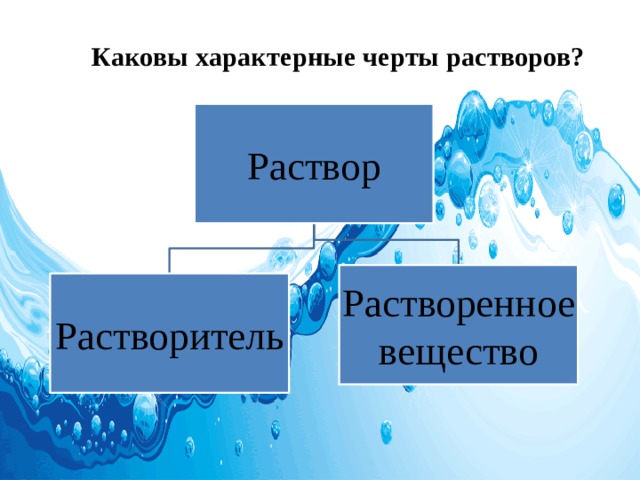
Каковы характерные черты растворов?
Раствор
Растворенное
вещество
Растворитель

- Раствор – гомогенная система, состоящая из 2-х и более независимых компонентов, а также продуктов их взаимодействия .
- Растворитель - вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, не изменяя их химически.
- Растворенное вещество - компонент жидкого или твердого раствора,
который присутствует в меньшем или
незначительном количестве.
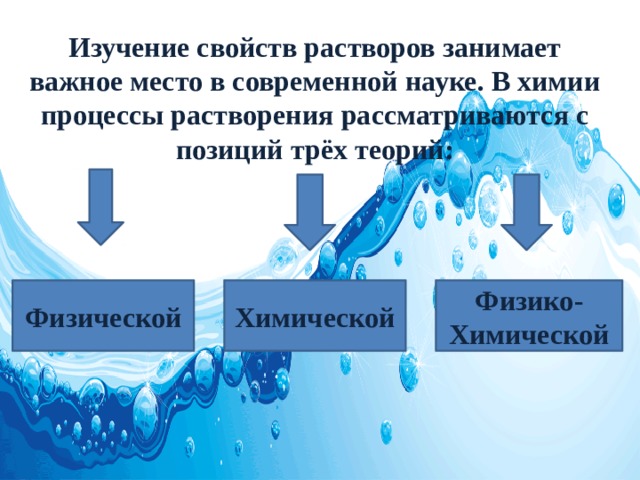
Изучение свойств растворов занимает важное место в современной науке. В химии процессы растворения рассматриваются с позиций трёх теорий:
Физической
Химической
Физико-Химической

Физическая теория
Якоб Хендрик Вант-Гофф
Сванте Август Аррениус
Вильгельм Фридрих Оствальд
Процесс растворения является процессом диффузии, т.е проникновение растворенного вещества в промежутки между молекулами воды
Раствор – однородная смесь, состоящая из двух или более однородных частей.

Химическая теория
Дмитрий Иванович Менделеев
Иван Алексеевич
Каблуков
Процесс растворения – это результат взаимодействия вещества с молекулами воды.
Раствор - это однородная система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.

При взаимодействии растворённого вещества с водой образуются гидраты .
Гидраты - это непрочные соединения веществ с водой, существующие в растворе.
растворитель
гидраты
растворённое вещество
Растворитель – компонент раствора, количественно преобладающий и находящийся в том же агрегатном состоянии.

Косвенным доказательством гидратации является существование твердых кристаллогидратов
self made by FischX
глауберова соль (Na 2 SO 4 ·10H 2 O)
медный купорос (CuSO 4 ·5H 2 O)
железный купорос (FeSO 4 ·7H 2 O)
Кристаллогидраты – соли и другие твердые вещества, в состав которых входит вода.

Физико-химическая теория
В настоящее время принята теория, которая объединяет обе точки зрения,- физико-химическая теория растворов. Её предсказал Д.И. Менделеев в своём учебнике “Основы химии», в 1906 году.
Растворение – это физико-химический процесс.
- При физическом явлении разрушается кристаллическая решетка и происходит диффузия молекул растворенного вещества.
- При химическом явлении в процессе растворения молекулы растворенного вещества реагируют с молекулами растворителя.

Теории, изучающие процессы растворения
Признаки сравнения
Теория
физическая
Сторонники теории (авторы)
химическая
Вант-Гофф, Аррениус и Оствальд
Определение растворения
физико-химическая
Результат диффузии, т е. проникновения растворенного вещества в промежутки между молекулами воды
Д.И. Менделеев, В.И. Каблуков
Д.И. Менделеев
Результатом химического взаимодействия растворенного вещества с молекулами воды
Результат диффузии и химического взаимодействия (учебник «Основы химии»)
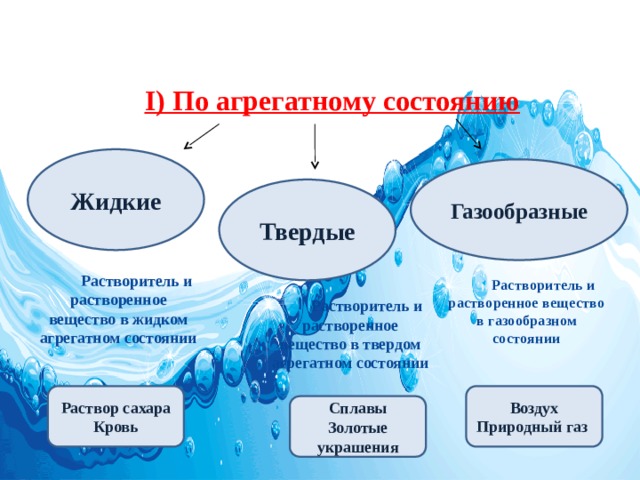
Классификация растворов:
I) По агрегатному состоянию
Жидкие
Газообразные
Твердые
Растворитель и растворенное вещество в жидком агрегатном состоянии
Растворитель и растворенное вещество в газообразном состоянии
Растворитель и растворенное вещество в твердом агрегатном состоянии
Воздух
Раствор сахара
Природный газ
Кровь
Сплавы
Золотые украшения

Классификация растворов:
II) По количеству растворенного вещества
Концентрированные
Разбавленные
Концентрированный раствор — раствор с высоким содержанием растворённого вещества.
Разбавленный раствор- раствор, содержащий малое количество растворённого вещества .

Классификация растворов:
III) В зависимости от количества растворённого в растворителе вещества
Насыщенные
Ненасыщенные
Перенасыщенные

- Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется.
- Ненасыщенным называют такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе .
- Пeренасыщенным называют такой раствор, в котором при данной температуре находится в растворённом состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.

Что такое растворимость?
Растворимость – это способность вещества разрушаться до молекул или ионов.
Растворимость -это способность веществ растворяться в каком-либо растворителе.
Растворимость - максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре.

От чего зависит растворимость веществ?
- От температуры
2. От природы растворителя
3. От природы вещества
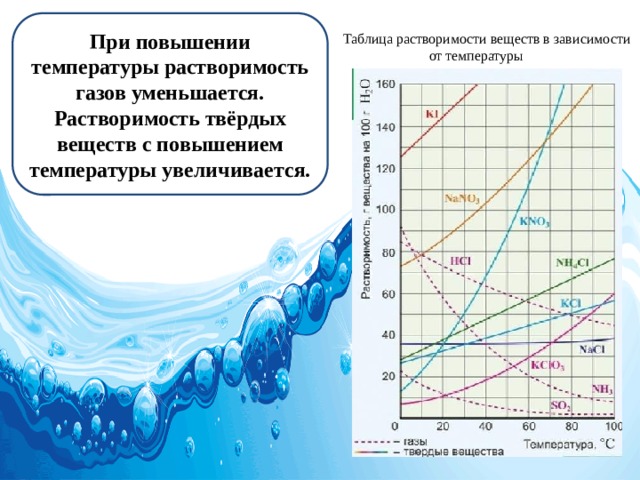
При повышении температуры растворимость газов уменьшается. Растворимость твёрдых веществ с повышением температуры увеличивается.
Таблица растворимости веществ в зависимости от температуры

Зависимость растворимости от природы растворителя
Растворение медного купороса
в спирте
в воде

В зависимости от способности вещества растворяться в воде, оно может быть:
малорастворимо ,
если при комнатной температуре в 100 граммах воды растворяется менее 1 грамма этого вещества .
хорошо растворимо ,
нерастворимо , растворимость меньше 0,01 грамма в 100 граммах воды.
если при комнатной температуре в 100 граммах воды растворяется более 1 грамма этого вещества.
.

Растворимость веществ.
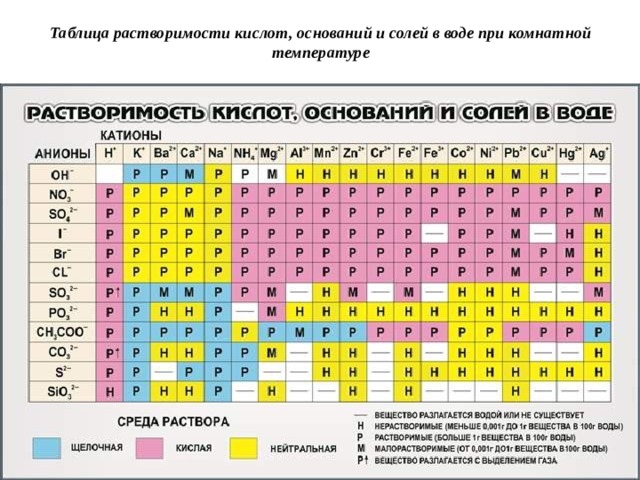
Таблица растворимости кислот, оснований и солей в воде при комнатной температуре

Общий вывод:
- По растворимости в воде различают вещества: растворимые, малорастворимые, практически не растворимые.
- Растворение – физико-химический процесс.
- Нагревание и измельчение веществ ускоряет процесс растворения.
- Раствор – однородная смесь,
многокомпонентная система, состоящая из: растворимого вещества, растворителя.

5. Значение воды и растворов
Роль воды и растворов трудно переоценить.
- Все химические превращения на Земле происходят или с непосредственным участием воды, или в водных растворах, или в её присутствии.

Вода – жизненно важное вещество…
Она содержится во всех живых организмах.

В состав человеческого тела входит около 65 % воды. Во взрослом человеке, который весит 70 кг, примерно 46 кг приходится на воду
В норме организм за сутки выделяет 2,5 л воды: через почки – около 50 %, через легкие – 13 %, через кишечник – 5 %, остальная часть воды (примерно 32 %) выделяется через кожу.

При утрате влаги в размере 6-8 % от веса чела человек впадает в полуобморочное состояние. Потеря 10 % влаги вызывает нарушение глотательного рефлекса, затем начинаются галлюцинации, в конце концов останавливается сердце.
При потере организмом
более 12 % влаги
наступает смерть

Вода является средой обитания для различных живых организмов.

От воды зависит климат планеты.
Вода обладает высокой
теплоемкостью.
Нагреваясь она поглощает
тепло,
а остывая – отдает его.

Большое количество воды расходуется на промышленные нужды .
- В металлургии;
- В химической промышленности;
- В земледелии, для орошения;
- В энергетике;
- В медицине;
- Для хозяйственных
нужд.

Применение воды в технических целях
для мойки
для охлаждения оборудования, сырья
для растворения реагентов, используемых в производствах, для получения пара
в качестве транспортной среды
в качестве поглотителя примесей

Сколько воды вы расходуете за день в повседневной жизни ?
Прием душа
15 литров в минуту
Наполнение ванны
200 литров
Стирка в стиральной машине
100-150 литров
Мыл руки
7 литров в минуту
Чистил зубы
7 литров в минуту
Мыл обувь
7 литров в минуту
Мыл посуду
15 литров в минуту

Поэтому должны приниматься меры по охране и рациональному использованию водных ресурсов.

Для выражения состава раствора используют количественную характеристику раствора- массовую долю растворенного вещества :
( Ѡ р.в. ) - это безразмерная величина, равная отношению массы растворённого вещества (m р. в . ) к общей массе раствора (m р-ра ):
m р. в .
- Ѡ р.в. = ------------ (1)
m р-ра
- m р-ра = m р.в. + m (н 2 о) (2)

Массовую долю растворённого вещества
( процентную концентрацию) обычно выражают в долях единицы или в процентах.
Например , массовая доля растворённого вещества – CaCl 2 в воде равна 0,1 или 10 %:
Ѡ (CaCl 2 ) = 0,1 (10%)
Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 10 г и вода массой 90 г

Задача: 60% от массы тела человека приходится на воду. Вычислите сколько воды содержится в организме человека массой 70 кг.
Дано:
1)
m(тела)= 70 кг
ω(воды)=60%
_______________
m(воды) -?
Ответ:
А сколько воды содержится в Вашем организме?

Что же такое вода?
Вода – это обыкновенное чудо , обладающее необыкновенными свойствами.

Знаете ли Вы что?
- Выплавка 1 тонны стали требует расхода 25м 3 воды.
- Для очистки 1 тонны нефти надо затратить 18м 3 воды.
- В древности человек обходился 12-18л воды в день, в 19 веке - 40-60 л.
- В настоящее время городской житель в сутки тратит более 500л воды.

Знаете ли Вы что?
- Общие запасы воды на Земле составляют около 1386 млн. км 3 . На долю пресной воды приходится только 35 млн. км 3 . И лишь 2,5% из них можно использовать.
- Запасы пресной воды небезграничны.
- Важна проблема очистки воды и использование её в системах замкнутого цикла.

Вы слыхали о воде? Говорят, она везде!
В луже, в море, в океане и в водопроводном кране.
Как сосулька, замерзает, в лес туманом заползает…
Ледником в горах зовется, лентой серебристой вьется.
Средь высоких, стройных елей рушится потоком селей…
На плите у нас кипит, паром чайника шипит,
Растворяет сахар в чае. Мы её не замечаем,
Мы привыкли, что вода – наша спутница всегда!
Анастасия Кавунова

Осуществите самооценку деятельности на уроке:
«5» -Если вы были внимательны на уроке, уверены в себе, и все изученные вопросы усвоили.
«4» - Если вы были внимательны, усвоили материал в целом, а на вопросы затруднялись ответить.
«3» - Кто сомневается .

Мое состояние после урока
Мне хорошо я активно работал(а),все понял(а )
Я чувствовал(а) себя неуверенно, работал(а) мало
У меня возникло много вопросов, есть над чем поработать

Информационные ресурсы:
1. А. Меркулов. Самая удивительная на свете жидкость. М., 1978.- 193 с.
2. В.В. Синюков. Вода известная и неизвестная. М., 1987.- 176 с.
3. Химия. Большой справочник для школьников и поступающих в вузы. М., 1999.- 780 с.
4. Зверев, И.Д. Анатомия, физиология и гигиена человека / И.Д. Зверев, О.В. Казакова, О.С. Яковлева. - Л.: Просвещение; Издание 3-е, 2014 . - 168 c.
5. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов. / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; под ред. Ю.А. Ершова -9-е изд., стер.- М: Издательство Юрайт, 2011 - 560 с
6. Попков В.А. Общая химия / В.А.Попков, С.А. Пузаков - М.: ГЭОТАР - Медиа, 2010. - 976 с.
7. Глинка Н.Л. Общая химия/ Н.Л. Глинка; под ред. В.А. Попкова, А.В. Бабкова - 19-е изд, перераб. и доп. - М.: Издательство Юрайт, 2013. - 900 с.
8. Химия. Просвещение МЕДИА. Электронная библиотека 2004г

 Получите свидетельство
Получите свидетельство Вход
Вход











 Вода.Растворы.Растворение. (4.69 MB)
Вода.Растворы.Растворение. (4.69 MB)
 0
0 1561
1561 72
72 Нравится
0
Нравится
0


