
МОУ«Средняя общеобразовательная школа № 36»
Тема урока : Кислород. Озон
(урок изучения нового материала в 8 кл.)
«Кислород - это вещество,
вокруг которого вращается земная химия». Я. Берцелиус

Цель урока
Образовательная:
ознакомить учащихся со свойствами, способами получения и применением кислорода , озона.
Развивающая:
способствовать проявлению творческих способностей учащихся, умению устанавливать взаимосвязь состава, строения и свойств изучаемых веществ.
Воспитательная:
развивать умения работать в коллективе.

Оборудование к уроку
Оборудование : спички, спиртовка, лучинка, стакан, пробирка, компьютер, проектор, экран, учебник . Реактивы : KMnO 4 ,С, S , Р.

План урока
- План характеристики элемента.
1. Химический знак.
2. Относительная атомная масса.
3. Валентность.
4. Нахождение в природе.
- План характеристики простого вещества.
- Химическая формула.
- Относительная молекулярная масса.
- Физические и химические свойства.
- Получение и применение.

Ход урока
1. Организационный момент (психологический настрой) - 2 мин .
2. Подготовка учащихся к восприятию нового учебного материала, т е актуализация знаний и практических и умственных умений- 2 мин.
3. Изучение нового материала - 31 мин.
4. Закрепление материала, изученного на данном уроке -
6 мин.
5 . Подведение итогов урока - 2 мин.
6 . Задание на дом (дифференцированное) – 2 мин.

Загадка
Достоин газ тот удивленья.
Его применяют сейчас
Для резки металлов и сталеваренья
И в доменных мощных печах.
Берет летчик в небесные дали,
Подводник с собою берет,
Вы верно уже догадались,
Что газ этот….

Из истории открытия кислорода
Кислород открыли одновременно независимо друг от друга два химика – англичанин Д. Пристли и швед К.Шееле.
Французский химик А.Лавуазье впервые назвал кислород «жизненным газом», а позднее - «кислород- рождающий кислоты».
К.Шееле
Д.Пристли
А.Лавуазье
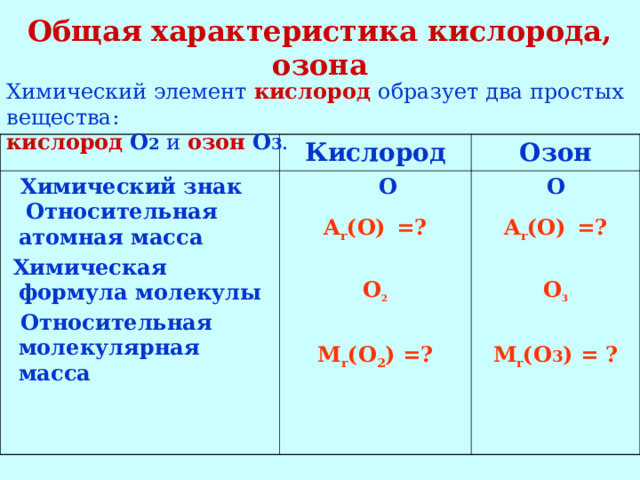
Общая характеристика кислорода, озона
Химический элемент кислород образует два простых вещества:
кислород О 2 и озон О 3 .
Кислород
Химический знак Относительная атомная масса
Озон
Химическая формула молекулы
Относительная молекулярная масса
О
A r (О) =?
О 2
М r (О 2 ) =?
О
A r (О) =?
О 3
М r (О 3 ) = ?

Нахождение в природе
Он повсюду и везде:
В камне, воздухе, в воде;
Он и в утренней росе,
И в небес голубизне.
Кислород - самый распространенный элемент на Земле.
Он присутствует в воздухе (около 21%), входит в состав различных минералов, воды и живых организмов.
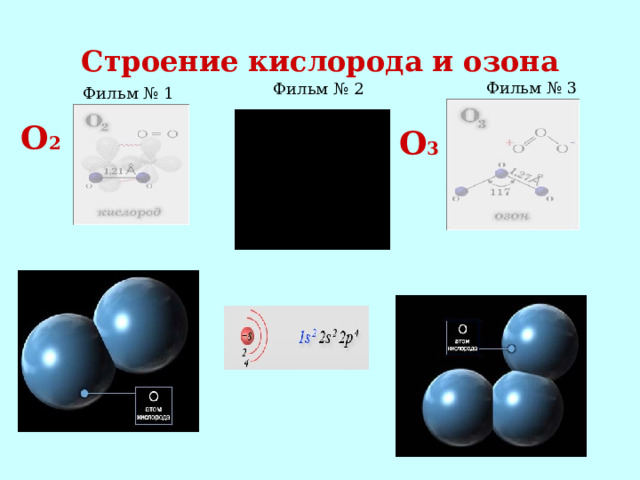
Строение кислорода и озона
Фильм № 3
Фильм № 2
Фильм № 1
О 2
О 3

Физические свойства
Кислород O 2 – газ без цвета , вкуса и запаха , умеренно растворим в воде, тяжелее воздуха . При давлении 760 мм. рт.ст. и температуре – 183 С кислород сжижается.
Газ озон был назван озоном - от греческого слова ozon, что означает «пахучий». Озон О 3 - голубой газ с резким запахом свежести . Растворимость озона в воде в 15 раз выше, чем у кислорода (по растворимости различают O 2 от О 3 ). Озон О 3 в отличии от кислорода О 2 в больших количествах ядовит. Образуется во время грозы.

Получение кислорода и озона
Фильм № 4
Промышленный способ:
перегонка сжиженного воздуха.
Лабораторные способы:
а) разложение кислородсодержащих веществ
2HgO 2Hg + O 2
2KMnO 4 K 2 MnO 4 + MnO 2 + O 2
б) прокаливание
2KClO 3 2KCl + 3O 2
(в присутствии катализатора MnO 2 )
2H 2 O 2 2H 2 O + O 2
(в присутствии катализатора MnO 2 )
Озон (О 3 ) в промышленности и в лабораториях получают под действием электрического разряда в специальных приборах озонаторах.
3О 2 = 2О 3
Фильм № 5
Фильм № 6

Способы собирания кислорода и обнаружения
вытеснением воздуха
вытеснением воды
почему нельзя?
Закрепление :
1. Как доказать, что сосуд наполнился газом?
2. Почему кислород можно собрать путем вытеснения воды и воздуха?
Кислород практически не растворяется в воде, поэтому его можно собирать методом вытеснения воды.
Фильм № 8
Фильм № 7

Химические свойства кислорода
Реакции, в которых участвует кислород,
называются реакциями окисления . Если при
этом выделяются теплота и свет, то такие
реакции называют еще реакциями горения .
Кислород реагирует по схеме с:
- Металлами: Ме + О 2 = Ме x О y (оксид металла)
- Неметаллами : НеМе + О 2 = НеМе x О y (оксид неметалла)
- Со сложными веществами : CH 4 + 2O 2 = CO 2 + 2H 2 O
Вывод: При горение веществ в кислороде получаются оксиды.
Медленное окисление различных веществ - это, например, реакции, описывающие процессы гниения дерева, ржавление железа.
Оксиды – это сложные вещества состоящие из 2-х элементов, один из которых кислород со степенью окисления -2.
Э x O y -2

Химические свойства кислорода
Простые вещества (металлы и неметаллы) горят в кислороде .
Фильм № 9
Фильм № 10
Fe + O 2 = оксид железа ( II )
S + O 2 = оксид серы ( IY ) В кислороде сера сгорает ярким синим пламенем. Сера горит в кислороде более интенсивно, чем на воздухе.
Железо активно взаимодействует с кислородом с выделением тепла и света.
Р + O 2 = оксид фосфора ( Y)
При горении фосфора образуется белый дым, состоящий из мельчайших частиц твердого оксида фосфора(V).
Фильм № 11

Химические свойства кислорода
Простые вещества горят в кислороде .
Фильм № 12
Фильм № 13
C + O 2 = оксид углерода ( IY )
H 2 + O 2 = оксид водорода

Химические свойства кислорода
Сложные вещества горят в кислороде с образованием оксидов. Например, метан ( CH 4 ) и ацетилен ( C 2 H 2 )
Фильм № 14
Фильм № 15
Фильм № 16
1 : 2
2C 2 H 2 + 5O 2 = 4CO 2 + 2H 2 O
CH 4 + O 2 = оксид водорода + оксид углерода ( IY )

Закрепление по химическим свойствам
Вывод:
при горение простых и сложных веществ образуются оксиды .

Применение кислорода
Кислород – химический элемент, необходимый для дыхания. Растения, животные и люди не могут жить без него. Кислород, образующийся в процессе фотосинтеза, попадает в атмосферу, откуда его вдыхают люди и животные. Кислород используется в медицине в кислородных респираторах, которые помогают пациентам дышать. Сжатый в баллонах кислород используется в промышленности, медицине и в лабораториях.
Фильм №18
Фильм №17

Применение кислорода
Смесь кислорода с ацетиленом дает при горении очень горячее пламя, используемое при сварке. Применяется как окислитель ракетных топлив и реагент во многих химических процессах.

Химические свойства озона
Фильм № 19
Озон - очень сильный окислитель.
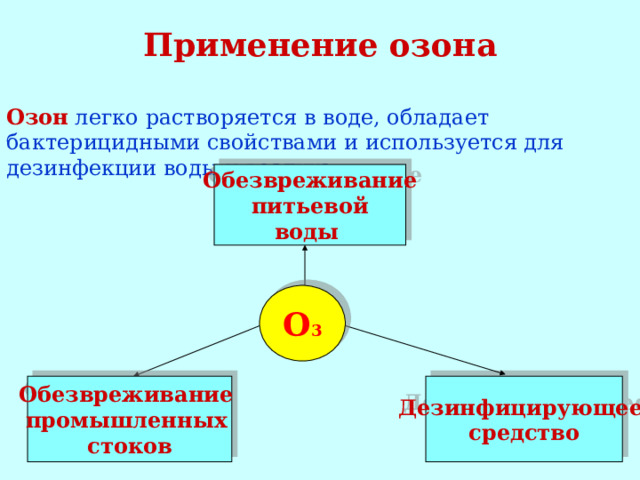
Применение озона
Озон легко растворяется в воде, обладает бактерицидными свойствами и используется для дезинфекции воды и воздуха.
Обезвреживание
питьевой
воды
О 3
Дезинфицирующее
средство
Обезвреживание
промышленных
стоков

Влияние озона
Другое особое свойство озона - способность поглощать УФ -лучи. Таким образом, озон защищает живые организмы - людей, животных и растения - от опасного УФ - излучения Солнца. Разрушение озонового слоя, вызванное многими причинами, например, космическими экспедициями, промышленной деятельностью и особенно фреонами, представляет собой серьезную угрозу жизни на Земле. Высокий
уровень ультрафиолетового излучения
оказывает негативное влияние на
организм человека: он вызывает
заболевания глаз и горла,
увеличивает подверженность
онкологическим заболеваниям.
Фильм № 20

Закрепление по применению
Расскажите, где находит применение кислород?
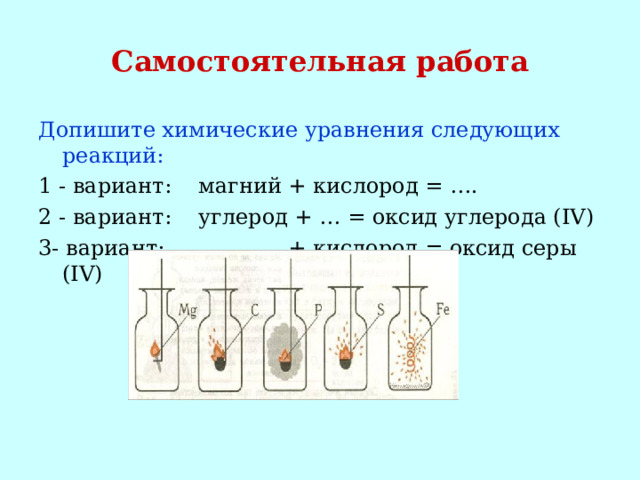
Самостоятельная работа
Допишите химические уравнения следующих реакций:
1 - вариант: магний + кислород = ….
2 - вариант: углерод + … = оксид углерода (IV)
3- вариант: … + кислород = оксид серы (IV)

Проверка самостоятельной работы
Допишите химические уравнения следующих реакций:
- магний + кислород = ….
2Mg + O 2 = 2MgO
- углерод + … = оксид углерода (IV)
C + O 2 = CO 2
3. … + кислород = оксид серы (IV)
S + O 2 = SO 2

Охрана окружающей среды
Фильм № 21
без звука
Озон образуется в атмосфере Земли на высоте 25 км под действием солнечной радиации. И здесь вредный газ превращается в защитника всего живого на Земле: он задерживает и поглощает опасное излучение Солнца. Однако в озоновом "зонтике" Земли, который имеет толщину всего-то около30 метров, то и дело возникают"дыры". Особенно это стало заметно в последние десятилетия в связи с загрязнением окружающей среды. В воздух попадает все больше "вредных" для озона газов, вроде оксида азота NO или тех веществ, которые используются для наполнения холодильных установок и аэрозольных баллончиков. Даже частичное исчезновение озонового слоя над Землей грозит всему живому гибелью …

Закрепление
- Кто впервые предложил название кислород?
- Какие известны вам способы собирания кислорода в сосуд? На каком свойстве кислорода основан каждый из этих способов?
3. Выберите верный рисунок собирания кислорода.
4. Какой из жидких оксидов является самым распространенным в природе?
5. Кислород или озон проявляет большую химическую активность?

Закрепление
Игра " крестики-нолики ".
- Найдите оксиды.
- Напишите уравнения химических реакций получения оксидов.
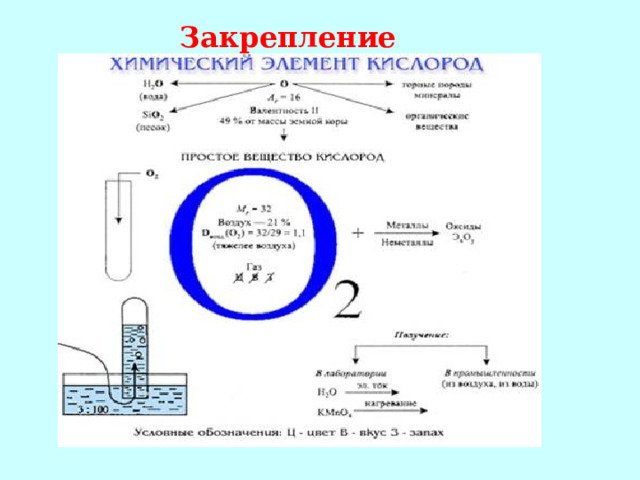
Закрепление

Знаете ли вы…
- Жидкий кислород обладает удивительным свойством: он притягивается магнитом!
- При T = -218,7 жидкий кислород затвердевает. Красивые, чистого синего цвета кристаллы твердого цвета не рекомендуется брать в руки: они «обжигают» холодом.
- Человек в лежачем положение «сжигает» в сутки около 0,5 кг.О2. Выполняя тяжелую работу – расходует уже 1,6 кг. О2.
А если бы
- воздух земной атмосферы содержал кислорода меньше 18%, то горение в нем углерода стало бы невозможным , а "естественный" (например, от удара молнии) огонь никогда бы не появился. И первобытный человек так и не узнал бы, что огонь можно использовать для своих нужд…
- еще хуже, если содержание кислорода в атмосфере больше 30%. В такой газовой среде первый же удар молнии вызвал бы катастрофу - гигантский пожар , а может быть, и взрыв. Ведь в этих условиях и сырая древесина горит как порох!

Вывод
- О - самый распространенный на Земле химический элемент.
- О - одно из самых активных веществ.
- Озон – более сильный окислитель, чем кислород.
4. Кислород можно собрать путем вытеснения воды и воздуха.

Домашнее задание
- Как получаются оксиды?
- Какое свойство кислорода позволяет рыбам жить под водой?
3. Какие рыбы употребляют самое меньшее количество кислорода и какие – самое большое?
- Как отличить озон от кислорода?
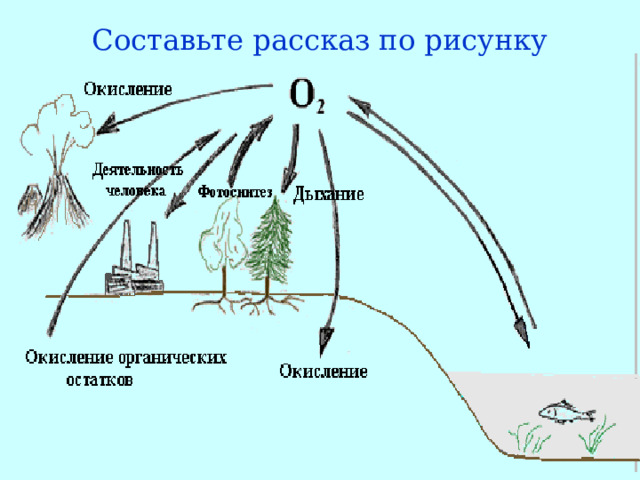
Составьте рассказ по рисунку

В работе использованы модели из эл. учебника «Химия для всех - 2000»,
«1С: Химия. Репетитор», «1 С Химия для всех- XXI ».
Зеркало Единой коллекции http://www.edu.yar.ru/

 Получите свидетельство
Получите свидетельство Вход
Вход











 Урок по теме: "Кислород" (2.87 MB)
Урок по теме: "Кислород" (2.87 MB)
 0
0 1859
1859 82
82 Нравится
0
Нравится
0






