МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ КОМИ
КОМИ РЕСПУБЛИКАСА ЙÖЗÖС ВЕЛÖДАН МИНИСТЕРСТВО
Государственное профессиональное образовательное учреждение
«Сыктывкарский лесопромышленный техникум»
«Сыктывкарса вÖр промышленносьт техникум»
уджсикасÖ велÖдан канму учреждение
Учебное пособие
Практикум
Органическая химия
Неорганическая химия
Разработала Пантелеева Т.П., преподаватель химии

Сыктывкар 2014
ОБЩИЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ
Во время работы в химической лаборатории необходимо знать и выполнять такие правила:
Перед выполнением опыта прочитать соответствующее описание, подготовить все необходимое для проведения опыта, выяснить непонятные вопросы у преподавателя и только после этого приступать к его выполнению.
Придерживаться всех мер безопасности, приведенных в специальной инструкции и методических указаниях.
Поддерживать чистоту и порядок на рабочем месте, не загромождать его ненужными предметами.
Методические указания, учебники и лабораторный журнал во время выполнения работы следует оберегать от попадания на них растворов кислот, щелочей и т.п. Запрещается ставить стаканы с реактивами на книжки и журналы.
Во время пользования реактивами следует соблюдать такие правила:
прежде чем взять банку с реактивом с полки, внимательно прочитайте этикетку с названием реактива, после использования возвратить банку на место и снова прочитать этикетку;
все банки с растворами держать закрытыми и открывать их только на время использования; закрывая банку не перепутать пробки, иначе реактивы загрязняются и становятся непригодными к использованию;
не переносить реактивы общего пользования на свои рабочие места;
сухие реактивы брать чистым шпателем, специальной ложечкой, чистой сухой пробиркой;
наливая жидкость из банки, последнюю надо держать этикеткой кверху, чтобы капли реактива, стекая по ней, не попали на этикетку и не испортили ее;
если не указано, какое количество вещества надо взять для опыта, следует брать сухое вещество в количестве, которое закрывает дно пробирки, а раствора - не больше 1-2мл;
неиспользованные реактивы ни в коем случае не высыпать и не выливать снова в те банки, из которых они были взяты;
остатки растворов, которые содержат соединения мышьяка, ртути и серебра, не выливать в канализацию, а сливать в специальные стаканы.
Без разрешения преподавателя ни в коем случае не проводить опытов, не предусмотренных в соответствующих указаниях.
Меры безопасности
Для предотвращения несчастных случаев необходимо:
Все опыты с ядовитыми веществами, веществами, которые плохо пахнут, а также упаривание кислот и растворов, которые их содержат, надо проводить в вытяжном шкафу.
Опыты с легковоспламеняющимися веществами проводить на расстоянии от огня.
При работе с металлическим натрием и другими щелочными металлами остерегаться воды. Сохранять щелочные металлы под керосином, который не содержит влаги. Обрезки щелочных металлов сдавать лаборанту и ни в коем случае не бросать в мусоросборник или раковину.
При нагревании растворов в пробирке пользоваться держателем и всегда держать пробирку таким образом, чтобы ее отверстие было направлено в сторону от работающего и его соседей по рабочему столу.
Не наклонять лица над жидкостью, которая нагревается, или над веществами, которые сплавляются, для предотвращения попадания брызг на лицо.
Нюхать любые вещества в лаборатории с осторожностью, не наклоняясь над пробиркой и не вдыхая на полную грудь, а направляя на себя пар или газ легким движением руки. Такие сильные яды, как стибин и фосфин, нюхать нельзя.
Со всеми веществами в лаборатории надо вести себя, как с отравляющими, поскольку больше ¾ веществ, которые находятся в лаборатории, отравляющие.
При работе с твердыми щелочами (измельчение в ступке, приготовление смесей для сплавления) обязательно надевать защитные очки. Брать щелочь разрешается только щипцами или пинцетом. Необходимо старательно прибирать остатки щелочи с рабочего места.
При разведении концентрированной серной кислоты надо осторожно приливать кислоту в воду, так как в этом случае кислота, которая имеет большую плотность, чем вода, опускаясь до дна, перемешивается с водой и тепло, которое выделяется при смешивании кислоты с водой, равномерно распределяется по всему объему раствора. Если же приливать воду к кислоте, вода остается на поверхности и вскипает благодаря выделению теплоты, при этом образуются брызги, опасные для работающего.
Запрещается есть в лаборатории.
Не бросать в раковину бумагу, битое стекло, остатки металла и др. Для этого следует пользоваться специальными мусоросборниками.
Оказание первой помощи
При попадании на кожу (рук, лица) концентрированных кислот (серной, азотной) необходимо смыть кислоту струей воды и промыть пораженное место большим количеством воды. Для нейтрализации кислоты можно смочить это место раствором соды, после чего наложить повязку из спирта или с 3%-ного раствора перманганата калия. При сильных ожогах после оказания первой помощи следует обратиться к врачу.
При ожоге кожи растворами щелочей пораженный участок кожи промывают водой до тех пор, пока она не перестанет быть скользкой на прикосновенье, после чего наложить повязку из спирта или 3%-ного перманганата калия.
При попадании брызг кислоты или щелочи в глаза немедленно промыть глаз большим количеством воды комнатной температуры, после чего сразу же обратиться к врачу.
При ожогах кожи горячими предметами (стекло, металлы и др.) наложить сначала повязку из спирта или 3% раствора перманганата калия, а потом повязку с мазью от ожогов.
При отравлениях хлором, бромом, оксидом углерода (II) немедленно вывести пострадавшего на свежий воздух и одновременно обратиться к врачу.
При отравлениях соединениями мышьяка и ртути, а также цианидами немедленно обратиться к врачу.
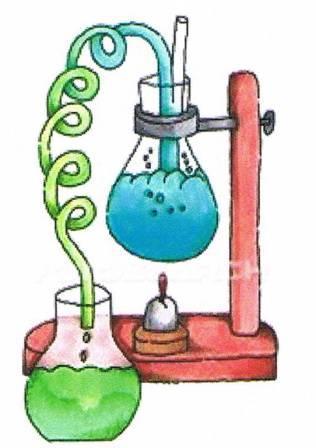
Практическая работа
Открытие углерода, водорода и хлора в органических соединениях.
Оборудование: пробирка, пробка с газоотводной трубкой, штатив школьный, спиртовка, стеклянная палочка.
Реактивы: оксид меди (порошок), парафин, известковая вода, безводный CuSO4.
Ход работы:
В пробирку положите кусочек парафина (величиной с горошину) и засыпьте его тройным количеством порошка оксида меди.
Укрепите пробирку в зажиме штатива в горизонтальном положении и внесите в нее немного безводного сульфата меди, поместив последний недалеко от отверстия пробирки. Закройте отверстие пробирки с газообразной трубкой и конец ее опустите в пробирку с известковой водой.
Сначала прогрейте всю пробирку, а затем нагрейте смесь парафина с оксидом меди. Пронаблюдайте, какие изменения происходят в нагреваемой пробирке с известковой водой и обезвоженным медным купоросом.
Прекратите нагревать пробирку. Удалите из нее сульфат меди и продукты реакции. Во что превратился оксид меди при окислении углеводородов? Что можно сказать о качественном составе взятых для исследования углеводородов?
Напишите уравнения реакции полного окисления оксидом меди углеводорода состава C14H30.
Практическая работа
Получение этилена и опыты с ним.
Оборудование: штатив металлический, спиртовка, спички, пробирка с газоотводной трубкой.
Реактивы: пробирка с приготовленной смесью этилового спирта и концентрированной серной кислотой с песком, бромная вода, раствор перманганата калия.
Ход работы:
1. В пробирку, выданную вам со смесью спирта и серной кислоты, добавляют речной песок, чтобы избежать толчков жидкости при кипении. Закрепите пробирку в металлическом штативе. Закройте пробирку пробкой с газоотводной трубкой и опустите в пробирку с перманганатом калия или с бромной водой.
2. Когда начнется реакция, пропускайте газ в пробирку с 2-3 мл. бромной воды, опустив газоотводную трубку до дна пробирки. Следите при этом, чтобы нагревание смеси не прекращалось, иначе жидкость из пробирки перебросится в прибор.
Какие изменения происходят бромной водой?
3. Пропускайте этилен в пробирку с таким же количеством подкисленного раствора перманганата калия. Что наблюдаете?
4. Вынув отводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ. Светящимся или несветящимся пламенем горит этилен?
5. Потушите спиртовку. Выделение этилена постепенно прекратится.
6. Объясните наблюдавшиеся явления. Составьте уравнения реакций. Какой вывод о химических свойствах этилена можно сделать?


![]()
KMnO4, I2
![]()
![]() H2SO4, C2H5OH
H2SO4, C2H5OH
Решение экспериментальных задач по теме « Углеводы»
Опыт 1. Докажите опытным путем, что обычный сахар содержит углерод.
Опыт 2. Докажите опытным путем, что крахмал содержится в картофеле и белом хлебе.
Опыт 3. Определите с помощью характерных реакций каждое из трех предложенных веществ:
А) Крахмал
Б) Глюкоза
В) Сахароза
Практическая работа
Идентификация органических веществ.
Задание 1. Выданы растворы: глицерина, этанола, уксусной кислоты, глюкозы, формальдегида.
Распознать все органические вещества. Результаты оформить в виде таблицы.
Задание 2. Выданы три кислоты: карболовая кислота (фенол), стеариновая кислота, уксусная кислота. Распознать эти кислоты. Результаты оформить в виде таблицы.
|
| № пробирок |
| Условия | 1 | 2 | 3 | 4 | 5 |
|  CuSO4+NaOH CuSO4+NaOH
Cu(OH)2 при обычных условиях |
|
|
|
|
|
| Cu(OH)2 при нагревании |
|
|
|
|
|
| выводы |
|
|
|
|
|
Практическая работа
Синтез уксусной кислоты и изучение ее свойств.
К ацетату натрия прибавить 2-3 мл раствора серной кислоты (1:1). Пробирку закройте пробкой с газоотводной трубкой, свободный конец, который опустить в пустую пробирку, а пустую пробирку поместить в стакан с холодной водой. Нагревайте смесь веществ на пламени до тех пор, пока в пробирке-приемнике соберется 1 мл. жидкости. Обратите внимание на запах уксусной кислоты.
Добавьте к собранной кислоте несколько капель метилоранжа. Что наблюдается?
Изучите свойства уксусной кислоты. Провести реакции уксусной кислоты с
Zn (при нагревании)
CuO ( при нагревании)
Na2CO3
В полученную кислоту добавить щелочь ( по каплям)
Получение уксусной кислоты
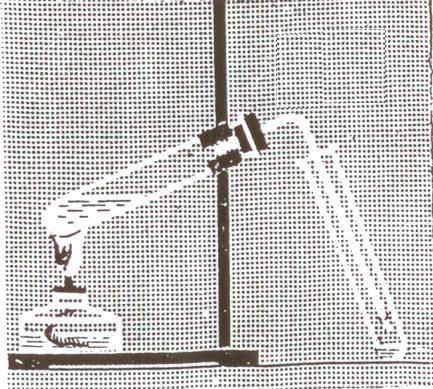
![]()
CH3COONa,
Уксусная Кислота
H2SO4![]()
Практическая работа
Распознавание волокон и пластмасс.
Цель работы:
1. В пакетах №1-5 распознать волокна: ацетат, лавсан, хлопок, капрон, шерсть.
2. В пакетах №6-10 распознать пластмассы: полиметилметакрилат, поливинилхлорид (ПВХ), полиэтилен, полистирол, фенолформальдегидная.
Практическая работа
Свойства полиэтилена
Образец полиэтилена нагрейте насильно (держите щипцами) над пламенем спиртовки или газовой горелки. Наблюдайте постепенное размягчение полимера и затем его плавление. Стеклянной или деревянной палочкой измените форму размягченного полиэтилена и дайте ему остыть. Какое свойство полиэтилена лежит в основе наблюдаемых явлений? Какое практическое значение оно имеет?
Подожгите образец полиэтилена. Обратите внимание, горит ли он вне пламени. Какого цвета пламя? Образуется ли при этом копоть? Обладают ли продукты горения запахом?
В пробирки с бромной водой и раствором перманганата калия поместите гранулы или мелкие кусочки полиэтилена. Наблюдайте, происходит ли изменения.
В пробирку с раствором серной кислоты и щелочи поместите измельченные кусочки полиэтилена.
Какой вывод о химических свойствах полимера можно сделать на основании проведенных опытов?
Практическая работа
Синтез этилового эфира уксусной кислоты
Оборудование и реактивы:
Спиртовка
Пробирки
Пробирки с длинной вертикальной трубкой
Два стеклянных стакана
Уксусная кислота (CH3COOH)
Этиловый спирт(C2H5OH)
Концентрированная серная кислота (H2SO4)
Насыщенный раствор поваренной соли
Получение уксусноэтилового эфира:
В пробирку налить равные объемы (5-7 мл) уксусной кислоты, этилового спирта, концентрированной серной кислоты. Пробирку закрыть пробкой с длинной вертикальной трубкой.
Осторожно нагреть смесь на пламени горелки. Минут через 5-7 вылить содержимое пробирки в стакан с насыщенным раствором поваренной соли. Когда жидкость отстоится, вылить её в делительную воронку и отделить образовавшийся эфир.
Написать уравнения реакций.
Практическая работа
Решение экспериментальных задач по органической химии
Задача: 1. Исходя из этилового спирта, получите:
Простой эфир
Альдегид
Карбоновую кислоту
Сложный эфир
Задача: 2. Выданы пробирки с растворами:
Глицерина
Этилового спирта
Уксусной кислоты
Белка
Формальдегида
Глюкозы
При помощи одних и тех же реактивов определите каждое вещество.
Задача: 3. Поместите в пробирку твердый хлорид натрия, концентрированную серную кислоту, немного этилового спирта. Соедините с газоотводной трубкой и нагревайте смесь. Газоотводную трубку переверните кверху и подожгите выделяющийся газ. Каким пламенем горит газ? Какой газ выделяется? Напишите уравнения реакций.
Лабораторная работа
Свойства каучука и резины
Поместите в пробирку несколько кусочков каучука и закройте ее пробкой с газоотводной трубкой. Пробирку с каучуком нагрейте и продукты разложения соберите в пробирку-приемник. Половину полученных жидких продуктов влейте в пробирку с 1-2мл бромной воды. Оставшиеся жидкие продукты влейте в другую пробирку с раствором перманганата калия, слгка подкисленным серной кислотой.
В две пробирки налейте по 2-3мл бензина. В одну из пробирок опустите кусочек резины, а в другую - такой же кусочек невулканизированного каучука. Закройте пробирки корковыми пробками и оставьте на некоторое время. Через несколько дней можно будет убедиться, что каучук в бензине частично растворяется, а резина только набухает.
Задание: Как доказать, что в продуктах термического разложения каучука содержатся непредельные углеводороды?
Лабораторная работа
Получение ацетилена и опыты с ним
Налейте в пробирку 1-2 мл воды и поместите в нее 2-3 небольших кусочка карбида кальция СаС2. Пробирку закройте пробкой с газоотводной трубкой.
Конец газоотводной трубки опустите в другую пробирку с бромной водой и пропустите через нее газ.
Конец газоотводной трубки опустите в пробирку с раствором перманганата калия, подкисленным серной кислотой.
Задание: Какой газ выделяется при взаимодействии карбида кальция с водой? Что происходит, если этот газ пропускают через бромную воду или раствор перманганата калия? Каким пламенем горит газ? Напишите уравнения соответствующих реакций.
Лабораторная работа
Изучение свойств многоатомных спиртов
В пробирку налейте немного глицерина и добавьте воду. Растворяется ли глицерин в воде?
В пробирку налейте 2мл гироксида натрия и добавьте немного раствора сульфата меди (II) до выпадения осадка. К осадку прилейте глицерин и взболтайте.
Задания: При помощи каких опытов можно доказать, что глицерин имеет свойства, сходные со свойствами одноатомных спиртов? Какая реакция характерна для глицерина и других многоатомных спиртов? Напишите уравнения соответствующих реакций.
Лабораторная работа
Изучение свойств фенола
Всыпьте в пробирку 1 см3 измельченного фенола и подогрейте его. Затем в ту же пробирку поместите очищенный кусочек натрия размером в одну-две спичечные головки. Выделяющийся газ подожгите.
Поместите в пробирку немного фенола и прилейте 4-5 мл воды. Содержимое пробирки встряхните. К образовавшейся взвеси прибавьте немного раствора гидроксида натрия и взболтайте.
Задание: На основе проделанных опытов поясните, какими общими отличительными свойствами обладает фенол по сравнению со спиртами. Напишите уравнения соответствующих реакций.
Вытеснение фенола из фенолята натрия кислотами. Полученный в предыдущем опыте прозрачный раствор фенолята натрия разлейте в две пробирки. К раствору в одной из пробирок прилейте немного соляной кислоты, а через раствор во второй пропустите избыток оксида углерода (IV).
Задание: Почему появляется взвесь, если к прозрачному раствору фенолята натрия добавить раствор кислоты или пропустить через него избыток оксида углерода (IV)? Составьте уравнения соответствующих реакций.
Лабораторная работа
Альдегиды
Получение этаналя окислением этанола. В пробирку налейте не более 1мл этанола и погрузите в него раскаленную спираль из медной проволочки. Появляется специфический запах, а медная проволочка приобретает характерный для металлической меди блеск.
Задание: Какие вещества образуются в этом опыте? Напишите уравнения соответствующих реакций.
Окислене этаналя оксидом серебра (I). Тщательно вымойте пробирку. Для этого налейте в нее концентрированный раствор гидроксида натрия и несколько минут нагревайте до кипения. Затем гидроксид натрия вылейте и пробирку несколько раз сполосните дистиллированной водой. В чистую пробирку налейте 2 мл свежеприготовленного раствора AgNO3 и к нему добавьте по каплям разбавленный раствор аммиака до растворения появившегося вначале осадка. К полученному раствору добавьте несколько капель раствора этаналя. Пробирку поместите в стакан с горячей водой. На стенках пробирки образуется осадок металлического серебра.
Окисление этаналя гидроксидом меди (II). В пробирку налейте 1 мл раствора этаналя и добавьте по 1 мл растворов СuSO4 и NaOH. Полученную смесь нагревайте. Образуется синий студенистый осадок. При нагревании осадок растворяется и жидкость приобретает желтый, а затем красный цвет.
Задание: Что образуется при окислении альдегидов? Как можно отличить альдегиды от других органических веществ? Почему при взаимодействии альдегидов с гидроксидом меди (II) появляется желтый, а затем красный цвет? Напишите уравнения соответствующих реакций.
Лабораторная работа
Белки
Доказать, что мясо и горох содержат белки
Пробирка № 1- мясной бульон
Пробирка №2 - горох (водный раствор)
Для этого проведите качественную реакции на белок ( биуретовую).
Доказать наличие в белке ароматических аминокислот.
Пробирка № 3 – белок куриного яйца.
Доказать можно с помощью азотной кислоты (конц.)
Натуральную или искусственную кожу вам выдали в пакетике?
Сжигаем образец кожи, продукты горения могут изменить окраску влажной лакмусовой бумаги (если кожа натуральная), а может не изменять окраску (кожа дана искусственная).
Игра « Светофорчики»
Если речь идет: о жирах – желтая карточка,
о белках – зеленая карточка,
об углеводах - красная карточка
На вещества действуют ферменты амилаза и мальтоза.
Начинают перевариваться в желудке.
Расщепляются до солодового сахара.
На вещества действуют ферменты: пепсин, трипсин, эрепсин.
Расщепляются до глицерина и жирных кислот.
Расщепляются до глюкозы.
Действует фермент липаза.
Расщепляются до альбумоз и пептонов.
Расщепление начинается в двенадцатиперстной кишке.
Окончательно расщепляются до аминокислот.
Для расщепления необходима желчь.
Всасываются в кровь.
Всасываются в лимфу.
Начинают расщепляться в ротовой полости.
Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества
ЦЕЛЬ РАБОТЫ: Приготовить 50г раствора сахара с массовой долей 2%.
ХОД РАБОТЫ: 1)Рассчитать массу твердого сахара и объем воды, необходимых для приготовления раствора. 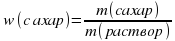
m(раствор) = m(сахар) + m(вода)
m(вода) = V(вода) * p(вода)
Плотность воды примите равной 1г/мл
2) Взвесьте на лабораторных весах необходимое количество сахара. Поместите на левую чашку весов лист фильтровальной бумаги и уравновесьте весы, размещая разновесы на правой чашке. Поместите твердый сахар на фильтровальную бумагу и с помощью весов взвесьте рассчитанную массу.

3) Перенесите массу сахара в коническую колбу.

4) Отмерьте мерным цилиндром найденный объем воды и влейте ее в коническую колбу.

Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости.
5)Размешайте стеклянной палочкой с резиновым наконечником полученный раствор
6)Рассчитайте, сколько молекул сахара содержится в полученном растворе, используя известные вам соотношения:
N(моль сахара) = NA *n (сахар),
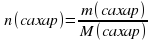
Поскольку сахар состоит на 99,9% из сахарозы, имеющей формулу C12H22O11, вы легко можете рассчитать молярную массу сахара и затем найти число молекул сахара в полученном вами растворе.
Практическая работа.
Решение экспериментальных задач по теме «Металлы»
Задача №1: В трех пронумерованных пробирках даны хлориды меди, алюминия, железа (III).
Определите опытным путем, в какой пробирке находится каждое из выданных вам веществ.
Задача №2: Исходя из хлорида алюминия, получите амфотерный гидроксид и подтвердите его химические свойства.
Задача №3: Проведите реакции, в которых осуществляются предложенные ниже химические превращения (по вариантам).
![]()
![]()
![]()
Вариант 1: MgCO3 MgCI2 Mg(OH)2 MgSO4
![]()
![]()
Вариант 2: CuSO4 Cu(OH)2 CuO
![]()
![]()
Вариант 3: ZnCI2 Zn(OH)2 ZnCI2
![]()
Na2ZnO2
Задача №4: Проведите реакции, подтверждающий качественный состав сульфата железа (II).
Задача №5: Очистите железный гвоздь от ржавчины химическим способом
Практическая работа
Получение, собирание и распознавание газов
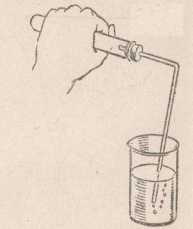
Опыт №1: Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1-2гранулы цинка и прилейте в нее 1-2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой и наденьте на кончик трубки еще одну пробирку. Продолжите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите горящую спиртовку. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции.
Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
Опишите, как можно распознать водород.
Опыт №2: Получение, собирание и распознание аммиака
Соберите прибор и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!) На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2-3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую или лакмусовую бумажку.
Вопросы и задания
Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции.
Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
Опишите не менее двух способов распознавания аммиака.
Опыт №3: Получение, собирание и распознавание кислорода
Соберите прибор и проверьте его на герметичность. В пробирку насыпьте примерно на 1/4 ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
Что происходит при нагревании перманганата калия Составьте уравнение реакции.
Составьте уравнение реакции.
Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
Опишите, как вы распознавали кислород.
Опыт №4: Получение, собирание и распознавание оксида углерода (IV).
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1-2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2-3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду подходят пузырьки газа.
Вопросы и задания
Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику.
Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
Опишите, как вы распознавали оксид углерода (IV).
Практическая работа
Решение экспериментальных задач по теме «Неметаллы»
Задача №1: Подтвердите качественный состав сульфата аммония.
Задача №2: Определите опытным путем, в какой из трех пробирок находится соляная кислота, серная кислота и гидроксид натрия.
Задача №3: В трех пронумерованных пробирках даны растворы, часто применяемые в быту: соды (карбоната натрия), поваренной соли (хлорида натрия), аммиачной селитры(нитрата аммония).
Испытайте характер среды и докажите, в какой пробирке находится каждое вещество.
![]() Задача №4: Проведите реакции, которые выражаются сокращенными ионными уравнениями: H+ + OH– H2O
Задача №4: Проведите реакции, которые выражаются сокращенными ионными уравнениями: H+ + OH– H2O
![]()
![]() 2H+ +
2H+ + H2O + CO2
H2O + CO2
![]()
![]() Ba2+ +
Ba2+ + BaSO4
BaSO4
Задача №5: Определите, содержит ли поваренная соль примесь сульфатов.
Лабораторная работа
Реакции ионного обмена
Цель работы: Провести реакции ионного обмена между выданными растворами, идущие до конца.
Выданы растворы: Карбонат натрия, серная кислота, хлорид бария, гидроксид натрия, фенолфталеин.
Написать уравнения возможных реакций в молекулярном, полном и сокращенном ионном виде.
Лабораторная работа
Основания
В пробирку налейте немного щелочи, добавьте каплю фенолфталеина, а затем добавляйте соляную кислоту до обесцвечивания. Напишите уравнение реакции в молекулярном и ионном виде.
В пробирку наливаем 1мл раствора медного купороса и добавляем по каплям раствора щелочи до выпадения осадка.
Полученный в предыдущем опыте осадок осторожно нагрейте. Какие происходят изменения?
К раствору хлорида железа (III) прибавляем по каплям раствор щелочи. К выпавшему осадку приливаем кислоту до тех пор, пока осадок не растворится. Напишите все уравнения реакций.
Лабораторная работа
Кислоты
К грануле цинка добавляем несколько капель соляной кислоты. Для ускорения химической реакции содержимое можно нагреть. Напишите уравнения реакций.
К выданному оксиду меди (II) добавить 1 мл серной кислоты и смесь нагреть. Обратите внимание на изменение цвета раствора. Напишите уравнения реакций.
К раствору соды добавляем раствор серной кислоты. Что выделяется в ходе реакции? Напишите уравнения реакций.
В серную кислоту добавить несколько капель метилоранжа, а затем добавляем щелочь до изменения окраски раствора. Напишите уравнения реакций.
Лабораторная работа
Соли
Вам выданы растворы гидроксида натрия, серной кислоты, хлорида бария, карбоната натрия, фенолфталеина, сульфата меди (II), железный гвоздь, цинковая гранула, алюминиевая фольга. Проведите все возможные опыты, характерные для солей. Напишите все уравнения реакций.
Лабораторная работа
Определение рН растворов
Испытайте с помощью универсальной индикаторной бумаги растворы следующих соединений хлорида натрия, гидроксида калия, соляной кислоты, хлорида алюминия, сульфата меди (II), карбоната натрия, силиката калия. Сравните окраску универсальной индикаторной бумаги с помощью эталонной шкалы, определите характер среды.
Лабораторная работа
Изучение скорости химической реакции
| № | Опыты | Факторы | Выводы |
| 1 | CH3COOH(1:5) H2SO4(1:5) Zn | Природа реагирующих веществ |
|
| 2 | H2SO4(1:5)Zn H2SO4(3:2)Zn | Концентрация |
|
| 3 | H2SO4(1:5) Zn | Температура |
|
| 4 | H2SО4(1:5) Fe (порошок) Fe (гвоздь) | Поверхность соприкосновения реагирующих веществ |
|
| 5 | Mn O2 H2O2( 3% - ный) | Катализатор
|
|
Скорость гомогенных реакций определяется изменением концентрации одного из вступивших в реакцию веществ в единицу времени
V гомог = - 
Скорость гетерогенной реакции определяется изменением количества веществ, вступившего в реакцию, в единицу времени на единице поверхности:
Vгетер = 
Правило Вант – Гоффа: при повышении температуры на каждые 100 С скорость большинства реакций увеличивается в 2- 3 раза:
Vt2 = Vt1 · γ(t2-t1)/10
Vt2 - скорость реакции при повышенной температуре
Vt1 - при начальной температуре, γ – температурный коэффициент
Лабораторная работа
Железо и его соединения
Положение в таблице, строение атома, возможные степени окисления железа.
Железо в природе.
Физические свойства.
Химические свойства (выполнение лабораторной работы)
Осуществите превращения:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2(SO4)3
б) Проведите качественные реакции на Fe2+ ; Fe3+ - ионы.
FeSO4 + K3 [ Fe(CN)6 ] ( красная кровяная соль) → ?
FeCl3 + K4 [ Fe(CN)6 ] (желтая кровяная соль) → ?
FeCl3 + KCNS ( роданид калия) → ?
Применение железа и его соединений.
Сплавы на основе железа.
Лабораторная работа
Алюминий и его соединения
Изучите действие на алюминиевую фольгу растворов гидроксида натрия, серной кислоты, раствора сульфата меди (II)
Получите амфотерный гидроксид алюминия и докажите его амфотерность. Напишите уравнения реакций.
Испытайте растворы солей алюминия (сульфата и хлорида) с помощью синей лакмусовой бумаги. Как изменяется окраска индикаторной бумаги? Поясните это явление.
Почему нельзя пользоваться алюминиевой посудой для хранения растворов карбоната натрия и карбоната калия (соды и поташа)?
26

 Получите свидетельство
Получите свидетельство Вход
Вход







 CuSO4+NaOH
CuSO4+NaOH
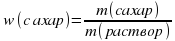













 Учебное пособие по химии "Практикум. Органическая и неорганическая химия" (0.9 MB)
Учебное пособие по химии "Практикум. Органическая и неорганическая химия" (0.9 MB)
 0
0 538
538 33
33 Нравится
0
Нравится
0


