Контрольно – корректирующая технология обучения (ККТО)
Календарно - тематическое планирование по химии 11 класс при изучении темы: «Углеводороды. Природные источники углеводородов» (9 часов)
Цель: Организация деятельности учащихся, направленной на прочное усвоение знаний по строению, номенклатуре, изомерии алканов. Дать понятие класса алканов, их общую формулу, гомологический ряд, рассмотреть строение метана и sp3-гибридизацию; способствовать усвоению гомологии, изомерии и номенклатуры, характерной для класса алканов; проверить уровень усвоения учебного материала по теме урока.
| ОВУ | ИВУ | СРУЭ | ЛЗ | ИК |
| 1 ч | 1 ч | 3 ч | 2 ч | 2 ч |
ОВУ – организационный ввод учителя
ИВУ – информационный ввод учителя
СРУЭ – самостоятельная работа с учебными элементами
ЛЗ – лабораторное занятие
ИК – итоговый контроль
| Учебный элемент | Название УЭ |
| УЭ1 | Общая характеристика алканов. Гомологический ряд |
| УЭ2 | Строение алканов |
| УЭ3 | Номенклатура алканов |
| УЭ4 | Физические свойства алканов |
ИНФОРМАЦИОННЫЙ ЛИСТ
| Учебный элемент | Вид контроля |
| УЭ1 | ПР1, ТК, УК |
| УЭ2 | ПР1, УК, ЭК |
| УЭ3 | ТК1, ПР, УК |
| УЭ4 | ПР. УК, Т |
ПР – письменная работа
УК – устный контроль
ТК – тестовый контроль
ЭК – экспериментальный контроль (работа с электронным учебником)
ЛИСТ КОНТРОЛЯ
В результате изучения темы учащиеся должны
| Знать | Уметь |
| 1. Определение понятий: -общая формула класса соединения; - молекулярная формула соединения; - структурная формула соединения. 2. Строение молекулы соединения (длина связи, валентный угол, тип гпбридизации). 3. Правила техники безопасности. 4. Название углеводородов. 5. Правила составления формул органического соединения. 6. Физические свойства соединений. 7. Нахождение веществ в природе 8. Химические свойства веществ. 9. Способы получения 10. Области применения | 1. Дать определение понятий. 2. Дать характеристику строения вещества. 3. Выполнять правила техники безопасности. 4. Называть вещества по формулам. 5. Составлять структурные и молекулярные формулы. 6. Описывать физические свойства. 7. Называть источники веществ в природе. 8. Составлять уравнения реакций. 9. Составлять уравнения получения веществ в лаборатории и промышленности. 10. Называть области практического применения соединений. |
УЭ1: Общая характеристика алканов. Гомологический ряд
КТ1 : Задание:
Используя текст учебника, дайте характеристику гомологического ряда алканов согласно плану:
1. Общая формула
2.Родовой суффикс
3. Виды изомерии
4. Номенклатура
Алканы, или парафины – предельные углеводороды, состав молекул которых отвечает общей формуле СnH2n+2. Они образуют гомологический ряд метана. Названия первых четырех членов ряда – исторические, а последующих производятся от соответствующих греческих числительных с добавлением окончания –ан.
Молекулы алканов могут иметь неразветвленные и разветвленные цепи из атомов углерода, соединенных между собой σ – связями. Атомные орбитали этих атомов, не перекрывающиеся между собой (между атомами углерода), участвуют в образовании σ – связей с атомами водорода.
Вокруг каждого атома углерода имеются по четыре максимума электронной плотности в соответствии с тем, что он образует четыре эквивалентные σ – связи. Поэтому углы между этими связями тетраэдрические (109,50), что, естественно, нельзя изобразить на плоском рисунке, и придется об этом все время помнить.
Названия и число структурных изомеров некоторых углеводородов ряда метана CnH2n+2
| N | Название n- алкана | Число изомеров |
| 1 | Метан | 1 |
| 2 | Этан | 1 |
| 3 | Пропан | 1 |
| 4 | Бутан | 2 |
| 5 | Пентан | 3 |
| 6 | Гексан | 5 |
| 7 | Гептан | 9 |
| 8 | Октан | 18 |
| 9 | Нонан | 35 |
| 10 | Декан | 75 |
Алканы – вещества молекулярного строения. Поэтому их физические свойства определяются сравнительно слабыми межмолекулярными силами.
В нормальных условиях – С1-С4 – газы, С5-С17 – жидкости, а углеводороды с количеством атомов углерода больше 18 – твердые вещества.
С ростом цепи повышается температура кипения и плавления. Разветвленные алканы имеют более низкие температуры кипения, чем нормальные.
Алканы нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Легко смешиваются друг с другом.
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами.
Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят к структурной изомерии. Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т.е. начиная с бутана.
Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия). В этом случае использование структурных формул недостаточно и следует применять модели молекул или специальные формулы – стереохимические (пространственные) или проекционные.
Алканы, начиная с этана Н3С – СН3, существуют в различных пространственных формах (конформациях), обусловленных внутримолекулярным вращением по σ – связям С – С, и проявляют так называемую поворотную (конформационную) изомерию.
По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
правила систематической номенклатуры:
1. В формуле молекулы алкана выбираем главную цепь — самую длинную.
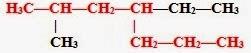
2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). (Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими) Заместители перечисляем по алфавиту.
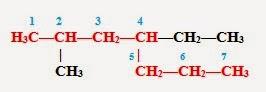
3. Называем углеводород: вначале указываем (цифрой) место расположения заместителя, затем называем этот заместитель (радикал), а в конце добавляем название главной (самой длинной) цепи.
Таким образом, углеводород может быть назван: 2 - метил - 4 - этилгептан (но не 6-метил-4-этилгептан).
КТ2
Тест по теме: Общая характеристика алканов.
1. Первый представитель ряда алканов называется:
А) бутан
Б) пропан
В) октан
Г) метан
2. Общая формула алканов:
А) СnH2n
Б) СnH2n+2
В) СnH2n-2
Г) СnHn
3. Атомы углерода в алканах находятся в состоянии:
А) sp-гибридизации
Б) Pp-гибридизации
В) Sp3-гибридизации
Г) в негибридном состоянии
4. Валентный угол в алканах равен:
А) 1090
Б) 1800
В) 900
Г) 2700
5. Молекула метана имеет строение:
А) октаэдрическое
Б) плоскостное
В) тетраэдрическое
Г) гексагональное
6. Каждый последующий представитель гомологического ряда органических соединений отличается от предыдущего на гомологическую разность, равную:
А) СН
Б) СН3
В) СН4
Г) СН2
7. Чтобы дать название радикалу, необходимо заменить –ан в названии алкана на:
А) –ин
Б) –ил
В) –ен
Г) – диен
8. Вещество СН3-СН(СН3) - СН(СН3)- СН3 называется:
А) 2,3,4- триметилоктан
Б) н-гексан
В) 2,3- диметилбутан
Г) 3,4 – диметилпентан
9. Вещество 2,2 –диметилпропан по-другому можно назвать:
А) октан
Б) тетраметилметан
В) 2-метилпропан
Г) пентан
10. Седьмой представитель ряда алканов называется:
А) октан
Б) нонан
В) декан
Г) гептан
Коррекционная карточка №1 к УЭ1
На оценку «3»
1. Запишите в тетрадь общую формулу предельного углеводорода, бутана, гептана
2. Составить структурную формулу 2-метилбутана
3. Записать уравнение реакции: горения метана
На оценку «4»
1. Записать в тетради общую формулу предельного углеводородного радикала, этила, бутила.
2. составить структурную формулу:
3-метил-5-этилгптан
3. Составьте уравнение:
Метан – ацетилен
На оценку «5»
1. Определите формулу предельного углеводорода, содержащего 75 % углерода и 25% водорода
2. Составить электронную формулу:
2-хлорпропана
3.Сколько грамм натрия понадобиться для получения 20 грамм пентана.
Коррекционная карточка №2 к УЭ2
Коррекционная карточка №3 к УЭ3
1 уровень
Для вещества, имеющего строение
СН3 – СН –СН - СН3


СН3 СН3
Составьте формулы одного гомолога и двух изомеров. Дайте им названия по систематической номенклатуре.
2 уровень
Дано вещество 2-метилбутан. Составьте формулу по названию, приведите по одному примеру гомолога и изомера и дайте им названия по систематической номенклатуре.
3 уровень
Решите задачу
При сгорании вещества массой 1,5г образовались оксид углерода массой 4,4г и вода массой 2,7г. относительная плотность паров вещества по воздуху равна 1,03. Установите молекулярную формулу данного вещества.
Цель: Обеспечить усвоение учащимися на уровне восприятия, осмысления и первичного запоминания знаний состава, строения, свойств и применения углерода; закрепить знания обучающихся об аллотропии. Формирование базовых компетентностей современного человека: учебно-познавательной, информационной, коммуникативной, личностного совершенствования.
| ОВУ | ИВУ | СРУЭ | ПЗ | ЛЗ | ИК |
| 1 ч | 1 ч | 6 ч | 2 ч | 2 ч | 2 ч |
ОВУ – организационный ввод учителя
ИВУ – информационный ввод учителя
СРУЭ – самостоятельная работа с учебными элементами
ПЗ – практическое занятие
ЛЗ – лабораторное занятие
ИК – итоговый контроль
| Учебный элемент | Название УЭ |
| УЭ1 |
|
| УЭ2 |
|
| УЭ3 |
|
| УЭ4 |
|

 Получите свидетельство
Получите свидетельство Вход
Вход











 Технология урока (41.47 KB)
Технология урока (41.47 KB)
 0
0 500
500 8
8 Нравится
0
Нравится
0






