| Целеполагания | Реализация субъект-субъектных отношений, совместное участие преподавателя и обучающихся в постановке основной дидактической цели урока | Активизирует внимание и мыслительную деятельность при помощи создания проблемной ситуации (стадия вызова –технология критического мышления), мотивация к деятельности.
| Обучающиеся повторяют правила техники безопасности при проведении химических опытов. Пытаются самостоятельно определить тему урока. | Развитие естественного интереса и любознательности. Преподаватель читает стих. «Эти явления знаете вы,
В природе и в быту встречаются они,
А отличают эти явления взаимные превращения,
При которых образуются всегда новые вещества». |
| Актуализация знаний | Подготовка обучающихся к активному усвоению нового материала через повторение и актуализацию опорных знаний. Давайте вспомним из материала 8-го класса, что такое физические и химические явления? Привести примеры. Ответ: Физическими наз.явления, при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние или форма. Напр. , плавление стекла, испарение или замерзание воды. Химическими наз. явления, в результате которых из данных веществ образуются другие, отличающиеся от них по составу или строению. Химические явления называют химическими превращениями или химическими реакциями. Напр. Сгорание топлива, ржавление железа, скисание молока. Сегодня на уроке мы должны выявить признаки и условия протекания химических реакций, изучить их классификацию или типы, изучить понятия степень окисления, катализатор. Для того, чтобы впоследствии хорошо овладев этой темой, вы без труда смогли осуществлять цепочки химических превращений, решать всевозможные химические задачи, в том числе и связанные с вашей профессией. (слайд 3) Например, составить химическое уравнение для следующего текста задачи : Медный наконечник паяльника при нагревании покрывается слоем оксида меди (II). Если нагретым паяльником прикоснуться к раствору хлорида аммония, то … ? Попробуйте записать уравнение реакции.
| Устанавливает уровень опорных знаний по теме из курса 8 класса основной школы, актуализирует прежние знания, организует диалог в виде фронтальной беседы с целью уточнения уровня знаний.
| Каждый обучающийся включается в конкретную деятельность на уже освоенном материале. | Обучающиеся затрудняются составить уравнение реакции и решить задачу. Переносится на конец урока. |
| Изучение нового материала | Итак, при химических реакциях исходные вещества превращаются в другие вещества, обладающие другими свойствами. Вопрос: по каким же внешним признакам можно судить о том, что протекает химическая реакция? Давайте проверим (ДЕМОНСТРАЦИЯ: медный купорос+щелочь = осадок+ кислота; спирт+ борная кислота) Ответ: 1) выделение теплоты; 2) изменение окраски; 3) появление запаха; 4) образование осадка; растворение осадка 5) выделение газа . У:. Итак, Мы с вами разобрались- что такое химические реакции, с условиями их возникновения и с их признаками, теперь давайте разберемся с их классификацией. ( слайд 6). (слайд 7) Типы химических реакций. По числу и составу реагирующих веществ По тепловому эффекту По признаку обратимости По признаку изменения степеней окисления По агрегатному состоянию веществ 6. По наличию катализатора ( слайд 8). 1. По числу и составу реагирующих веществ:
| Реакции соединения | Реакции разложения | Реакции замещения | Реакции обмена | | Из нескольких веществ образуется одно новое вещество | Из одного вещества образуется несколько новых веществ | Атомы простого вещества замещают атомы одного из элементов в сложном веществе | Два сложных вещества обмениваются своими составными частями | | S + O2 = SO2 где SO2 - оксид серы (IV) | 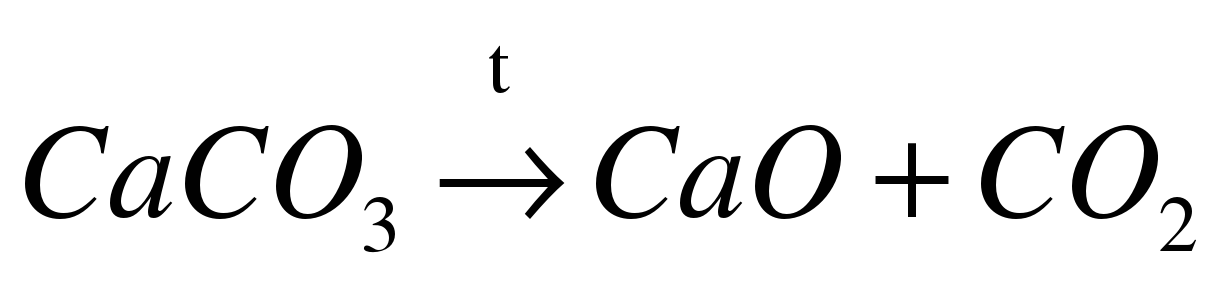
г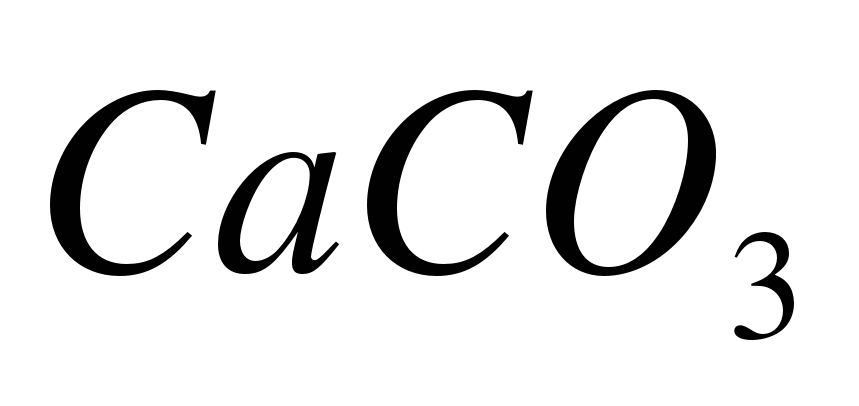 де - карбонат кальция де - карбонат кальция | Zn + 2HCl = = ZnCl2 + H2↑ где HCl – соляная кислота, ZnCl2 - хлорид цинка | Раствор нитрата свинца взаимодействует с иодидом калия, в результате реакции образуется осадок иодида свинца и нитрат калия.
| Демонстрационный опыт – взаимодействие цинка с соляной кислотой
Особый вид реакции обмена представляет собой реакция нейтрализации: взаимодействие растворов щелочей и кислот. Попробуйте записать уравнение ? NaOH + HCl = NaCl + H2O ( слайд 9). 2. По тепловому эффекту: !ДЕМОНСТРАЦИЯ! Предварительно измеряют температуру воды термометром. NaOH растворяют в воде. Поднимается температура. ( слайд 10).
!ДЕМОНСТРАЦИЯ видео! Эндотермические и экзотермические реакции. ( слайд 11). 3. По признаку обратимости:
Признаки необратимости: !Демонстрационный опыт – взаимодействие серной кислоты с хлоридом бария. Добавить индикатор и определить характер среды. ( слайд 13). 4. По признаку изменения степени окисления: Степень окисления - условный заряд атомов в химическом соединении, если предполагают, что оно состоит только из простых ионов. Окислительно – восстановительные реакции ( ОВР) протекают с изменением степени окислении. Рассмотрим процесс на примере одной из реакций замещения – алюминотермии +3 -2 0 0 +3 -2 Fe2O3 + 2Al = 2Fe + Al2O3
0 - +3 Al – 3e = Al - вещество, отдающее электроны называют восстановителем +3 - 0 Fe + 3e = Fe - вещество, принимающее электроны называют окислителем.
( слайд 14). По агрегатному состоянию веществ: Гомогенные и гетерогенные !Демонстрационный опыт - взаимодействие железа с раствором сульфата меди!
6. По наличию катализатора: ( слайд 16). !ДЕМОНСТРАЦИЯ видео.! Каталитические реакции
Этап эмоциональной разгрузки ( слайд 17). 1. Он бежит по проводам,
Он бывает тут и там.
Свет зажег, нагрел утюг
... - наш лучший друг.
Если в атом он попал -
То, считай, почти пропал:
Он с утра и до утра
Носится вокруг ядра. ( слайд 18). 2. .В сильных электромагнитных полях в воздухе вокруг силовых кабелей и других электрических устройств образуется озон. Формула озона? ( слайд 19). 3.Пусть математик удивится:
Один прибавив к одному,
У химика равно один.
(Реакция соединения) 4. Скажите, что это такое:
Один нырнул, а всплыло – двое.
(Реакция разложения)
| Создает проблемную ситуацию
При помощи исследовательского демонстрационного эксперимента подводит обучающихся к самостоятельному выводу.
Проводит инструктаж по самостоятельному заполнению таблицы
Создает проблемную ситуацию
При помощи исследовательскихдемонстрационных экспериментов подводит обучающихся к самостоятельному выводу.
Обеспечивает восприятие, осмысление и первичное запоминание знаний о типах химических реакций, степени окисления, катализаторе.
Создает благоприятный психо-эмоциональный фон
|
Обучающиеся наблюдают, осмысливают и обсуждают результаты эксперимента
Выполняют самостоятельную работу
Обучающиеся наблюдают, осмысливают и обсуждают результаты эксперимента
Обучающиеся принимают активное участие в проведении экспериментов, наблюдают, осмысливают и обсуждают результаты
|
элемент технологии медиаобразования «обучающийся должен переводить информацию в другую знаковую систему»
Обучающиеся затрудняются записать уравнение
Творческий характер работы обучающихся, основанный на репродуктивной деятельности.
|
| Первичная проверка знаний | ( слайд 20). Лови ошибки!
С + O2 = СO2 + Q – реакция разложения, экзотермическая N2 + O2 = 2NO – Q – реакция эндотермическая, соединения H2 (г)+ Cl2 (г) = 2HCl (г) – гетерогенная, соединения Zn + 2HCl = ZnCl2 + H2↑ - реакция обмена, ОВР
Давайте повторим, то о чем говорилось на занятии: Определение химической реакции. Признаки химических реакций Условия протекания химических реакций Перечислите типы химических реакций какие реакции называют реакциями соединения, разложения, замещения, каталитическими, обратимыми, окислительно-восстановительными, эндотермическими ( - Q)? Катализаторы? Степень окисления?
(слайд 21) Упражнение 1. Вам предложен бессистемный перечень реакций. Требуется их классифицировать по типам при помощи таблицы. |
| Уравнение реакции | Ключ | | 1. | М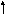 g + H2 SO4 = Mg SO4 + H2 g + H2 SO4 = Mg SO4 + H2 | Замещения ОВР | | 2. | CaCO3 = CaO + 2 С O2 - Q | Разложения, эндотермическая | | 3. | 2 К N О3 = 2 К N О2 + О2 К N О3 = 2 К N О2 + О2 | разложения | | 4 | HCl+ NaOH=NaCl+ H2O | Обмена, гомогенная | | 5. | SО3 + H2 O = H2 SO4 | соединения | | 6. | Cu SO4 + 2 КOH = Cu ( OH) 2 + K 2SO4 | обмена | | 7. | 2SO2 + O2 2SO3 | Соединения, обратимая
|
(слайд 23). Упражнение 2. Охарактеризуйте химическое уравнение в соответствии с классификацией: 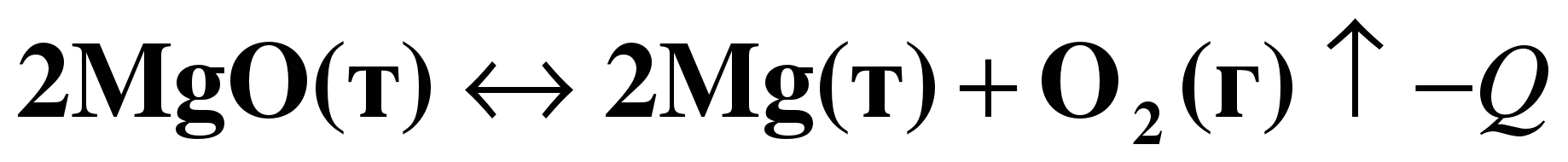
1. Реакция разложения 2. Реакция ОВР, так как у элементов изменились степени окисления. 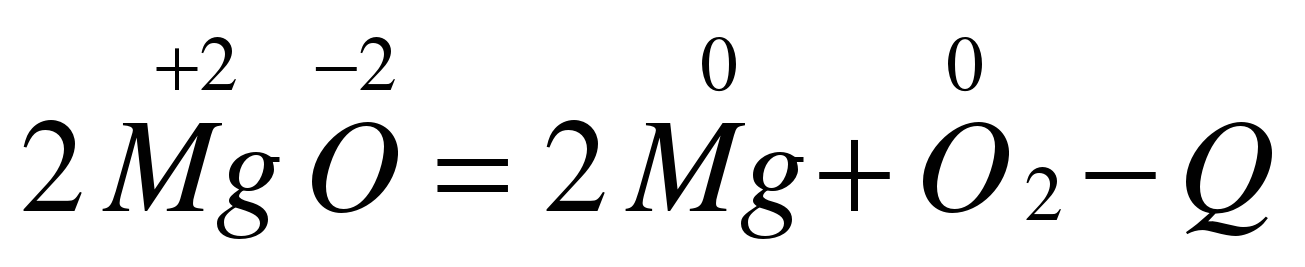
3. По тепловому эффекту – реакция эндотермическая. 4. Гетерогенная реакция 5. Необратимая реакция
Теперь сверим свои ответы с ключом (Слайд 24). Ключ к упр.1 Обсуждение. Упражнение 4. Из предложенных простых и сложных веществ составить уравнения химических реакций и определить тип реакций. 1. H2 SO4 , H2 O , SО3 ( р-я соединения) 2. Mg SO4, Мg , H2 SO4 , H2 ( р-я замещения) 3. Na NО3 , Na OH , H2 O , HNО3 ( р-я обмена)
| Организует проверку усвоения и понимания материала, включая элементы деловой игры. Выявляет качество и уровень овладения знаниями и способами действий.
Организует самостоятельную работу по выполнению заданий.
| . Обучающимся разрешается высказывать свои мысли вслух, спорить, доказывая свою точку зрения.
Активизация мыслительной деятельности. Отвечают на вопросы
Обсуждение. Самооценка.
. Выполнение тестовых заданий с взаимооценкой | Элемент технологии медиа-образования Обучающиеся должны найти ошибки в информации, представленной на слайде и принять меры к их исправлению |
| Подведение итогов. Рефлексия | Давайте повторим, то о чем говорилось на занятии: Определение химической реакции. Признаки химических реакций Условия протекания химических реакций Перечислите типы химических реакций какие реакции называют реакциями соединения, разложения, замещения, каталитическими, обратимыми, окислительно-восстановительными, эндотермическими ( - Q)? Катализаторы? Степень окисления? Рефлексия 1. Перед вами лежит таблица-фиксация знаний, заполните, пожалуйста, графы знаками | Понятия | Знаю «+» | Узнал «!» | Хочу знать «?» | | Химическая реакция |
|
|
| | Признаки химических реакций |
|
|
| | Условия протекания химических реакций |
|
|
| | Катализатор |
|
|
| | Типы химических реакций: -соединения |
|
|
| | -разложения |
|
|
| | -замещения |
|
|
| | -обмена |
|
|
| | -экзо-и эндотермических |
|
|
| | -каталитических |
|
|
| | -обратимых и необратимых |
|
|
| | -ОВР |
|
|
| | Степень окисления |
|
|
|
2. «Плюс-минус-интересно» 1. В графу «П» - «плюс» записывается все, что понравилось, информация и формы работы, которые вызвали положительные эмоции. В графу «М» - «минус» записывается все, что не понравилось, показалось скучным, вызвало неприязнь, осталось непонятным; или информация, которая, по вашему мнению, оказалась не нужной, бесполезной с точки зрения решения жизненных ситуаций. В графу «И» - «интересно» вписывают все любопытные факты, о которых узнали и что бы еще хотелось узнать по данной проблеме, вопросы к преподавателю. | П (плюс) | М (минус) | И (интересно) | |
|
|
|
| Предлагает анкеты-рефлексию, используются методы стимулирования и мотивации познавательной деятельности | Анализируют и оценивают собственные интеллектуальные операции, выявляют степень освоенности содержания, владение действиями, понимание смысла изученного и понимание степени личностных приращений. |
|

 Получите свидетельство
Получите свидетельство Вход
Вход



 g + H2 SO4 = Mg SO4 + H2
g + H2 SO4 = Mg SO4 + H2 К N О3 = 2 К N О2 + О2
К N О3 = 2 К N О2 + О2








 Технологическая карта проекта урока по химии "Типы химических реакций" (0.18 MB)
Технологическая карта проекта урока по химии "Типы химических реакций" (0.18 MB)
 0
0 1384
1384 266
266 Нравится
0
Нравится
0


