Тема урока: «Щелочноземельные металлы. Нахождение в природе.
Кальций и его соединения»
(9 класс)
Подготовила: учитель химии,
Кочкарова Халимат Масхутовна,
с.п.Кенделен, Эльбрусский район,
Кабардино-Балкария
Цели урока: дать общую характеристику металлов главной подгруппы II группы, рассмотреть основные физические и химические свойства этих элементов, подробно изучить кальций и его соединения.
Обучающие. Создать условия: для систематизации и расширения знаний и умений по данной теме; для закрепления понятий о щелочных и щелочно-земельных металлах и взаимосвязи между группой элементов и их свойствами; показать насколько велико значение этих элементов в жизни человека; создать условия для совершенствования умений находить и формулировать правильный ответ на поставленный вопрос, на основе полученных ранее знаний; зафиксировать в работе учащихся последовательность действий при составлении уравнений реакций, характеризующих происходящие в природе процессы с опорой на имеющийся жизненный опыт.
Развивающие. Стимулировать познавательную активность учеников, развивать интерес к предмету, смекалку, умения быстро и четко высказывать свои мысли, применять свои знания на практике при выполнении тех или иных заданий. Создать условия для развития: умений выделять главное; отстаивать свою точку зрения.
Воспитательные. Продолжить: формирование научного мировоззрения; воспитание положительного отношения к получению знаний, уверенности в своих силах.
Тип урока – изучение нового материала, на котором происходит актуализация знаний по теме, через осознание и осмысление изученной на предыдущих уроках учебной информации, с использованием имеющихся навыков и умений, а также с опорой на жизненный опыт.
Вид урока - объяснительно-иллюстративный, с элементами самостоятельной работы по нахождению правильных ответов на предложенные вопросы и задания, содержащиеся на слайдах.
Методы и методические приемы. Самостоятельная работа по нахождению правильных ответов, составлению уравнений реакций, обсуждение выбранного ответа, демонстрация опытов, с последующим написанием уравнений реакций, обсуждение результатов работы.
Оборудование: компьютер, проектор, образцы металлов главной подгруппы II группы Mg, Ca (металлические), фенолфталеин, пробирки, чашки Петри, медная проволока, спиртовка, спички.
Единственный путь, ведущий к знанию, – это деятельность.
Б.Шоу
Ход урока.
Организационный момент (3′): сообщение общих целей и задач к уроку.
Проверка знаний (10′): индивидуальный опрос.
1). На прошлом занятии мы изучили щелочные металлы. Вспомните, где в Периодической таблице они расположены?
2). Перечислите их.
3). Какими физическими свойствами обладают щелочные металлы?
4). Сколько электронов на внешнем энергетическом уровне у атомов всех щелочных металлов?
5). Восстановителями или окислителями являются щелочные металлы?
6). Вспомните названия соединений щелочных металлов и составьте их формулы:
1. Каустическая сода. NaOH
2.Кальцинированная сода. Na2CO3
3.Пищевая сода. NaHCO3
4.Калиевая селитра. KNO3
5.Поташ. K2CO3
1. Каустическая сода. А) KNO3
2.Кальцинированная сода. Б) NaOH
3.Пищевая сода. В) K2CO3
4.Калиевая селитра. Г) Na2CO3
5.Поташ. Д) NaHCO3
7). Используя схему, напишите уравнения соответствующих реакций:
NaH
↑
NaCl ← Na → Na2O2
↓
NaNO3 ← NaOH → Cu(OH)2
2Na + H2 = 2NaH NaOH + HNO3 = NaNO3 + H2O
2Na + Cl2 = 2NaCl 2NaOH + Cu(NO3)2 = Cu(OH)2 + 2NaNO3
2Na + O2 = Na2O2
2Na + 2H2O = 2NaOH + H2
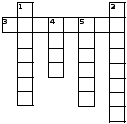
3). Кроссворд 1.
По горизонтали: 3.Общее название металлов IА группы.
По вертикали: 1.Если в Периодической таблице условно провести линия от бора к астату, то в нижнем правом углу находятся ….2.Na + O2  … . 4.Степень окисления металла в сульфате калия. 5…. + S
… . 4.Степень окисления металла в сульфате калия. 5…. + S  Na2S.
Na2S.

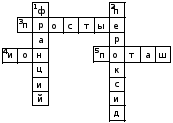
Кроссворд 2.
По горизонтали: 3.Вещества, состоящие из атомов одного химического элемента. 4. Na+. 5. K2CO3.
По вертикали: 1. Самый сильный восстановитель периодической системы. 2. Продукт взаимодействия натрия с кислородом.

Изучение нового материала (20′).
Сегодня мы познакомимся с элементами IIА-группы – щелочноземельными металлами. Сначала изучим особенности строения атомов, затем нахождение в природе, физические и химические свойства веществ, свойства и применение соединений.
Во IIА-группу входят элементы: бериллий, магний, кальций, стронций, барий и радий. Последние четыре элемента получили название «щелочноземельных». 
Такое название обусловлено тем, что в природе встречаются в основном в составе карбонатов, прокаливание которых и дальнейшее растворение продуктов этой реакции приводит к образованию щелочных растворов. Отсюда и название щелочные земли.
Особенностью строение атомов IIА группы является то, что на внешнем электронном слое у них находится по два электрона, поэтому в химических реакциях они будут выступать в роли восстановителей, отдавая два внешних электрона и превращаясь в катионы с зарядом 2+.
Атомы ЩЗ металлов и их соли окрашивают пламя в разные цвета: кальций – в кирпично-красный цвет, стронций в красный, барий – в зеленый.

Таким образом, используя это свойство химических элементов также можно распознавать соли ЩЗ металлов.
(учащиеся наблюдают окрашивание пламени для кальция, магния и бария)
В природе ЩЗ металлы в самородном состоянии не встречаются. Самые распространенный из них – магний и кальций входят в состав минералов, в основном содержащих карбонаты и сульфаты этих элементов. Также соли кальция и магния растворимы в воде, содержатся в пресной и морской воде. Радий является радиоактивным элементом и встречается в природе в составе минералов, содержащих уран.

Теперь рассмотрим химические свойства элементов IIА группы – простых веществ, образованных этими элементами. Простые вещества, образованные элементами IIА группы являются довольно активными веществами. Причем их активность увеличивается от бериллия к радию, т.е. сверху вниз по главной подгруппе.
ЩЗМ как и ЩМ нельзя хранить на воздухе. Их хранят под слоем керосина, так как на воздухе они очень быстро окисляются. При взаимодействии ЩЗМ с кислородом образуется оксид этого металла:
2Ba + O2 = 2BaO + Q
А не пероксид как в случае некоторых ЩМ. ЩЗМ и бериллий с магнием могут взаимодействовать также с другими неметаллами. С серой они образуют сульфиды:
Mg + S = MgS
С хлором и другими галогенами – галогениды:
Mg + CL2 = MgCL2 (хлорид магния)
С фосфором – фосфиды:
3Ca + 2P = Ca3P2 (фосфид кальция)
С водородом – гидриды металлов:
Ba + H2 = BaH2 (гидрид бария)
ЩЗМ энергично реагируют с водой.
(Демонстрация эксперимента).
При этом выделяется большое количество теплоты, из продуктов реакции образуется щелочь и водород. Например, кальций при взаимодействии с водой образует гидроксид кальция:
Ca + 2H2O = Ca(OH)2 + H2
(доказывается щелочность раствора с помощью фенолфталеина)
Такие реакции являются экзотермическими.
Экзотермические реакции – реакции, которые протекают с выделением теплоты. Эндотермические реакции – реакции, протекающие с поглощением теплоты.
Бериллий, магний и ЩЗМ стоят в ряду напряжений левее водорода. Поэтому они могут вступать в реакции замещения с кислотами. Бериллий является переходным элементом, а значит, он может реагировать как с кислотами, так и со щелочами. Оксид и гидроксид бериллия являются амфотерными веществами, а значит, вступают в реакцию и с кислотами и со щелочами. Гидроксид бериллия реагируя с соляной кислотой, образует хлорид бериллия и воду:
Be(OH)2 +2 HCL = BeCL2 + 2H2O
Гидроксид бериллия также реагирует с концентрированными растворами щелочей:
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
тетрагидроксобериллат натрия
Остальные оксиды и гидроксиды ЩЗМ проявляют основные свойства, а значит, вступают в реакцию с кислотами. Причем гидроксид магния – нерастворимое в воде соединение, а вот гидроксиды ЩЗМ – кальция, стронция, бария и радия, - являются щелочами. Гидроксиды металлов 2А-группы разлагаются при нагревании, при этом образуется оксид металла и вода:
Mg(OH)2 = MgO + H2O
И некоторые нерастворимые карбонаты металлов 2А-группы разлагаются на оксид металла и углекислый газ:
CaCO3 = CaO + CO2
Гидроксид кальция Ca(OH)2 – гашеная известь, его насыщенный растор в воде называют известковой водой, а взвесь его в воде носит название «известковое молоко».
Ca(OH)2 + CO2 = CaCO3 + H2O
| Виды жесткости воды | Присутствующие ионы | Способы устранения жесткости воды |
| Временная (карбонатная) | Са+2; Mg+2 HCO3- | 1.Кипячением 2.Добавлением соды или Са(ОН)2 |
| Постоянная | Ca+2, Mg+2 SO4-2, Cl- | 1.Добавлением соды 2.Использование катионообменников |
| Общая | Ca+2, Mg+2 HCO3-, SO4-2, Cl- | Сочетание вышеуказанных способов |
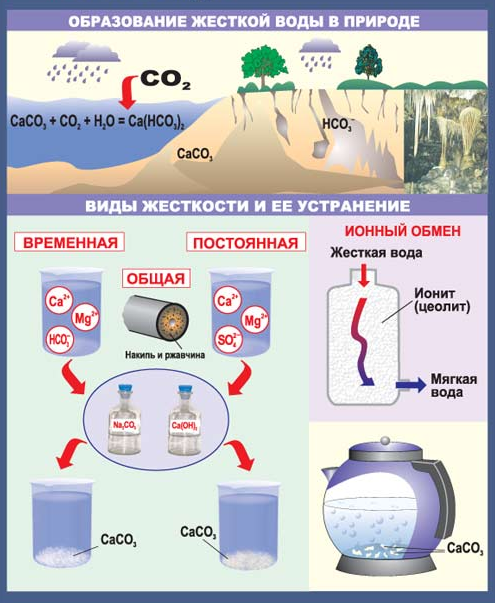
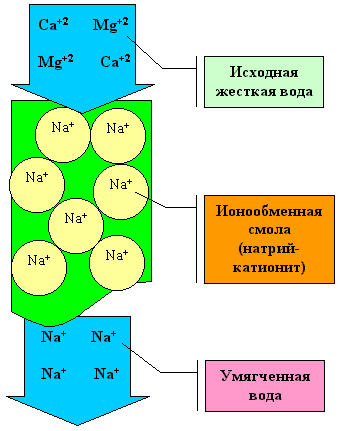
Соли бериллия, бария, стронция и радия являются ядовитыми, а вот соли кальция и магния жизненно необходимы живым организмам. Кальций входит в состав скорлупы яиц, домиков улиток, а также костей человека и животных. Магний входит в состав хлорофилла – зеленого пигмента, который участвует в процессе фотосинтеза у растений. Бериллий, магний и ЩЗМ широко применяются в промышленности и технике.
Закрепление (10′).
1). Игровая пятиминутка. «Определите металл»
1.Этот металл используют для металлотермии – восстановления редких металлов из их руд.
2.Сульфат данного элемента, известный под названием горькой, или английской, соли, используется в медицине в качестве слабительного средства.
3.Морская соль имеет горький вкус из-за наличия в ней катионов данного металла.
4.Сжигание данного металла сопровождается ослепительной вспышкой, поэтому его раньше применяли при фотографировании.
5.В его атоме на внешнем уровне два электрона, все электроны размещены на трёх энергетических уровнях.
Ответ: магний.
1.Вследствие высокой химической активности этот металл не пригоден для изготовления изделий.
2.В организме взрослого человека содержится более 1 кг данного элемента в виде фосфата.
3.Этот металл был впервые получен Г. Дэви в 1808 г.
Соединения этого элемента широко используется, например, в строительстве. 4.Мел, мрамор, известняк - это его карбонат.
5.В его атоме на внешнем уровне два электрона, все электроны размещены на четырёх энергетических уровнях.
Ответ: кальций.
2). Продолжите высказывание.
| 1. Оксид кальция получают в промышленности: | а) при разложении сульфата кальция;
б) Взаимодействием кальция с кислородом;
в) разложением карбоната кальция;
г) действием на соли кальция щелочью. |
| 2. С какими из перечисленных веществ взаимодействует оксид бария: | а) H2SO4; в) SO3;
б) CaO; г) NaOH. |
| 3. С какими из перечисленных веществ взаимодействует гидроксид кальция: | а) HNO3 б) Mg(OH)2;
в) Li2O г) CO2;
|
| 4. У кальция электроны распределены по энергетическим уровням. | а) 2,8.8,3;
б) 2,8,8,1;
в) 2,8,8,2. |
| 5. Кальций проявляет свойства. | а) Окислительные;
б) Восстановительные;
в) Окислительные и восстановительные. |
| 1.Наиболее выраженные металлические свойства проявляет: | а) Al; в) Mg;
б) Na; г) Be. |
| 2. Химическая реакция проходит между: | а) Mg и ZnSO4 (раствор);
б) Cu и FeSO4 (раствор);
в) Ag и AlCl3 (раствор); г) Pb и Mg(NO3)2 (раствор). |
| 3.На внешнем энергетическом уровне один электрон у атомов: | а) щелочно-земельных металлов; б) щелочных металлов; в) алюминия; г) железа. |
| 4.Пламя газовой горелки окрашивается солями натрия в цвет: | а) красный; в) желтый;
б) зеленый; г) фиолетовый. |
| 5.Укажите общую формулу гидридов щелочных металлов: | а) MeH2; в) MeH3;
б) MeH; г) MeH4. |
Задача: Определите состав английской (горькой) соли, используемой медиками для снижения артериального давления, при некоторых заболеваниях нервной системы, в качестве слабительного средства, если массовые доли элементов в ней составляют в %: магния – 9,86; серы – 13,01; кислорода – 71,4; водорода – 5,73.
Решение: Возьмём образец вещества массой 100г, тогда
m (Mg) = 9,86 г
m (S) = 13,01 г
m (O) = 71,4 г
m (H) = 5,73 г
n (Mg ) = 9,86 / 24 = 0,41 моль
n (S) = 13,01 / 32 = 0,41 моль
n (O) = 71,4 / 16 = 4,46 моль
n (H) = 5,73 /1 = 5,73 моль
MgXSYOZHK
X:Y:Z:K = n (Mg): n(S): n(O): n(H) = 0,41:0,41:4,46:5,73 = 1:1:11:14
MgSO11H14 – простейшая формула; MgSO4 *7 H2O – истинная формула.
Итоги урока (2′).
Выставление оценок за урок. Д/З. §40-41, с.119-123 (читать), выполнить упр.8-12 и решить задачу 3 на с.125.

 Получите свидетельство
Получите свидетельство Вход
Вход



 … . 4.Степень окисления металла в сульфате калия. 5…. + S
… . 4.Степень окисления металла в сульфате калия. 5…. + S 


















 Щелочноземельные металлы. Нахождение в природе. Кальций и его соединения (1.2 MB)
Щелочноземельные металлы. Нахождение в природе. Кальций и его соединения (1.2 MB)
 0
0 3744
3744 327
327 Нравится
0
Нравится
0


