7
Роль химического эксперимента в профильном обучении химии
Зенкович Алла Алексеевна,
Учитель химии,
МБОУ «СОШ №1»,
г. Абакан, Республика Хакасия
Учителя профильных химических классов находятся, можно сказать, в привилегированном положении в отличие от учителей химии непрофильных классов, где химия изучается 1 час в неделю и подготовить обучающегося к ЕГЭ без репетитора или подготовительных курсов невозможно.
Однако профильные химические классы – это не подготовительные курсы, и задачи наши гораздо шире. Проблему можно сформулировать так: «В каком объеме давать детям углубленные химические знания?» Главная задача - умение дозировать информацию. Не надо стремиться рассказать детям все, что знаешь сам. Нельзя всю лавину информации выплескивать на детей. Первая опасность при этом – часть детей «за деревьями не увидит леса». Вторая опасность – неготовность большинства вузов учить студентов с подобной подготовкой. Ситуация такова, что если в школе изучали бимолекулярное нуклеофильное замещение, энтропию, потенциал Гиббса и другие понятия, рассматриваемые в вузе, то у студента возникает ложное убеждение, что он все знает. Такой студент перестает ходить на лекции, упускает важное, новое, в результате – «хвосты» и исключение.
Одним из путей решения проблемы является отказ от дублирования вузовских программ. Научные знания следует формировать на основе самостоятельного анализа явлений, предметов, процессов. При этом надо стремиться к тому, чтобы учащиеся овладели логическими методами познания. Умение выполнять сложные умственные операции (выделение главного, сравнение, доказательство, обобщение, конкретизация, анализ, синтез) не менее важно, чем знание фактического материала. Большую роль в этом играет химический эксперимент.
Химия-наука экспериментальная. Поэтому обучение этой дисциплины в школе невозможно без использования химического эксперимента. Проведение химического эксперимента на уроках химии также предусмотрено и ФГОС. Требования к предметным результатам освоения углубленного курса включают формирование у учащихся специальных предметных умений работать с химическими веществами, выполнять химические опыты, применять полученные знания и умения для безопасной работы с веществами в лаборатории, быту и на производстве.
Обычно учебные опыты, выполняемые на уроках химии, подразделяют в зависимости от субъекта их проведения на демонстрационные, лабораторные опыты и практические работы. Демонстрационный эксперимент выполняется учителем или учеником для всеобщего обозрения всех учащихся в классе; один проводит опыт, остальные наблюдают за ходом процесса. Лабораторные опыты выполняются, как правило, всеми учениками в классе во время объяснения учителя. Эти опыты должны быть простыми, непродолжительными по времени (2-3 мин) и безопасными в проведении. Все необходимое для лабораторных опытов должно быть заранее подготовлено на столах учащихся. Практические работы – это эксперимент по изучению определенной темы, выполняемый учениками под руководством учителя в течение всего урока.
Практические работы (занятия) бывают двух видов: проводимые по инструкции и экспериментальные задачи. Инструкция является ориентировочной основой деятельности учащихся. В ней подробно в письменном виде должен быть изложен каждый этап выполнения опытов, даны указания как избежать возможных ошибочных действий, указания по технике безопасности к данной работе.
Экспериментальные задачи не содержат инструкции, а только условие. Учащиеся должны самостоятельно разработать план решения и осуществить его на практике, получив тем самым определенный материальный результат.
Само собой разумеется, что каждый вид учебного химического эксперимента имеет свои определенные цели и особенности исполнения. Демонстрационные опыты по химии могут проводиться в виде натуральных процессов или реакций; в виде имитационных опытов, когда одни вещества с целью большей безопасности, наглядности и экономичности заменяются другими; в виде мультимедиа-эксперимента, те есть показа опытов по телевизору, с помощью кинопроектора или компьютера.
К сожалению, сегодня, в период бурного внедрения в учебный процесс информационно-коммуникационных технологий, реальный химический эксперимент все чаще стал подменяться виртуальным. Это происходит из-за отсутствия у педагога времени на подготовку эксперимента, приготовления необходимых растворов. Конечно, проще и быстрее показать любой химический опыт в записи, чем продемонстрировать его самому или организовать его выполнение учащимися.
Вполне очевидно, что необоснованная подмена реального химического эксперимента виртуальным идет вразрез с практико-ориентированным подходом в обучении химии, лишает учащихся возможности получить объективные данные о свойствах веществ, формирования навыков работы с веществами, умения планировать и проводить химический эксперимент, позволяющий проверять теорию практикой.
В профильном классе времени на проведение лабораторных опытов и практических работ достаточно. Поэтому я особое внимание уделяю в своей работе проведению практических и лабораторных работ. Убеждена, что только дав возможность ученику попробовать себя в роли исследователя, экспериментатора, можно добиться усвоения учебного материала. Теория без практики ничто. Одно дело просто провести химическую реакцию, совсем другое – провести химическое исследование.
Высокий уровень подготовки учащихся профильных классов позволяет широко использовать проблемный метод обучения химии. Среди организационных форм постановки химических опытов, приближающих учащихся к научному экспериментальному исследованию, на определенных этапах обучения применяю и такую форму, как проблемный эксперимент. Что следует понимать под проблемным экспериментом? Проблемный эксперимент - это такая форма применения химического эксперимента в обучении, которая дает возможность создать и организовать проблемную ситуацию, вызывая интерес у учащихся к поиску причин наблюдаемого явления. Проблемный эксперимент как самостоятельную форму химического эксперимента можно применять на различных этапах процесса обучения: при изучении нового материала, совершенствовании знаний, обобщении и повторении, закреплении или контроле знаний. Применение проблемного эксперимента можно представить схемой:
 ЭП → П→ Г → Т → В → Э пров
ЭП → П→ Г → Т → В → Э пров
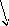
Э иссл
где ЭП- проб. эксперимент, создающий проблемную ситуацию; П - проблема; Г-гипотеза; Т-теория, необходимая для разрешения проблемы; Э иссл. - исследовательский эксперимент, подтверждающий гипотезу и теорию; В - новый вывод; Э пров.-проверочный эксперимент, подтверждающий полученный вывод.
В качестве иллюстрации приведу методику проведения проблемных экспериментальных работ по общей химии в 11 классе «Гидролиз солей»
Гидролиз солей
Цель: формирование представлений о гидролизе солей, самостоятельное решение проблем, возникающих в процессе выполнения экспериментов и формулировка выводов.
Задачи:
В процессе практической работы обучающиеся должны научиться:
определять характер среды в водных растворах;
характеризовать свойства электролитов;
записывать уравнения гидролиза солей в молекулярном и ионном виде.
Оборудование и реактивы. Растворы веществ: HCl, HNO3, H2SO4, NaOH, KOH, Ba(OH)2, NaCl, K2SO4, Na2CO3, CuSO4, лакмус, фенолфталеин.
Ход работы
Опыт 1 Изменение окраски индикаторов в растворах кислот, щелочей, солей
Задание 1. Исследуйте индикаторами растворы HCl, HNO3, H2SO4, NaOH, KOH, Ba(OH)2, NaCl, K2SO4. На идикаторные бумажки с помощью пипетки нанесите по капле каждого из растворов, взятых для этого опыта. Сравните окраску индикатора в каждом растворе.
Учащиеся знакомы со свойствами кислот и щелочей изменять окраску индикаторов. Поэтому они быстро проводят соответствующие реакции с кислотами и щелочами и объясняют изменение окраски лакмуса и фенолфталеина взаимодействием индикатора с ионами H+ и OH–. Растворы хлорида натрия и сульфата калия не изменяют окраску индикаторов, что тоже объяснимо, исходя из теоретических представлений учащихся 9-го класса. При диссоциации средних солей образуются катионы металлов и анионы кислотных остатков, которые с индикаторами не взаимодействуют.
Задание 2 Исследуйте индикаторами растворы солей карбоната натрия и сульфата меди(II).
Возникает проблема, когда цвет индикатора изменяется в растворах карбоната натрия и сульфата меди(II). Причем цвет лакмуса в растворе Na2CO3 становится синим, а в растворе CuSO4 – красным.
Для объяснения наблюдаемых явлений учащиеся выдвигают ряд гипотез, одна из которых – посторонние примеси в растворах двух последних солей. Для проверки этой гипотезы учащимся предлагаются для анализа растворы других солей.
Задание 3 Исследуйте индикаторами растворы следующих солей: CuCl2, Pb(NO3)2, FeCl3, Na2S, K2SO3, CH3COONa, KBr, NaNO3.
Вывод: все соли можно разделить на три группы:
1-я г р у п п а – соли, растворы которых ведут себя по отношению к лакмусу как кислоты;
2-я г р у п п а – соли, растворы которых ведут себя по отношению к лакмусу и фенолфталеину как щелочи;
3-я г р у п п а – соли, растворы которых не изменяют окраску индикаторов.
Гипотезу о посторонних примесях можно считать отвергнутой.
Результаты оформляют в таблицу (кроме последней графы):
| Формула растворенного вещества | Цвет индикаторной бумажки | рН (больше или меньше 7) | Реакция среды (кислотная, щелочная или нейтральная | Подвергается ли соль гидролизу |
|
|
|
|
|
|
По результатам исследований проводится беседа.
Вопрос. Почему растворы солей первой группы изменяют фиолетовую окраску раствора лакмуса на красную?
(Значит, в этих растворах есть ионы H+).
Вопрос. Откуда ионы H+ в растворе, если вы смешивали соль и воду?
(Наверное, из воды).
Вопрос. Как от воды могли отделиться ионы H+?
(Видимо, какая-то частица соли отрывает от молекулы воды частицу OH– Отрицательную частицу от молекулы воды может оторвать положительная частица из соли).
Вопрос.Что же общего у катионов Cu2+, Pb2+, Fe3+? Почему именно они присоединяют гидроксид-ионы? Почему этого не происходит в случае катионов Na+, K+?
(Гидроксиды Сu(OH)2, Pb(OH)2, Fe(OH)3 – cлабые основания, а NaOH, KOH – сильные. Сильные основания в растворе полностью диссоциируют на ионы).
Растворы второй группы солей изменяют фиолетовую окраску лакмуса на синюю. Значит, в их растворах есть гидроксид-ионы. Остатки слабых электролитов – анионы кислотных остатков – взаимодействуют с молекулами воды с образованием ионов OH–. В растворах солей третьей группы нет свободных ионов H+ и OH– . С водой не взаимодействуют остатки сильных электролитов (кислот и оснований).
В результате подобных рассуждений учащиеся самостоятельно приходят к следующим выводам:
1. если соль образована сильной кислотой и слабым основанием, реакция ее раствора будет кислая. Причина кислой среды – взаимодействие катиона (остатка слабого основания) с молекулами воды. Такое взаимодействие называется гидролизом по катиону.
2. Если соль образована слабой кислотой и сильным основанием, реакция ее раствора будет щелочная. Причина щелочной среды – взаимодействие аниона (остатка слабой кислоты) с молекулами воды. Этот процесс называется гидролизом по аниону.
3. Если соль образована сильной кислотой и сильным основанием, реакция ее раствора будет нейтральной. Катионы металла и анионы кислотного остатка таких солей не образуют прочных связей с молекулами воды. Как следствие, в растворах таких солей нет ионов H+ и OH–.
Здесь уместно сделать паузу. В классе обязательно найдется учащийся, который увидит новую проблему. Учить детей самостоятельно видеть проблемы, формулировать их – одна из важнейших задач учителя.
Ученик. А как ведут себя в растворе соли, образованные слабым основанием и слабой кислотой?
Учитель. Попробуйте самостоятельно спрогнозировать результат опыта и аргументировать свой прогноз.
Ученик. Вероятно, реакция раствора такой соли будет нейтральной, ведь ионы H+, образованные при взаимодействии катиона – остатка слабого электролита – с молекулами воды, будут связываться ионами OH–, образованными при гидролизе по аниону.
На фиолетовую бумажку лакмуса нанести каплю раствора ацетата аммония. Цвет не изменяется – реакция раствора нейтральная.
Поэкспериментируем еще с одной солью – сульфидом аммония. При его добавлении фиолетовый лакмус становится синим. Проблема! Обсуждение продолжается еще оживленнее.
Ученик. Сила и слабость электролита – понятия относительные. Сила электролита – сероводородной кислоты – оказалась меньше, чем сила гидроксида аммония, поэтому реакция раствора сульфида аммония щелочная.
У детей, конечно, возникает вопрос: «Как узнать, какой электролит сильнее?» Рассказываю о константах диссоциации кислот и оснований, учу пользоваться справочными данными.
Занятие 2.
Взаимодействие веществ с продуктами гидролиза, совместный гидролиз.
Карта-инструкция
Опыт 1. Влияние температуры на гидролиз ацетата натрия.
Оборудование и реактивы: СН3СООNa, раствор фенолфталеина, спички, пробиркодержатель.
2 мл раствора ацетата натрия прибавьте 1-2 капли фенолфталеина и нагрейте до кипения. Обратите внимание на появление розовой окраски, исчезающей при охлаждении раствора.
Объясните, наблюдаемые явления, имея ввиду, что фенолфталеин служит индикатором на ионы ОН-.
Составьте ионное и молекулярное уравнения гидролиза ацетата натрия.
Оформите работу в соответствии с таблицей.
| Что делали | Что наблюдали | Выводы |
|
|
|
|
|
|
|
|
Опыт 1. Взаимодействие веществ с продуктами гидролиза
Оборудование и реактивы: раствор ZnCI2; Zn – гранулы
Налейте в пробирку 3 мл раствора хлорида цинка. Испытайте реакцию среды индикаторной бумажкой.
В раствор опустите 2 гранулы цинка и нагрейте. Наблюдайте выделение пузырьков газа.
Проанализируйте продукты реакции, объясните происходящие явления.
Составьте ионные и молекулярные уравнения
а)гидролиза хлорида цинка;
б) взаимодействие цинка с продуктами гидролиза.
5) Оформите работу в виде таблицы (см. таблица выше).
Опыт 4. Совместный гидролиз.
Реактивы: Растворы K2CO3, AI2(SO4)3
К 1-2 мл раствора AI2(SO4)3 прилить такой же объем раствора K2CO3.
Наблюдайте выделение пузырьков газа (СО2) и образование осадка.
Напишите ионные и молекулярные уравнения совместного гидролиза взятых солей.
Оформите работу в соответствии с образцом (см. таблицу выше)
Форма проведения занятия.
Обсуждение результатов экспериментов проводится в форме фронтальной эвристической беседы. Я задаю вопросы, позволяющие установить существующие закономерности, сделать выводы. Определения понятий, уравнения реакций, выводы, сформулированные детьми и скорректированные учителем, должны быть записаны каждым учащимся в тетрадь. По ходу обсуждения отмечаю успехи учащихся, в конце урока выставляю им оценки.
Считаю целесообразным использование проблемных и исследовательских экспериментов при изучении следующих тем:
1. Получение и свойства комплексных соединений.
2. Окислительно-восстановительные свойства ионов.
3. Гидролиз солей в водных растворах.
4. Скорость химических реакций. Химическое равновесие.
5. Взаимодействие активных металлов с растворами солей.
6. Изучение свойств соединений хрома, железа и меди.
Во время подобных уроков никогда не возникает проблем с дисциплиной, потому что детям не скучно. Они самостоятельно добывают знания, не получая их от учителя в готовом виде, как это происходит при объяснительно-иллюстративном методе. Знания, полученные таким путем, глубокие и прочные, об этом свидетельствуют результаты контрольных работ и результаты ЕГЭ. После таких практических работ задания на совместный гидролиз и на взаимодействие веществ с продуктами гидролиза выполняются с малым количеством ошибок.
Химический эксперимент в средней школе – уникальная возможность развития в мышлении школьника способностей к анализу, синтезу, конкретизации, обобщению и систематизации нового учебного материала и, как следствие, формирования в сознании субъекта учебно-познавательной деятельности осмысленной им стройной конструкции химической картины мира.
Овладение исследовательскими умениями (ставить цель, выявлять проблему, планировать действия по ее решению, делать умозаключения) способствует формированию личностных качеств, необходимых для успешной социализации в современном мире.
Литература:
Денисова В. Г. Химия 11 класс. Поурочные планы по учебнику О. С. Габриеляна, Г. Г. Лысовой (профильный уровень)
Сурин Ю.В., Балезина С.С. Проблемный эксперимент при изучении гидролиза солей в ХI классе. Химия в школе, 1990, № 3, с. 39–40;

 Получите свидетельство
Получите свидетельство Вход
Вход











 Роль химического эксперимента в профильном обучении химии (36.89 KB)
Роль химического эксперимента в профильном обучении химии (36.89 KB)
 0
0 1006
1006 9
9 Нравится
0
Нравится
0





