
МОУ«Средняя общеобразовательная школа № 36»
Тема урока : Водород
(Урок изучения нового материала)
8 кл.
«Жизнь учит только тех, кто ее изучает».
В.Ключевский

Цель урока
Образовательная:
ознакомить учащихся со свойствами, способами получения и применением водорода.
Развивающая:
развивать любознательность, интерес к познанию,
способствовать проявлению творческих способностей учащихся.
Воспитательная:
воспитывать организованность в работе, развивать умения работать в коллективе.

Оборудование к уроку
Оборудование : спички, спиртовка, лучинка, стакан, пробирка, компьютер, проектор, экран, учебник. Реактивы: Zn, HCl.

План урока
- План характеристики элемента.
1. Химический знак.
2. Относительная атомная масса.
- Валентность.
- Нахождение в природе.
- План характеристики простого вещества .
- Химическая формула.
- Относительная молекулярная масса.
- Физические и химические свойства.
- Получение и применение.

Ход урока
1. Организационный момент (психологический настрой) - 2 мин .
2. Подготовка учащихся к восприятию нового учебного материала, т е актуализация знаний и практических и умственных умений - 2 мин.
3. Изучение нового материала - 31 мин.
4. Закрепление материала, изученного на данном уроке -
6 мин.
6. Подведение итогов урока - 2 мин.
7. Задание на дом (дифференцированное) - 2 мин.

Загадки
1. Гость из космоса пришел,
В воде приют себе нашел .
2. Я - газ легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду!
3. Первый я на белом свете:
Во Вселенной, на планете.
Превращаясь в легкий гелий,
Зажигаю Солнце в небе .

Из истории открытия водорода
Водород был открыт в 1766 году английским химиком Генри Кавендишем . Этот газа Г.Кавендиш назвал «горючим воздухом». Принимая во внимание, что водород можно получить из воды, а при горение водорода образуется вода, А. Лавуазье дал газу название hydrogène - «рождающий воду». Русское наименование «водород» предложил химик М.Ф.Соловьев в 1824 году.
Г.Кавендиш
А.Лавуазье
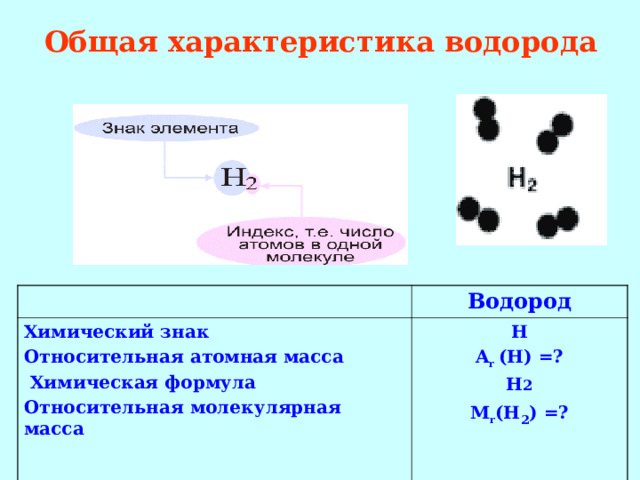
Общая характеристика водорода
Химический знак
Относительная атомная масса
Химическая формула
Относительная молекулярная масса
Водород
Н
A r (Н) =?
Н 2
М r (Н 2 ) =?

Нахождение в природе
В космосе водород - главный элемент.
- В космосе водород - главный элемент.
Водород является одним из наиболее распространённых элементов - атмосферы, гидросферы и литосферы. В свободном состоянии практически весь водород на Земле находится в виде соединений. Свободный водород состоит из молекул Н 2 . Он часто содержится в вулканических газах. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов.
- Водород является одним из наиболее распространённых элементов - атмосферы, гидросферы и литосферы. В свободном состоянии практически весь водород на Земле находится в виде соединений. Свободный водород состоит из молекул Н 2 . Он часто содержится в вулканических газах. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов.

Строение водорода H 2
В центре атома находится положительное заряженное ядро. Вокруг вращается отрицательно заряженный электрон.
фильм № 2
фильм № 1
фильм № 3
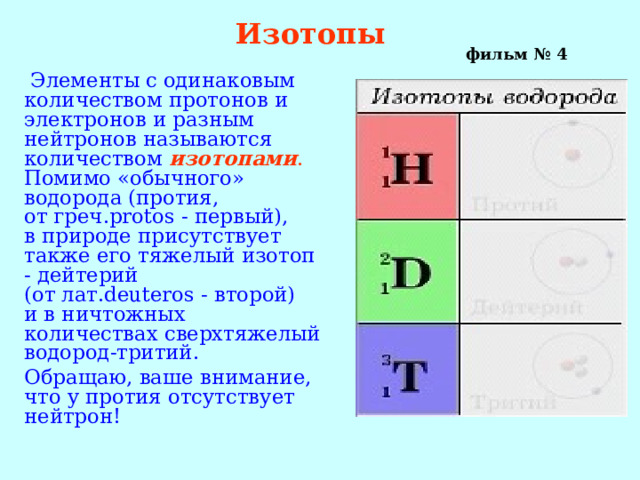
Изотопы
фильм № 4
Элементы с одинаковым количеством протонов и электронов и разным нейтронов называются количеством изотопами . Помимо «обычного» водорода (протия, от греч.protos - первый), в природе присутствует также его тяжелый изотоп - дейтерий (от лат.deuteros - второй) и в ничтожных количествах сверхтяжелый водород-тритий.
Обращаю, ваше внимание, что у протия отсутствует нейтрон!

Физические свойства
При обычных условиях H 2 -это газ без цвета, запаха и вкуса. Практически не растворим в воде. Горюч и взрывоопасен. Водород - самый лёгкий газ, он в 14,5 раза легче воздуха Если надуть им резиновый шарик, он взлетит ввысь. Это свойство водорода использовали раньше для наполнения воздушных шаров и дирижаблей.
фильм № 5 без звука
H 2 принадлежит много других «рекордов». H 2 - самая легкая жидкость, а твердый H 2 - самое легкое твердое вещество.
фильм № 6
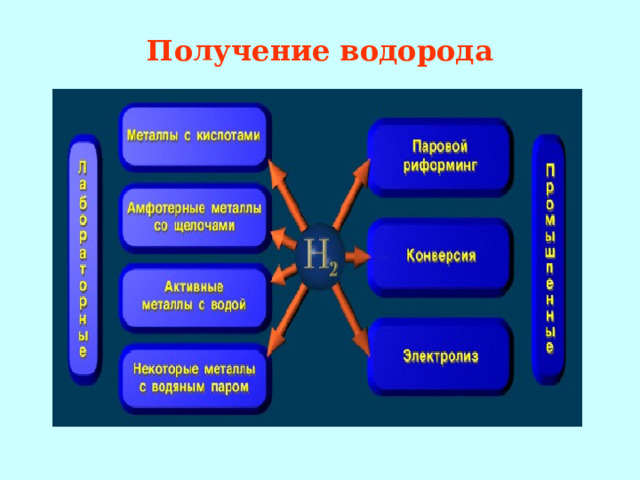
Получение водорода

Получение водорода
Лабораторные способы :
1 . Действие разбавленных кислот на металлы . Для проведения такой реакции чаще всего используют цинк и соляную кислоту:
Zn + 2HCl →ZnCl 2 + H 2 ↑
Реакция замещения
2. Взаимодействие кальция с водой:
Ca + 2H 2 O → Ca(OH) 2 + H 2 ↑
Реакция замещения
фильм № 7
фильм № 8
Водород практически не растворяется в воде,
поэтому его можно собирать методом вытеснения
воды.

Получение и обнаружение водорода
Распространен лабораторный метод получения H 2 в аппарате Киппа. Техника безопасности:
Перед работой с водородом всегда проверять его на чистоту!
фильм № 9
фильм № 10
H 2 + O 2 = оксид водорода
фильм № 11

Химические свойства водорода
1. Взаимодействие со щелочными и щёлочноземельными металлами: H 2 образует с активными металлами – гидриды:
2 Na + H 2 = 2 NaH (гидрид натрия)
2. С галогенами образует галогеноводороды:
H 2 + Cl 2 =2 HCl (хлороводород)
3 . С сажей взаимодействует при сильном нагревании:
C +2 H 2 = CH 4 (метан)
4 . H2 способен отнимать кислород из его оксидов . Оксиды восстанавливаются до металлов :
CuO +H 2 = Cu + H 2 O
Fe 2 O 3 + 3H 2 = 2 Fe + 3H 2 O
WO 3 + 3H 2 = W + 3H 2 O
фильм № 12

Применение водорода
Ежедневный прием с пищей: главным образом в виде воды. Использование водорода в качестве топлива (экономическая эффективность). Водород применяют в химической промышленности для производства хлороводорода, аммиака, мыла и пластмасс. В пищевой промышленности с помощью водорода из жидких растительных масел делают маргарин. Водород используют также в качестве ракетного топлива. Водородно-кислородное пламя применяется для резки и сварки металлов.
фильм № 13
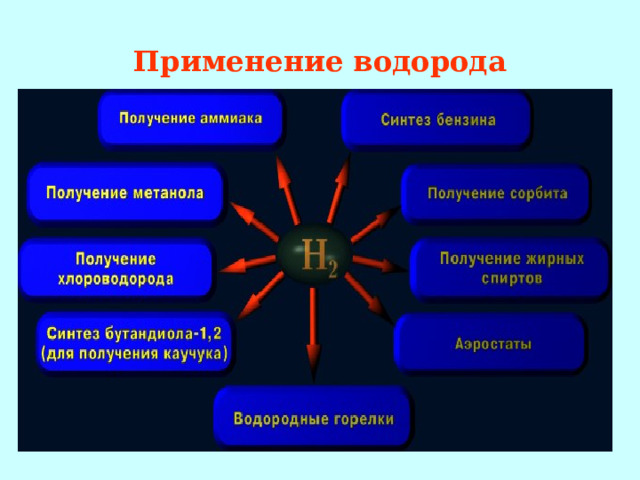
Применение водорода
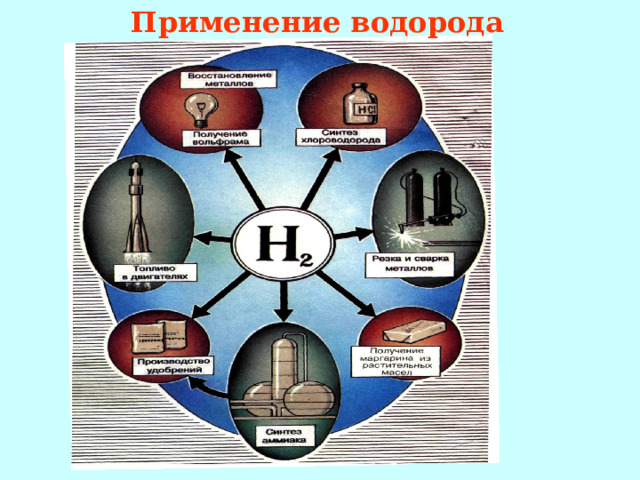
Применение водорода

Из истории…
Вот какая история произошла с французским химиком, директором Парижского музея науки Пилатром де Розье (1756-1785). Как-то он решил проверить, что будет, если вдохнуть водород; до него никто такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться, проник ли водород в легкие. Он еще раз хорошо вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в легких смелого экспериментатора был смешан с воздухом и произошел сильный взрыв. «Я думал, что у меня вылетели все зубы вместе с корнями»,- писал он впоследствии, очень довольный опытом, который чуть не стоил ему жизни.

Самостоятельная работа
Допишите химические уравнения следующих реакций:
1 - вариант: магний + водород = ?….
2 - вариант: углерод + ?… = CH 4
3- вариант: ?… + ?… = H 2 S

Проверка самостоятельной работы
Допишите химические уравнения следующих реакций:
1 - вариант: магний + водород =? ….
Mg + H 2 =MgH 2
2 - вариант: углерод + ?… = CH 4
C + H 2 =CH 4
3- вариант: ? … + ?… = H 2 S
H 2 + S=H 2 S

Закрепление
1. Опишите важнейшие свойства водорода как простого вещества.
2. Как «перелить» водород из одного сосуда в другой?
3. Можно ли собирать водород (как кислород) над водой? Ответ обоснуйте.
4. Как испытать водород на чистоту?
5.Три сосуда заполнены: а) водородом, б) кислородом,
в) углекислым газом. Как определить, какой газ содержится в каждом сосуде?

Вывод
- Водород- первый химический элемент в таблице
Д.И. Менделеева.
2. Имеет простейшее строение.
3. Самый легкий элемент.
4. В соединениях водород одновалентен.
5. Основной способ получения водорода:взаимодействия металлов с кислотами.
6. Перед работой с водородом всегда проверять его на чистоту .
7. Водород можно собрать путем вытеснения воды и воздуха .

Домашнее задание
Напишите реакции получения водорода взаимодействием:
1- вариант: раствора серной кислоты ( H 2 SO 4 ) с алюминием, магнием, железом ( II ).
2- вариант: раствора соляной кислоты ( HCl ) с алюминием, магнием, железом ( II ).

В работе использованы модели из эл. учебника «Химия для всех - 2000»,
«1С: Химия. Репетитор», «1 С Химия для всех- XXI ».
Зеркало Единой коллекции http://www.edu.yar.ru/

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация : "Водород" (3.1 MB)
Презентация : "Водород" (3.1 MB)
 0
0 3944
3944 191
191 Нравится
0
Нравится
0


