
Автор: преподаватель химии Ракчеева Н.А.
Йорданс Якоб «Пир Клеопатры» 1653
“ Она … опустила жемчужину в уксус… Когда от нее не осталось и следа, Клеопатра подняла кубок, и выпила весь до последней капли”
Картина написана на сюжет из «Естественной истории» Плиния Старшего (I в.). Египетская царица Клеопатра (I в. до н. э.), славившаяся красотой и умом, отличалась также экстравагантностью своего поведения. Однажды на глазах своего возлюбленного, римского полководца Марка Антония, Клеопатра растворила в бокале с уксусом крупную жемчужину, а затем выпила его содержимое. На картине изображен момент, когда царица опускает в бокал серьгу, а Марк Антоний, его спутник Энобард и негр-слуга застыли в немом изумлении, всем своим видом выражая сожаление о погибшей ценности и одновременно — восхищение поступком Клеопатры. А вот ухмылка и презрительный жест придворного шута яснее всяких слов говорят о нелепости и глупости подобного расточительства. Картина заставляет вспомнить нравоучительные аллегории Х. Босха и П. Брейгеля Старшего.
Учитель зачитывает отрывок из произведения Г.Р.Хаггарда “Клеопатра”:
“… Она вынула из уха одну их тех жемчужин … и … опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев наблюдали, как несравненная жемчужина медленно растворяется в крепком уксусе. Вот от ней осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли…”
Римский историк Плиний-старший в своем труде «Естественная история» рассказывает об эпизоде, когда Клеопатра побилась об заклад с Марком Антонием, что сумеет приготовить самое драгоценное яство из когда-либо подававшихся. Клеопатра сняла одну из своих жемчужных серег (как утверждал Плиний, ценой в баснословные 10 миллионов сестерциев) и опустила ее в чашу кислого вина (уксуса). Жемчуг якобы растворился в уксусе, и Клеопатра выпила чашу до дна, тем самым победив в этой затее.

«Мозговой штурм»
1.Какой класс органических соединений мы с вами изучаем?
2.Как вы думаете, что объединяет все эти фрукты ?

3. Какую кислоту используют для консервирования и маринования?
4. Какую кислоту используют для приготовления компотов и напитков?
5. Какую кислоту содержат молочнокислые продукты?
6. Об образовании какой кислоты свидетельствуют прогорклый вкус и специфический запах масла?

7.Какая кислота ежедневно образуется в организме человека в количестве 400 г?
8. Какое еще название имеет метановая кислота?

9. Почему болят икры ног после продолжительного бега?
10. Какая кислота содержится в янтаре?
11. Какие кислоты содержатся в табачном дыме?
12. Какие вещества называют предельными одноосновными карбоновыми кислотами ?
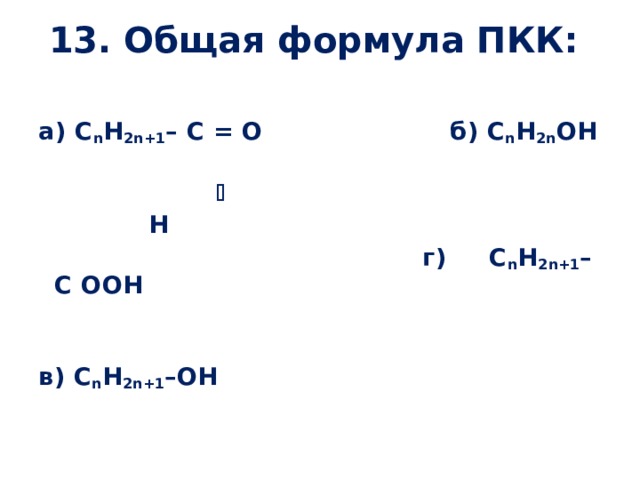
13. Общая формула ПКК:
а ) C n H 2n+1 – C = O б ) C n H 2n OH
H
г) C n H 2n+1 – C OOH
в) C n H 2n+1 –OH

13. Среди формул предложенных веществ, укажите формулы ПКК:
- а ) CH 3 – CH 3 ; б ) CH 3 – CH 2 – OH ;
- в ) CH 3 – COOH ; г ) CH 3 – O – CH 3 ,
- д) CH 3 – CH 2 – COOH

Мини-проекты по теме “Карбоновые кислоты. Их значение в нашей жизни»

- Жидкость с резким
запахом. Содержится в
хвое, крапиве, едких выделениях
муравьев и пчел.
Применяется для получения
лекарственных средств,
пестицидов и растворителей.


- Муравьиная кислота в 10 раз сильнее, чем уксусная кислота за счет самого маленького углеводородного радикала.

Муравьинофенилэтиловый эфир
Муравьиноэтиловый эфир

Опасность муравьиной кислоты зависит от концентрации

Применение кислоты в различных отраслях народного хозяйства .

- Народная медицина традиционно использовала муравьиную кислоту для лечения ревматических болей и радикулитов

Обладает бактерицидными свойствами, поэтому ее применяют, как консервант

- Эту кислоту называли «кислой влажностью», «древесной кислотой», так как долгое время ее получали из древесины.
В 1789 г. русский химик Т.Е.Ловиц впервые получил кристаллическую, так называемую ледяную уксусную кислоту.

- Широко распространена в природе.
- Она содержится в выделениях животных ,в растениях (в зеленых листьях).
- Она присутствует в кислом молоке и сыре.

- В пищевой промышленности ее применяют в качестве консервирующего средства и как вкусовую добавку.

Растворитель лекарств и душистых веществ, реагент в химическом синтезе при производстве ацетатного шелка, красителей, сложных эфиров, ацетона, хлоруксусной кислоты, уксусного ангидрида.

тема занятия:
«Химические свойства карбоновых кислот»

Цель занятия:
1. Выяснить особенности строения карбоксильной группы и спрогнозировать химическое поведение карбоновых кислот .
2. С помощью лабораторного исследования изучить химические свойства карбоновых кислот (общие и специфические)
3. Отработать умения составлять
уравнения химических реакций
=
= O
–
=
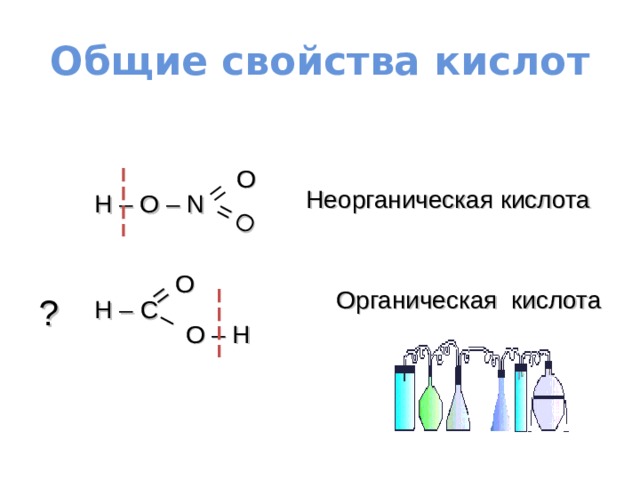
Общие свойства кислот
O
Неорганическая кислота
H – O – N
O
Органическая кислота
?
H – C
O – H
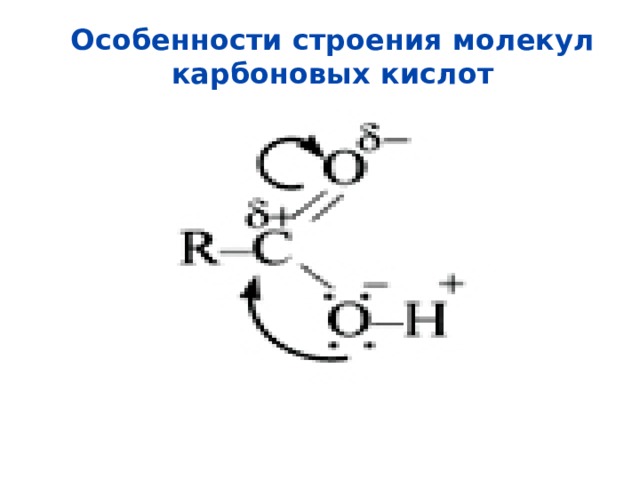
Особенности строения молекул карбоновых кислот

Свойства, характерные для неорганических кислот
- - действие на индикаторы,
- + Ме,
- + щелочь,
- + нерастворимое основание,
- + амфотерный гидроксид,
- + основный оксид,
- + амфотерный оксид,
- + соль.
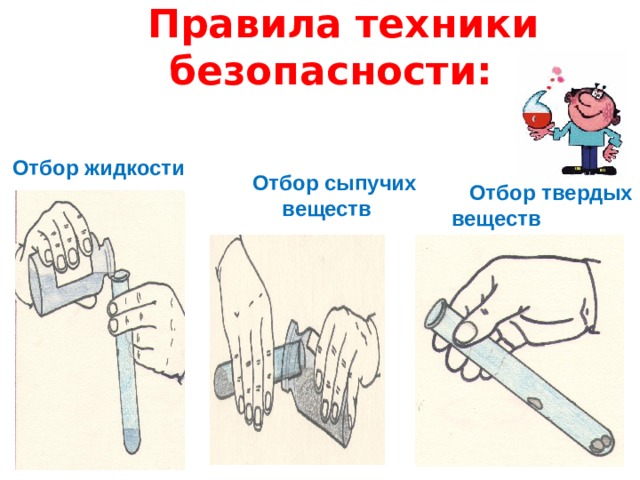
Правила техники безопасности:
Отбор жидкости
Отбор сыпучих
веществ
Отбор твердых веществ
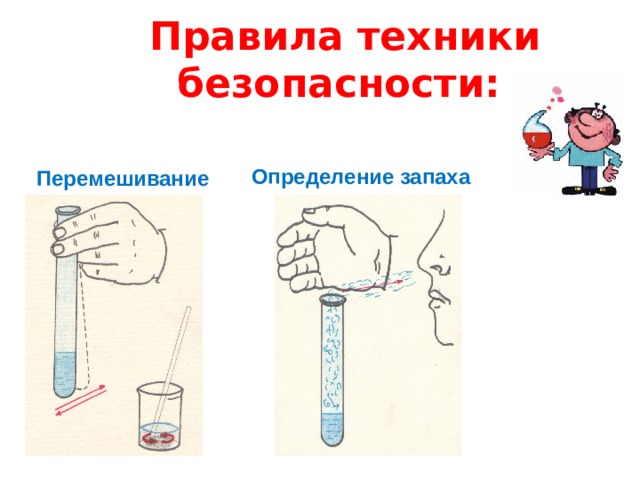
Правила техники безопасности:
Перемешивание
Определение запаха

Лабораторная работа Свойства уксусной кислоты в сравнении со свойствами соляной кислоты
Группа 1. Взаимодействие с металлами и действие на индикатор
Группа 2. Взаимодействие с оксидами металлов и основаниями.
Группа 3 . Взаимодействие с солями слабых кислот, действие на индикатор
Группа 4 Взаимодействие с нерастворимыми основаниями
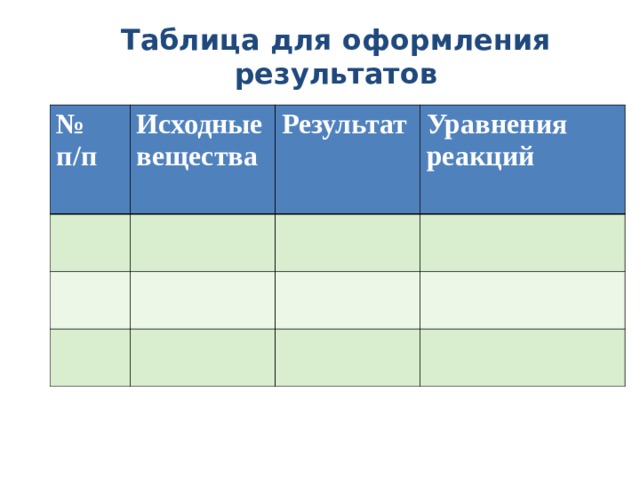
Таблица для оформления результатов
№ п/п
Исходные вещества
Результат
Уравнения реакций
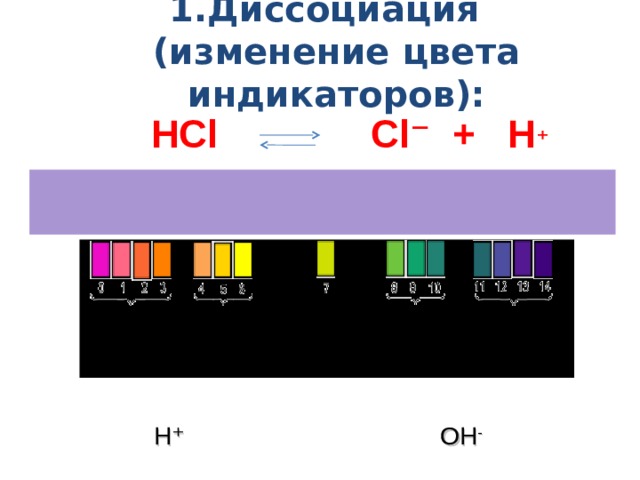
1.Диссоциация (изменение цвета индикаторов):
НС l С l ⁻ + Н ⁺
СН 3 СОО - + Н ⁺
СН 3 СООН
⁺
Нейтральная
Кислая среда
Щелочная среда
Н⁺
ОН -

2. Взаимодействие с Ме, стоящими до Н
+
2
Ацетат Mg
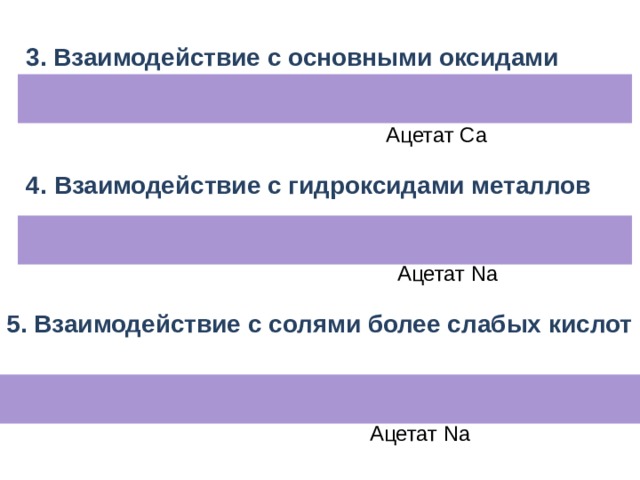
3. Взаимодействие с основными оксидами
+
Ацетат Ca
4. Взаимодействие с гидроксидами металлов
+
Ацетат Na
5. Взаимодействие с солями более слабых кислот
+
Ацетат Na

6.Взаимодействие с нерастворимыми основаниями
N аОН+ CuSO 4 = С u( ОН ) 2 + N а 2 S О 4
2СН 3 СООН + Сu(ОН) 2 =(СН 3 СОО) 2 Сu+2Н 2 О

7 . Горение уксусной кислоты
СН 3 СООН + 2О 2 → 2СО 2 + 2Н 2 О
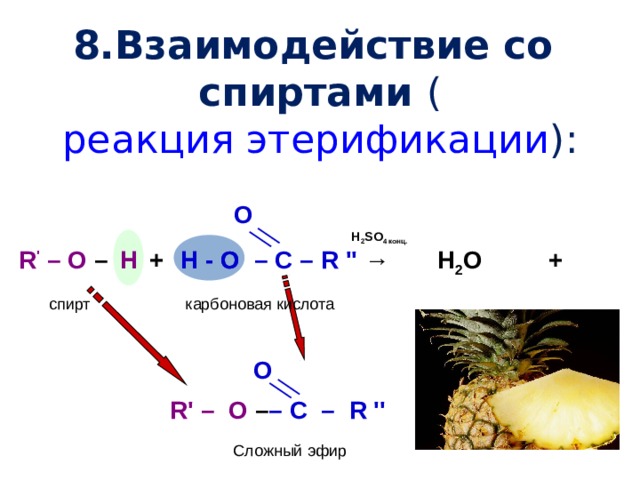
8.Взаимодействие со спиртами ( реакция этерификации ):
O
R ' – O – + – C – R '' →
Н 2 SO 4 конц.
Н - О
Н
H
+
Н 2 О
H - O
карбоновая кислота
спирт
О
R' – O – – C – R ''
Сложный эфир
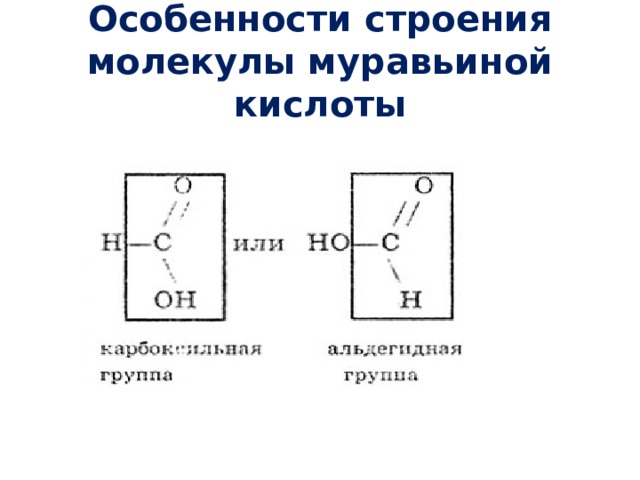
Особенности строения молекулы муравьиной кислоты
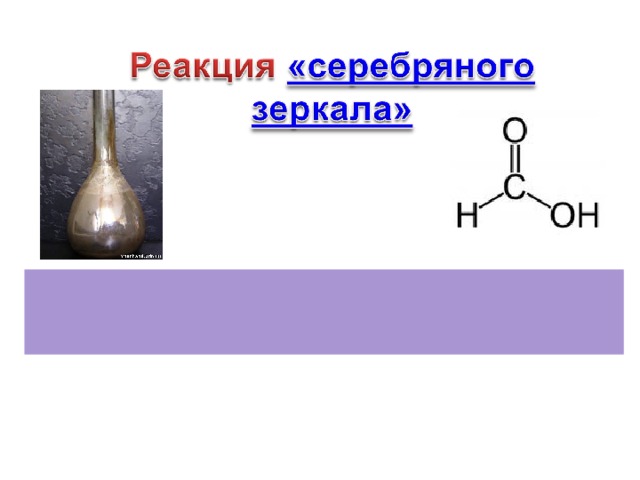
НСООН +Аg 2 О→ 2Аg + СО 2 +Н 2 О

Общий вывод:
- 1. ПКК обладают общими свойствами с неорганическими кислотами. Эти свойства обусловлены ионом водорода карбоксильной группы (- COOH );
- 2. Специфические свойства проявляются за отсутствии радикала в молекуле муравьиной кислоты.

Закрепление изученного материала
- 1. Какую реакцию осуществила Клеопатра. Какое соединение она принимала? Написать уравнение соответствующей реакции.
- =
2СН 3 СООН + СаСО 3 = (СН 3 СОО) 2 С a + H 2 CO 2

Закрепление изученного материала
- 2. Контролирующий тест
3.Тест «пятерочка»
а
1
б
2
в
3
г
4
д
5
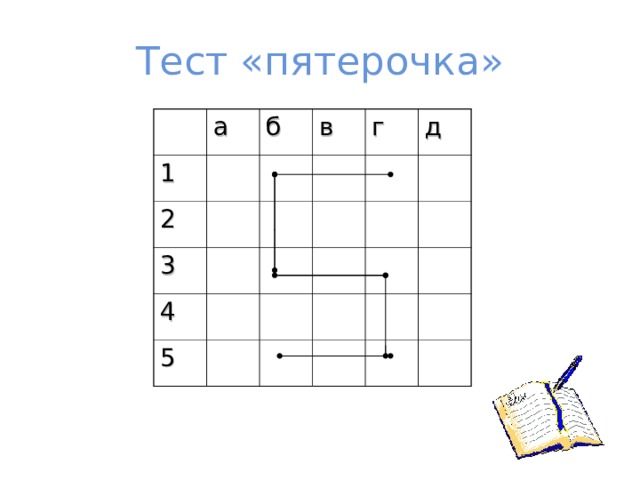
Тест «пятерочка»
а
1
2
б
3
в
г
4
5
д

Цель занятия:
1. Выяснить особенности строения карбоксильной группы и спрогнозировать химическое поведение карбоновых кислот .
2. С помощью лабораторного исследования изучить химические свойства карбоновых кислот (общие и специфические)
3. Отработать умения составлять
уравнения химических реакций

РЕФЛЕКСИЯ
Продолжите фразу:
- Сегодня на уроке я узнал …
- Теперь я могу …
- Было интересно …

Домашнее задание:
§ 20; конспект
- Выполнить творческое задание в программе « MS Power Point » по теме: «Карбоновые кислоты в жизни человека» или составить кроссворд по этой теме

Всем спасибо! До новых встреч!
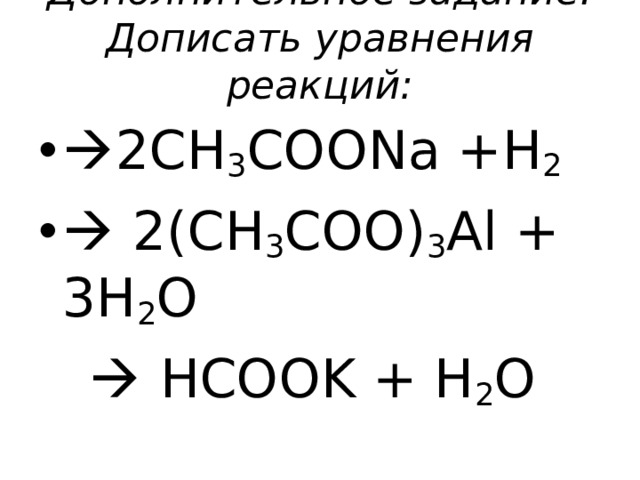
Дополнительное задание. Дописать уравнения реакций:
- 2CH 3 COONa +H 2
- 2(CH 3 COO) 3 Al + 3H 2 O
HCOOK + H 2 O

Из букв данного слова составьте химические слова
Декарбоксилирование

Литература и ЦОР
- Габриелян, О.С. Химия. 10 класс. Профильный уровень: метод. пособие. - М.: Дрофа, 2006.
- Габриелян, О.С., Маскаев, Ф.Н., Пономарев, С.Ю., Теренин, В.И. Химия. 10 класс: учеб. для общеобразоват. учреждений. – М.: Дрофа, 2002.
- Габриелян, О.С., Остроумов И.Г. Настольная книга учителя. Химия. 10 класс. – М.: Дрофа, 2004.
- Компакт-диск «Химия в школе. Электронные уроки и тесты. Кислородсодержащие соединения». ЗАО «Просвещение-Медиа»,2005г .

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к занятию по теме "Карбоновые кислоты" (14.73 MB)
Презентация к занятию по теме "Карбоновые кислоты" (14.73 MB)
 0
0 477
477 43
43 Нравится
0
Нравится
0


