
Министерство образования Московской области ГБПОУ МО « Красногорский колледж»
ВИДЕОКУРС
по общепрофессиональной учебной дисциплине
«Теория горения и взрыва»
автор-составитель: преподаватель высшей квалификационной категории
Лебединская Е.М.

Глава 1. Основы процессов горения. Материальный и тепловой балансы процессов горения. Урок.2 Материальный баланс процессов горения
Цели и задачи :
- Введение в содержание дисциплины Изучение механизма химических и физических явлений, протекающих при горении; Формирование навыков, позволяющих составлять уравнение материального баланса процессов горения различных веществ
- Введение в содержание дисциплины
- Изучение механизма химических и физических явлений, протекающих при горении;
- Формирование навыков, позволяющих составлять уравнение материального баланса процессов горения различных веществ

Учебные вопросы
- Понятие « Баланс»
- Определение коэффициента горючести
- Составление уравнений горения в кислороде и в воздухе
- Характеристики процессов горения

№ п / п
Вопросы
1
Начало занятия
Что значит в теории горения составить « материальный баланс»?
2
На какие группы классифицируются все индивидуальные вещества по горючести?
3
Каков физический смысл коэффициента горючести?
4
5
При каком значении К вещество будет негорючим?
Если горючее вещество содержит углерод, водород и серу. Каковы будут продукты сгорания в кислороде?
6
7
Если горючее вещество содержит углерод, водород и серу. Каковы будут продукты сгорания в воздухе?
8
Чему равен стехиометрический коэффициент β в уравнении горения аммиака
В каком объемном соотношении находятся кислород и азот в составе воздуха?

Понятие « Баланс»
- От французского « balance »- весы
- Количественное выражение сторон какого-либо процесса, которые должны уравновешивать друг друга
- Баланс- уравновешивание
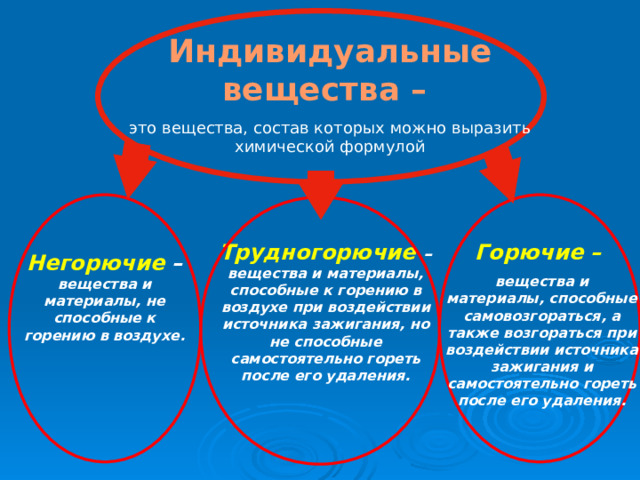
Индивидуальные вещества –
это вещества, состав которых можно выразить химической формулой
Горючие –
вещества и материалы, способные самовозгораться, а также возгораться при воздействии источника зажигания и самостоятельно гореть после его удаления.
Трудногорючие – вещества и материалы, способные к горению в воздухе при воздействии источника зажигания, но не способные самостоятельно гореть после его удаления.
Негорючие – вещества и материалы, не способные к горению в воздухе.
 2 – вещество является горючим. " width="640"
2 – вещество является горючим. " width="640"
Коэффициент горючести -это показатель горючести вещества
- К = 4n C + 4n S + n H + n N - 2n O - 2n Cl - 3n F - 5n Br
где: n C , n S , n H , n N , n O , n Cl , n F , n Br -соответственно число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора, брома в молекуле вещества.
- Если расчётное значение К 0 – вещество негорючее,
- 0 К 2 – вещество трудногорючее,
- К 2 – вещество является горючим.
 2, то динитрокрезол – горючее вещество. " width="640"
2, то динитрокрезол – горючее вещество. " width="640"
Пример 1. Определить горючесть динитрокрезола
Дано : С 7 Н 6 О 5 N 2 – динитрокрезол
Найти: К ?
Решение:
1.Записываем количество атомов составляющих динитрокрезол:С 7 Н 6 О 5 N 2 n C = 7; n H = 6; n O = 5; n N = 2
2.Рассчитываем коэффициент горючести.
К = 4n C + 4n S + n H + n N - 2n O -2n Cl -3n F - 5n Br = 4 7 + 6 + 2 2 5 = 26
- Вывод: т.к. К 2, то динитрокрезол – горючее вещество.
 0 , то тетрафтордибромэтан – негорючее вещество. " width="640"
0 , то тетрафтордибромэтан – негорючее вещество. " width="640"
Пример 2. Определить горючесть тетрафтордибромэтана
Дано : С 2 F 4 Br 2 – тетрафтордибромэтан
Найти: К ?
Решение:
1.Записываем количество атомов составляющих тетрафтордибромэтан С 2 F 4 Br 2 n C = 2; n F = 4 ; n Br = 2 ; 2.Рассчитываем коэффициент горючести.
К = 4n C + 4n S + n H + n N - 2n O -2n Cl -3n F - 5n Br = 4 2 3 4 5 2 = -14
- Вывод: т.к. К 0 , то тетрафтордибромэтан – негорючее вещество.

Состав продуктов горения
в зависимости от состава исходного вещества
Элементы, входящие в
состав горючего вещества
Продукты горения
Углерод С
Углекислый газ СО2
Водород Н
Вода Н2О
Сера S
Оксид серы ( IV) SO2
Азот N
Молекулярный азот N2
Фосфор Р
Оксид фосфора ( V) Р2О5
Галогены F, Cl, Br, I
Галогеноводороды HCl, HF, HBr, HI
Стехиометрические коэффициенты
- коэффициенты, стоящие в уравнении реакции,
показывающие сколько молей (кмолей) веществ
участвовало в реакции или образовалось в результате реакции.
Стехиометрический коэффициент, показывающий число молей кислорода, необходимое для полного сгорания вещества, обозначается буквой β

Пример 3.
Составить уравнение реакции горения в кислороде пропана С3Н8, глицерина С3Н8О3, аммиака NH3

Пример 3.
Составить уравнение реакции горения в кислороде пропана С3Н8, глицерина С3Н8О3, аммиака NH3

Пример 3.
Составить уравнение реакции горения в кислороде пропана С3Н8, глицерина С3Н8О3, аммиака NH3

Составление уравнений реакций горения в воздухе

Молекулярный состав воздуха
(О 2 + 3,76N 2 )
Составить уравнение реакции горения в воздухе пропанола С 3 Н 7 ОН
Аналогично предыдущим уравнениям с кислородом:
С 3 Н 7 ОН+ 4,5О 2 + 4,5*3,76N 2 =3СО 2 +4Н 2 О+ 4,5*3,76N 2
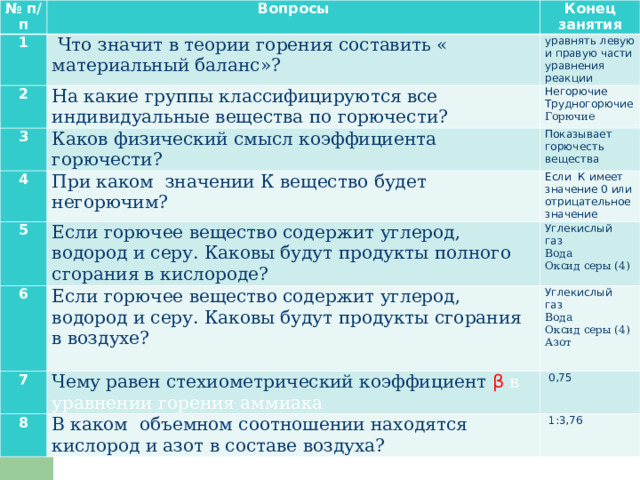
№ п / п
Вопросы
1
Конец занятия
Что значит в теории горения составить « материальный баланс»?
2
3
уравнять левую и правую части уравнения реакции
На какие группы классифицируются все индивидуальные вещества по горючести?
4
Негорючие
Трудногорючие
Каков физический смысл коэффициента горючести?
Показывает горючесть вещества
Горючие
При каком значении К вещество будет негорючим?
5
6
Если К имеет значение 0 или отрицательное значение
Если горючее вещество содержит углерод, водород и серу. Каковы будут продукты полного сгорания в кислороде?
7
Углекислый газ
Если горючее вещество содержит углерод, водород и серу. Каковы будут продукты сгорания в воздухе?
8
Углекислый газ
Чему равен стехиометрический коэффициент β в уравнении горения аммиака
Вода
Оксид серы (4)
0,75
В каком объемном соотношении находятся кислород и азот в составе воздуха?
Вода
Оксид серы (4)
Азот
1:3,76

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к уроку "Материальный баланс процессов горения" (1.35 MB)
Презентация к уроку "Материальный баланс процессов горения" (1.35 MB)
 0
0 188
188 0
0 Нравится
0
Нравится
0


