
06.03.20
Химические свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе.

О 2

ТЕСТ.
1. Самый распространенный х.э.:
а) водород в) кремний
б) кислород г) алюминий
2. Химический элемент кислород в
природе распространен по массе:
а) 59% в) 49%
б) 94% г) 19%

3. Впервые кислород получил:
а) А.Лавуазье в)М.Ломоносов
б) Д.Пристли г) Р.Бойль
4. Относительная атомная масса
кислорода:
а) 8 в) 16
б) 32 г) 15

5. Валентность кислорода в соединениях: а) II в) III б) I г) V 6. Формула простого вещества кислорода: а) О в) Н 2 б) О 2 г) О 3

7. Относительная молекулярная масса кислорода: а) 8 в) 32 б) 16 г) 23 8. Определяют кислород: а) по цвету б) по запаху в) по вкусу г) тлеющей лучинкой

9. В лаборатории кислород получают: а) р.соединения б) р.разложения в) р.замещения г) р.обмена 10. В промышленности кислород получают: а) разложением воды б) разложением КМ nO 4 в) из воздуха

Явления
Физические
Химические
Замерзание воды
Плавление стекла
Плавление парафина
Горение бумаги
Скисание молока
Ржавление железа
Химические свойства – способность
веществ превращаться в другие под
воздействием определенных условий:
при изменении температуры, давления
и т. д.

Химические свойства

Запомнить !
- Кислород – сильный окислитель.
- Взаимодействие веществ с кислородом называется окислением .
- Реакции окисления, идущие с выделением тепла и света, называются реакциями горения
- С кислородом реагируют все элементы, кроме Au , Pt , He (С l 2 , В r 2 , I 2 ) , Ne и Ar .
- В результате взаимодействия веществ с кислородом образуется оксиды .
- Оксиды – сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
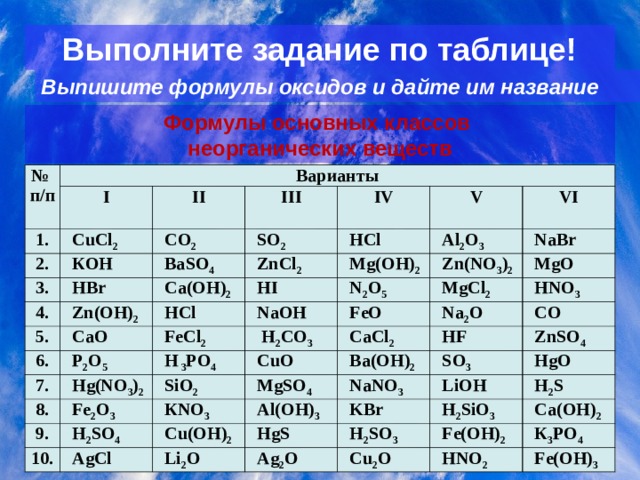
Выполните задание по таблице!
Выпишите формулы оксидов и дайте им название
Формулы основных классов
неорганических веществ
№
п/п
Варианты
1.
I
С uCl 2
II
2.
К O Н
III
3.
СО 2
НВ r
S О 2
4.
IV
Ва S О 4
ZnCl 2
5.
Н Cl
Zn ( O Н ) 2
V
Са( O Н ) 2
C аО
Н I
Al 2 O 3
Н Cl
6.
VI
М g ( O Н ) 2
FeCl 2
7.
Р 2 O 5
N а O Н
Zn ( NO 3 ) 2
NaBr
N 2 O 5
М gCl 2
Нg( NO 3 ) 2
Н 2 С O 3
FeO
М gO
Н 3 Р O 4
8.
9.
Fe 2 O 3
Si О 2
CaCl 2
Н NO 3
С u О
Na 2 О
Н F
Н 2 S О 4
М gSO 4
10.
К NO 3
Ва( O Н ) 2
СО
N а NO 3
ZnSO 4
Al(O Н ) 3
S О 3
С u ( O Н ) 2
AgCl
LiO Н
Нg S
Li 2 О
Нg O
K В r
Н 2 S
Ag 2 O
Н 2 Si О 3
Н 2 S О 3
Fe(O Н ) 2
Са( O Н ) 2
С u 2 О
К 3 Р O 4
Н NO 2
Fe(O Н ) 3
О 2
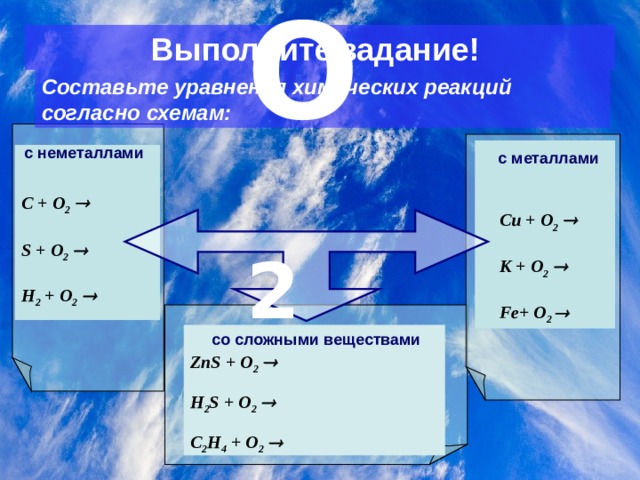
Выполните задание!
C оставьте уравнения химических реакций согласно схемам:
с неметаллами
Cu + O 2
К + O 2
Fe+ O 2
с металлами
C + O 2
S + O 2
H 2 + O 2
ZnS + O 2
H 2 S + O 2
C 2 H 4 + O 2
со сложными веществами
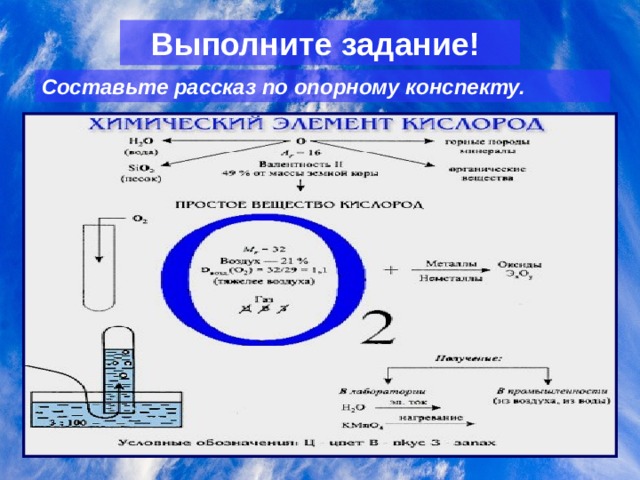
Выполните задание!
C оставьте рассказ по опорному конспекту.
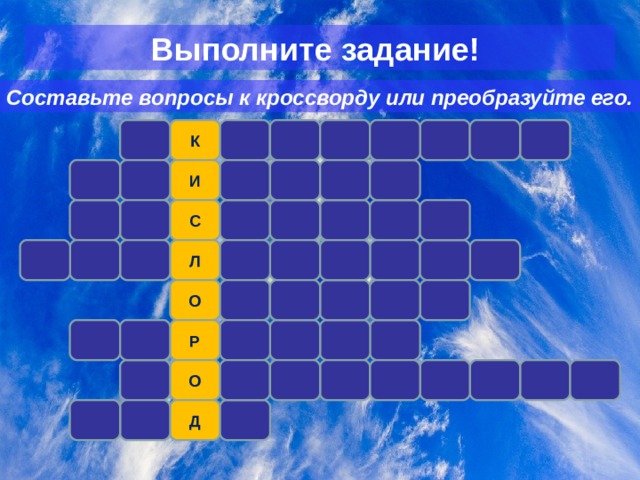
Выполните задание!
C оставьте вопросы к кроссворду или преобразуйте его.
К
И
С
Л
О
Р
О
Д

Нахождение кислорода в природе
Он всюду и везде:
В камне, в воздухе, в воде.
Он и в утренней росе,
И в небес голубизне.
Литосфера - 47% по m (в составе оксидов, солей)
Гидросфера - 85,8% (в основном в составе воды )
Атмосфера - 23% по m, 21% по V
Растения - 40%
Животные - 20%
Тело человека - 65%
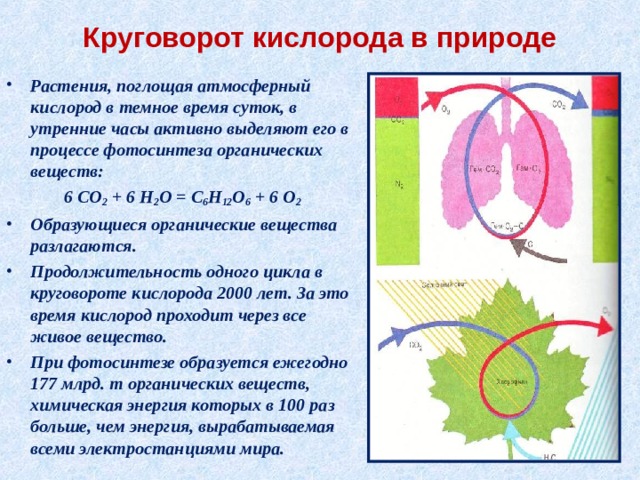
Круговорот кислорода в природе
- Растения, поглощая атмосферный кислород в темное время суток, в утренние часы активно выделяют его в процессе фотосинтеза органических веществ:
6 CO 2 + 6 H 2 O = C 6 H 12 O 6 + 6 O 2
- Образующиеся органические вещества разлагаются.
- Продолжительность одного цикла в круговороте кислорода 2000 лет. За это время кислород проходит через все живое вещество.
- При фотосинтезе образуется ежегодно 177 млрд. т органических веществ, химическая энергия которых в 100 раз больше, чем энергия, вырабатываемая всеми электростанциями мира.
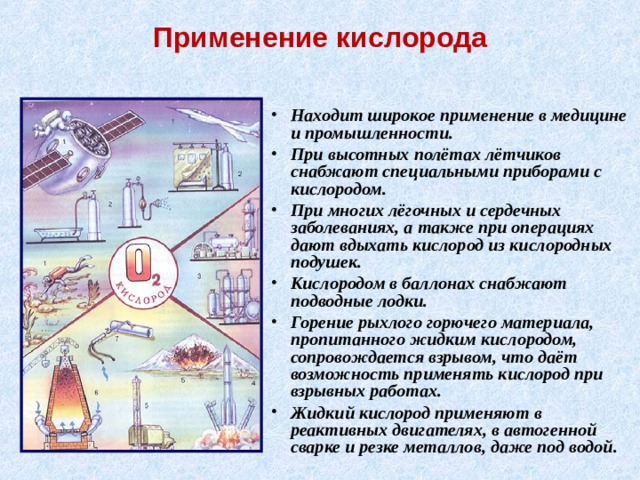
Применение кислорода
- Находит широкое применение в медицине и промышленности.
- При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
- Кислородом в баллонах снабжают подводные лодки.
- Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
- Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.

ДОМАШНЕЕ ЗАДАНИЕ
§ 22, 23
упр. 4—12,
задачи 2, 3 (с. 60)

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к уроку: "Химические свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе. (1.45 MB)
Презентация к уроку: "Химические свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе. (1.45 MB)
 0
0 1011
1011 182
182 Нравится
0
Нравится
0


