

Повтороение:
- Дать определение электрического тока.
- По способности проводить электрический ток твердые тела делятся?
- Что называется проводниками?
- Что называется диэлектриками?
- Что называется полупроводниками?

Сравним свойства проводников и полупроводников.
- Чем обусловлена электрическая проводимость металлов?
- Чем создается электрический ток в чистом полупроводнике?
- Влияние примесей на сопротивление проводников?
- Влияние примесей на сопротивление полупроводников.

- Зависит ли сопротивление проводников от температуры?.
- Зависит ли сопротивление полупроводников от температуры?.


Цель урока:
- Сравнить электропроводность жидкостей.
- Разъяснить физическую природу электропроводности жидких проводников.
- Ввести определение понятий:
- электролиты;
- электрическая диссоциация;
- степень диссоциации.
2. Рассмотреть явление электролиза.
3. Закон Фарадея.
4. Применение электролиза в технике .
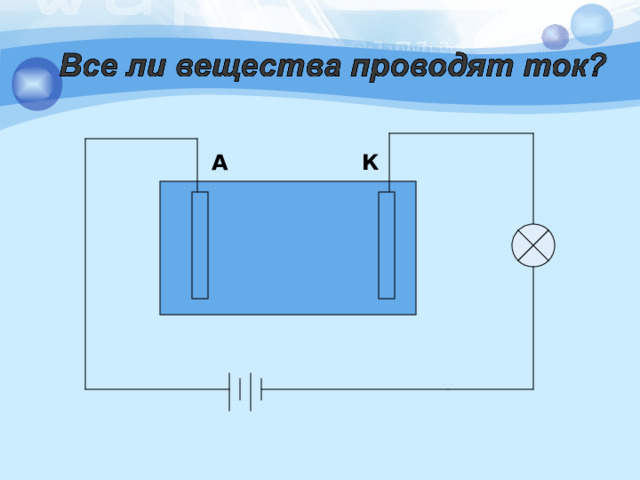
К
А


Почему чистая вода,раствор сахара не проводят, а раствор соли проводит электрический ток? Чем обусловлен электрический ток в растворе соли ?
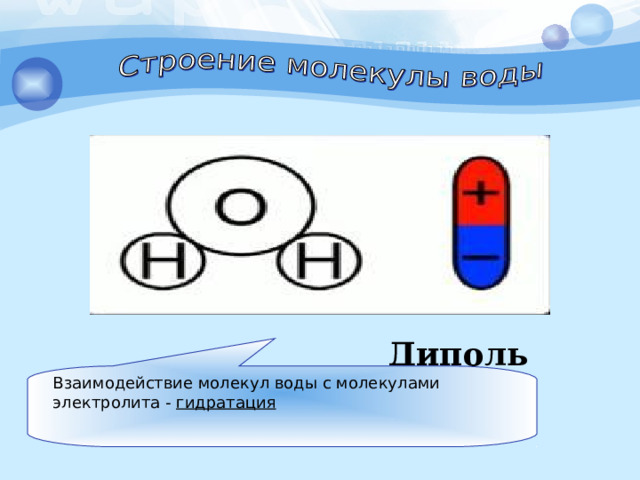
Диполь воды
Взаимодействие молекул воды с молекулами электролита - гидратация
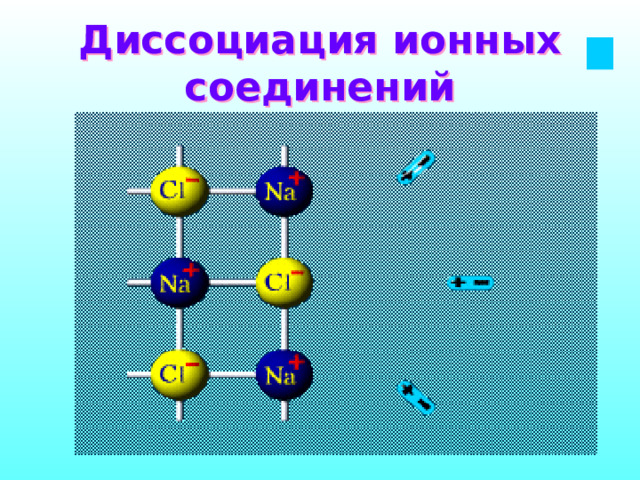
Диссоциация ионных соединений
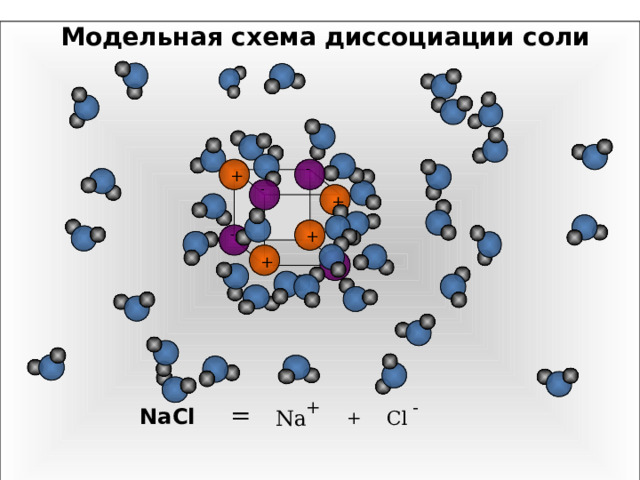
Модельная схема диссоциации соли
-
+
-
+
-
+
+
-
-
+
+
=
NaCl
Cl
Na
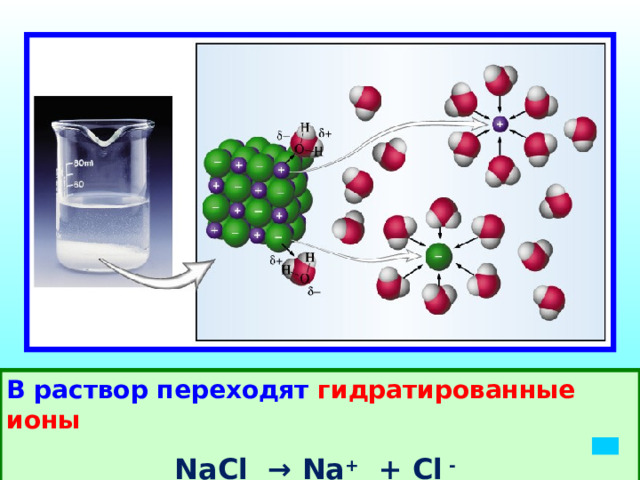
В раствор переходят гидратированные ионы
NaCl → Na + + Cl -

Электрическая диссоциация – расщепление молекул электролита на положительные и отрицательные ионы под действием растворителя
В процессе диссоциации:
NaCL . ↔ Na + + Cl - ,
Если в дистиллированную Н 2 О. налить НCl
НCl↔ Н + + Cl - ,
Если в дистиллированную Н 2 О. налить Na ОН
Na ОН↔ Na + +ОН -

Электрическая диссоциация – расщепление молекул электролита на положительные и отрицательные ионы под действием растворителя.
Степень диссоциации – отношение числа молекул, диссоциировавших на ионы, к общему количеству молекул данного вещества.
Рекомбинация – процесс объединения ионов разных знаков в нейтральные молекулы.
Вследствие теплового движения молекул растворимость зависит от температуры. «+» и «-» ионы могут возникать и при плавлении тв.электролитов в результате распада полярных молекул из-за увеличения амплитуды тепловых колебаний.
Наряду с процессом диссоциации (распада) молекул в электролитах возможен обратный процесс.
При сближении ионов разных знаков возможно их объединение в одну молекулу – рекомбинация.
Когда число молекул распадающихся на ионы становится равным числу молеку, возникающих за то же время вследствие рекомбинации, наступает динамическое равновесие.

Причины распада вещества на ионы в расплавах
Нагревание усиливает колебания ионов в узлах кристаллической решётки - кристаллическая решётка разрушается .

Вывод: подвижными носителями зарядов в растворах, расплавах солей, кислот и щелочей являются ионы.
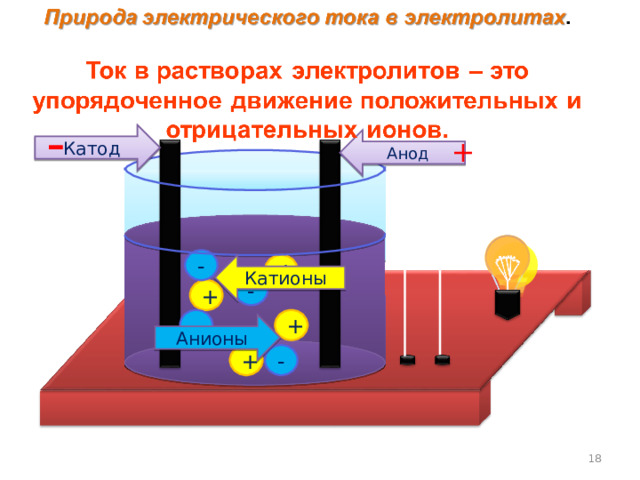
Катод
-
Анод
+
-
+
Катионы
-
+
-
+
Анионы
+
-
18
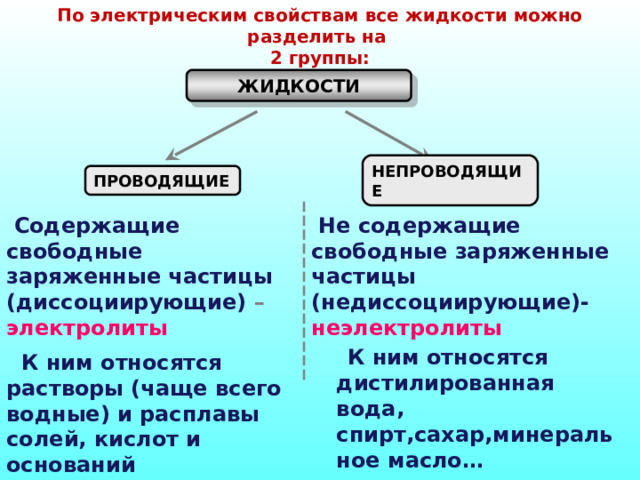
По электрическим свойствам все жидкости можно разделить на
2 группы:
ЖИДКОСТИ
НЕПРОВОДЯЩИЕ
ПРОВОДЯЩИЕ
Содержащие свободные заряженные частицы (диссоциирующие) – электролиты
Не содержащие свободные заряженные частицы (недиссоциирующие)- неэлектролиты
К ним относятся дистилированная вода, спирт,сахар,минеральное масло…
К ним относятся растворы (чаще всего водные) и расплавы солей, кислот и оснований

Опыт №1
- Выяснить, влияет ли концентрация раствора электролита на силу тока.

Вывод № 1.
- Сила тока зависит от концентрации раствора, чем насыщение раствор, тем больше сила тока.

Опыт №2
- Установить, как влияет площадь погружения электродов на силу тока.

Вывод № 2.
- Сила тока зависит от площади погружения электродов, чем больше площадь погружения тем больше сила тока и наоборот.

Опыт № 3.
- Установить, как влияет расстояния между электродами на силу тока.

Вывод № 3.
- Сила тока зависит от расстояния между электродами, чем меньше расстояние тем больше сила тока и наоборот.

Опыт № 4.
- Выяснить, как влияет температура электролита на силу тока в нём.

Вывод № 4.
- С повышением температуры электропроводность электролита увеличивается.

Опыт № 5.
- Выяснить, как влияет природа электролита на силу тока в нём.

Вывод № 5.
- Различные электролиты по-разному проводят электрический ток.
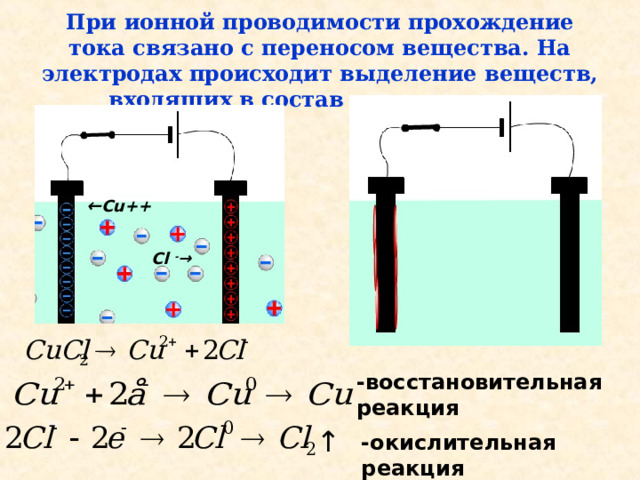
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов.
← Cu++
Cl - →
При создании в электролите внешнего эл.поля возникает направленное движение ионов. Хлорид меди в водном растворе диссоциирует на ионы меди и хлора.
К «-» электроду (катоду) притягиваются «+» ионы меди (катионы), а к «+» электроду (аноду) - «-» ионы хлора (анионы).
Достигнув катода, ионы меди нейтрализуются избыточными электронами, которые находятся на катоде – в результате образуются нейтральные атомы меди, которые оседают на катоде.
Ионы хлора отдают на аноде по одному избыточному электрону, превращаясь в нейтральные атомы хлора, соединяясь попарно атомы хлора образуют молекулу хлора, которые выделяются на аноде в виде пузырьков газа.
-восстановительная реакция
↑
-окислительная реакция

Процесс выделения на электродах вещества, связанный с окислительно-востановительной реакцией – называется электролизом.
Явление электролиза
было открыто в 1800г
анг. физиками
У.Никольсом и А.Карлейлем.

От чего зависит масса вещества, выделившегося на электродах за определённое время? З акон электролиза (Закон Фарадея).
Исследовал электролиз и открыл его законы в 1834 г. английский физик Майкл Фарадей
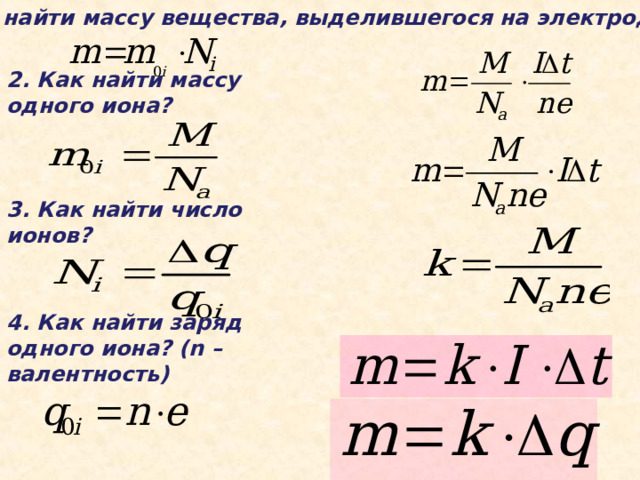
1 . Как найти массу вещества, выделившегося на электродах?
2. Как найти массу одного иона?
3. Как найти число ионов?
4. Как найти заряд одного иона? (n – валентность)

1 закон Фарадея
Масса вещества, выделившегося на электроде за время Δ t при прохождении электрического тока, прямопропорциональна силе тока и времени
K – электрохимический эквивалент вещества (зависит от молярной массы вещества «М» и валентности « n »)
Физ. смысл k – численно равен массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл.

- постоянная Фарадея
F = 9,65 *10 -4 Кл/моль
Физ.смысл F - численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде 1 моль одновалентного вещества.

2 закон Фарадея
электрохимические эквиваленты веществ прямо пропорциональны отношениям их малярных масс ( m ) в валентности ( n )
k=
Объединенный закон Фарадея
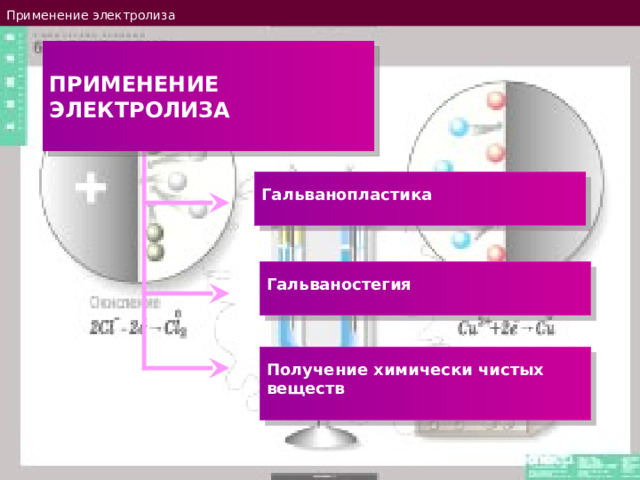
Применение электролиза
ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
Гальванопластика
Гальваностегия
Получение химически чистых веществ

Борис Семёнович Якоби
1801-1874
Русский физик и электротехник, академик Петербуржской Академии наук (1842). Многочисленные труды по практическому применению электричества.
В 1838 году создал гальванопластику – процесс изготовления рельефных металлических копий путем электролиза

Изготовление декоративных скульптур
методом гальванопластики

Применение электролиза
1. Гальванопластика
Гальванопластика – получение отслаиваемых копий предмета, полученных путем осаждения металла на поверхности предмета электролитическим способом
Точность копирования формы предмета очень высокая, т.к. процесс идет на ионном (молекулярном) уровне
Применение:
- Получение рельефных копий барельефов, статуй
- Изготовление клише, полиграфия
- выпуск ценных бумаг, денег
Копия барельефа, полученная методом гальванопластики

Венцы, чеканка, камни, золочение
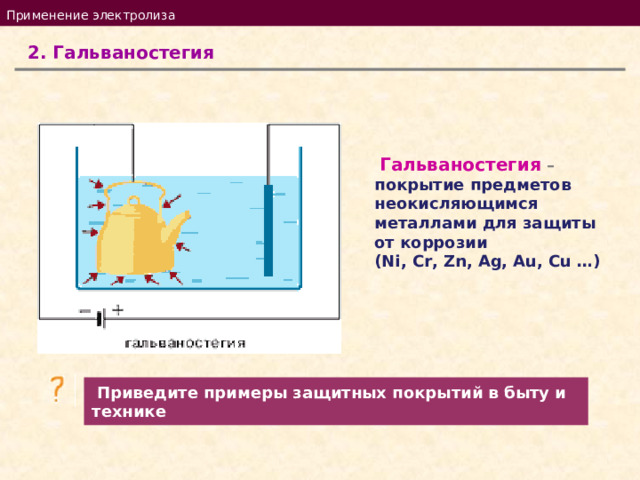
Применение электролиза
2. Гальваностегия
Гальваностегия – покрытие предметов неокисляющимся металлами для защиты от коррозии
( Ni, Cr, Zn, Ag, Au, Cu …)
Приведите примеры защитных покрытий в быту и технике

Алмазный инструмент,
изготовленный методом
гальваностегии
гальваническое наращивания тонкого слоя

Применение электролиза
3. Получение химически чистых веществ
Катод – тонкая пластина чистой меди , анод – толстая пластина неочищенной меди
Рафинирование меди
- катод
+ анод
CuSO4
При прохождении тока через электролит на катоде оседает чистая медь, анод расходуется и истощается
Примеси остаются в электролите или оседают на дно
При плотности тока 0,3 А на 1 дм 2 процесс идет несколько дней

Применение электролиза
3. Получение химически чистых веществ
Получение алюминия
Алюминий получают электролитическим способом из глинозема (вспомните – алюминий является одним из самых распространенных химических элементов земной коры и содержится в любой глине)
Электролитическим способом получают:
Магний, натрий, калий, кальций …
Соду, хлор, хлористый кальций …
Осуществив, например, электролиз раствора поваренной соли NaCl , мы можем получить сразу 3 полезных химических вещества:
Газообразные водород и хлор, а также раствор едкого натра NaOH
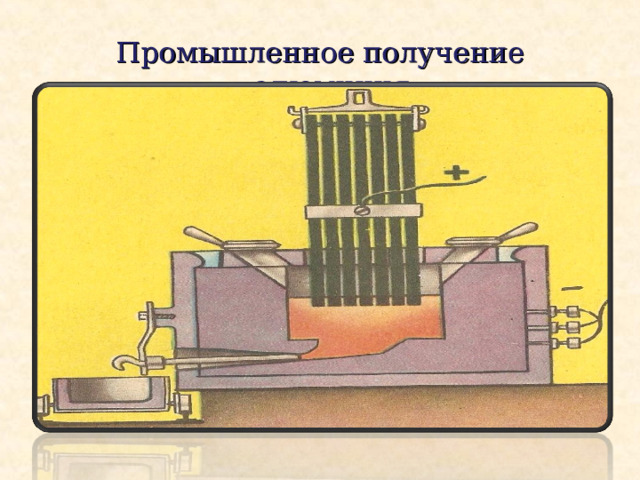
Промышленное получение алюминия


Электролиты – это …
Вещества растворы или расплавы которых проводят электрический ток
водные растворы солей, кислот, щелочей.

Неэлектролиты – это …
Вещества растворы и расплавы которых не проводят электрический ток
дистилированная вода, сахар, минеральное масло, спирт,нерастворимые оксиды …..
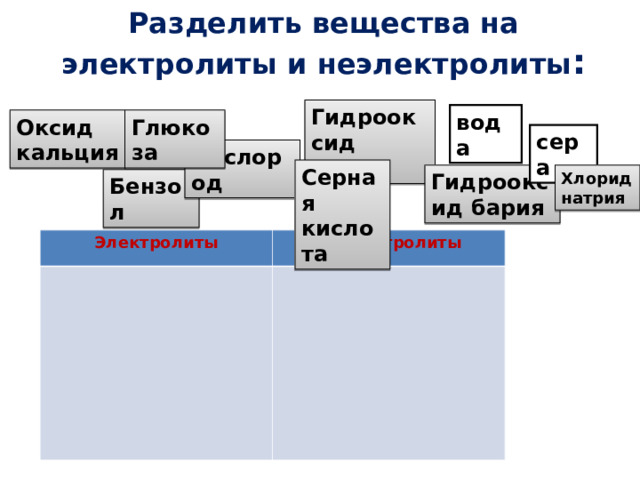
Разделить вещества на электролиты и неэлектролиты :
Гидрооксид калия
вода
Оксид кальция
Глюкоза
сера
Кислород
Серная кислота
Гидрооксид бария
Хлорид натрия
Бензол
Электролиты
Неэлектролиты

Носителями заряда в электролитах являются…
положительные и отрицательные ионы.
+
-
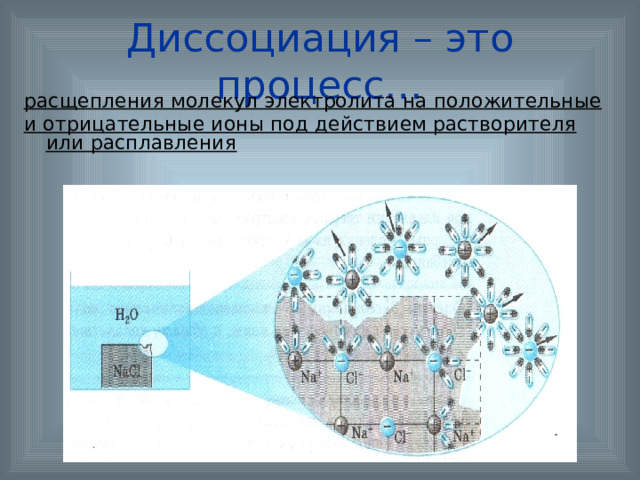
Диссоциация – это процесс…
расщепления молекул электролита на положительные
и отрицательные ионы под действием растворителя или расплавления
© Акимцева А.С. 2008

Рекомбинация – это процесс…
соединение ионов в нейтральную
молекулу.

Если в электролите нет электрического поля, то ионы движутся….
непрерывно и хаотично.
+
-
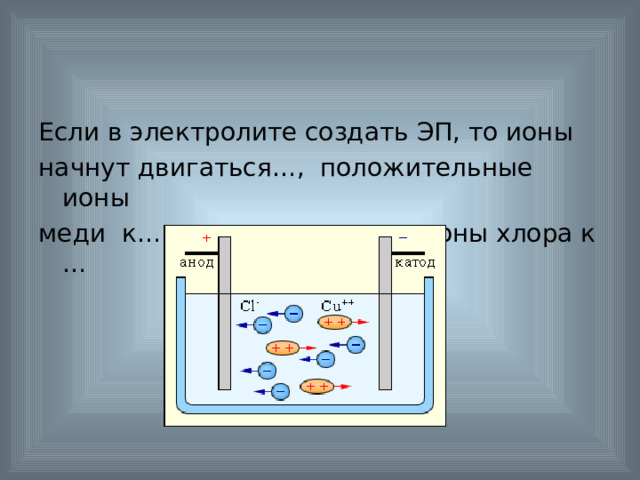
Если в электролите создать ЭП, то ионы
начнут двигаться…, положительные ионы
меди к…, а отрицательные ионы хлора к …

Значит, ток в электролитах – это…
упорядоченное движение
положительных и отрицательных ионов.
Катод
_
Анод
+
+
Направление тока в электролите
-

При прохождении электрического тока через электролит наблюдается…
выделение веществ, входящих в
электролит, на электродах!!!

Электролиз – это явление…
выделения на электродах веществ,
входящих в состав электролита, при
протекании через него электрического
тока.
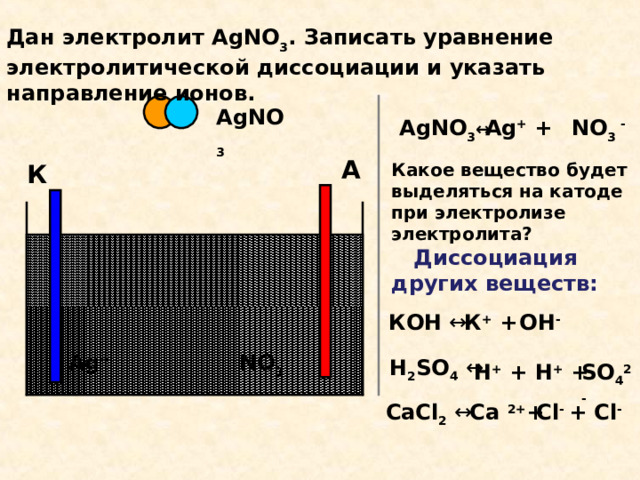
Дан электролит AgN О 3 . Записать уравнение электролитической диссоциации и указать направление ионов.
AgN О 3
N О 3 -
AgN О 3 ↔
Ag + +
А
К
Какое вещество будет выделяться на катоде при электролизе электролита?
Диссоциация других веществ:
КОН ↔
К + +
ОН -
Ag +
N О 3 -
H 2 SO 4 ↔
H + + H + +
SO 4 2-
СаС l 2 ↔
Ca 2+ +
Cl - + Cl -
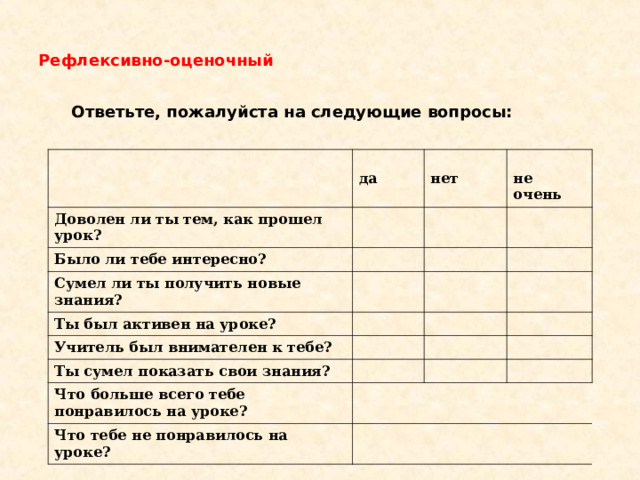
Рефлексивно-оценочный
Ответьте, пожалуйста на следующие вопросы:
да
Доволен ли ты тем, как прошел урок?
нет
Было ли тебе интересно?
не очень
Сумел ли ты получить новые знания?
Ты был активен на уроке?
Учитель был внимателен к тебе?
Ты сумел показать свои знания?
Что больше всего тебе понравилось на уроке?
Что тебе не понравилось на уроке?

Итог урока .
Д/з §§ 119-120 , упр.20 (4,5)


 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация к уроку "Электрический ток в жидкостях. Закон Фарадея" (10.9 MB)
Презентация к уроку "Электрический ток в жидкостях. Закон Фарадея" (10.9 MB)
 0
0 148
148 8
8 Нравится
0
Нравится
0


