Вопрос №1 Что такое степень окисления? (показ слайда №2)
Вопрос №2 Прокомментируйте и выполните задание (вместо «Х» подставить цифру, которая укажет на степень окисления хим. элемента). (показ слайда №2)
Проверка правильности ответа. (показ слайда №3)
Вопрос №3 Что такое ОВР ? (показ слайда №4)
Вопрос №4 Прокомментируйте схемы уравнений реакций (вместо «Х» подставить цифру, которая укажет на число переходящих электронов). (показ слайда №4)
Проверка правильности ответа. (показ слайда №5)
Вопрос №5 Что такое окисление и восстановление? (показ слайда №6)
Вопрос №6 Какой из процессов изображен на схемах (вместо «Х» подставить цифру, которая укажет число принятых или отданных электронов)? (показ слайда №6)
Проверка правильности ответа (показ слайда №7),
выставление оценок за устные ответы.
Создание проблемной ситуации и ее решение.
Учитель: Зачем нам нужно знать о классификации хим. реакций в свете электронной теории? Что бы ответить на этот вопрос, давайте решим расчетную задачу.
Текст задачи: Какой объем газа - оксида азота (II) - выделится при взаимодействии 32г меди с раствором азотной кислоты? (Запомните, что азотная кислота,при взаимодействии с металлами, ведет себя по сравнению с другими кислотами иначе, окислителем будет азот со степенью окисления +5, которому все равно, где находится металл в ряду напряжений – до или после водорода).
Ученик у доски начинает решать задачу с составления уравнения хим. реакции:
Cu + HNO3 - Cu(NO3)2 + NO + H2O, при этом он и ученики видят, что расставить коэффициенты в уравнении методом подбора, как это делали ранее,- дело не только трудное, даже невозможное … Как же тогда быть?
Учитель задает наводящие вопросы учащимся:
Какой это тип реакции? Что здесь будет окислителем и восстановителем? Как с помощью электронных уравнений показать переход электронов? Есть ли равновесие (баланс) в составленных схемах? Как поступить, если число принятых и отданных электронов не совпадает ( а ведь есть правило сохранения числа электронов в ОВР)? (Это ОВР. Окислителем будет азотная кислота за счет азота со С.О.=+5,которую он понижает до С.О.=+2; а восстановителем будет медь, С.О. свою она повышает от 0 до +2. Электронные уравнения для данного процесса: Cu0 - 2e = Cu+2 (окисление) и N+5 + 3e = N+ 2 (восстановление). Баланса в полученных электронных уравнениях нет. Найдем между принятыми и отданными электронами наименьшее общее кратное, а затем коэффициенты перед формулами веществ в исходном уравнении).
Ученик, составляя электронные уравнения, находит коэффициенты для данного уравнения реакции : 3 Cu + 8 HNO3 - 3 Cu(NO3)2 + 2 NO + H2O
Учитель: Итак, мы поставили в данном уравнении коэффициенты, опираясь на знания электронной теории, т.е. методом электронного баланса. Теперь можно было бы решить задачу, это будет ваше домашнее задание. Так, зачем же нам нужны сведения об ОВР? Давайте попробуем предложить алгоритм действий при составлении ОВР методом электронного баланса.
Ученики рассуждают …. (показ слайда № 8)

Метод электронного баланса
Цель: научиться использовать метод электронного баланса при записи уравнений химических реакций.
Учитель химии: Ткаченко Алла Евгеньевна, МОУ СОШ № 84, г. Пермь, 2009 г .
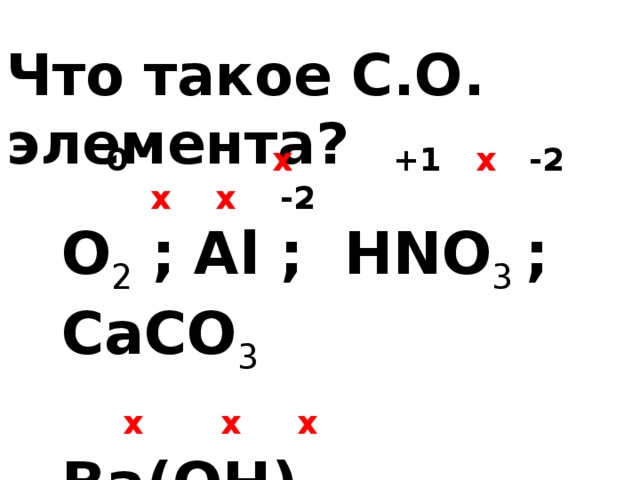
Что такое С.О. элемента?
0 x +1 x -2 x x -2
О 2 ; Al ; HNO 3 ; CaCO 3
x x x
Ba(OH) 2

Что такое С.О. элемента?
0 0 +1 +5 -2 +2 +4 -2
О 2 ; Al ; HNO 3 ; CaCO 3
+2 -2 +1
Ba(OH) 2
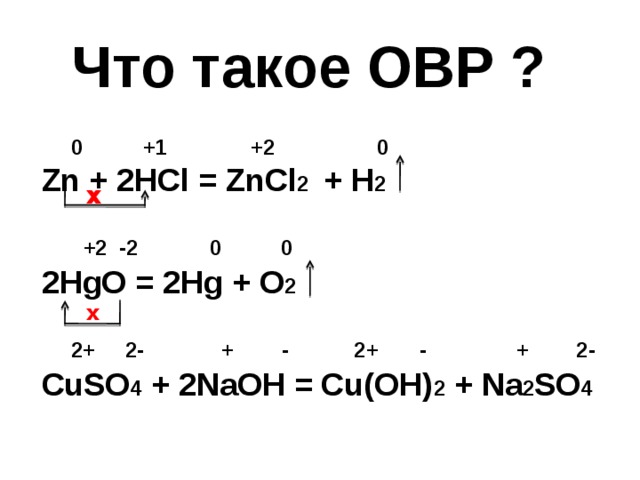
Что такое ОВР ?
0 +1 +2 0
Zn + 2HCl = ZnCl 2 + H 2
+2 -2 0 0
2HgO = 2Hg + O 2
2+ 2- + - 2+ - + 2-
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
x
x
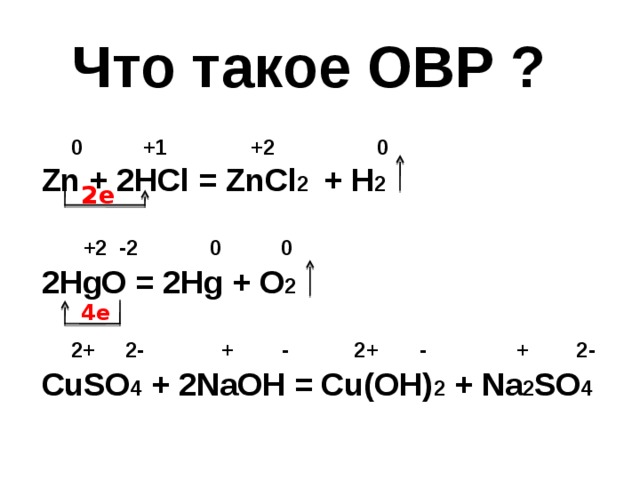
Что такое ОВР ?
0 +1 +2 0
Zn + 2HCl = ZnCl 2 + H 2
+2 -2 0 0
2HgO = 2Hg + O 2
2+ 2- + - 2+ - + 2-
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
2e
4e

Что такое окисление
и восстановление?
+ 1 0 0 + 2
2H + 2ē H 2 ; Zn - 2ē Zn
0 +6 +5 -3
S – x ē S ; N + x ē N
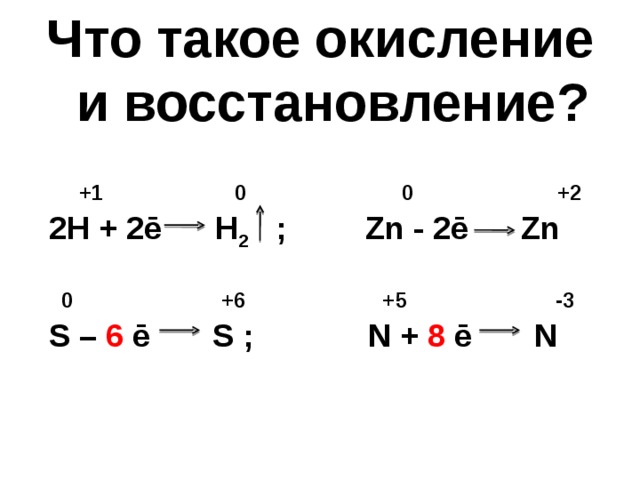
Что такое окисление
и восстановление?
+ 1 0 0 + 2
2H + 2ē H 2 ; Zn - 2ē Zn
0 +6 +5 -3
S – 6 ē S ; N + 8 ē N

Алгоритм :
1) Определяем С.О. элементов до и
после реакции.
2) Выписываем элементы , в которых
изменилась С.О.
3) Составляем уравнение электрон-
ного баланса ( помни! что число при-
нятых и отданных ē равно) .
4) Находим коэффициенты и расстав-
ляем их в ур-е р-и .
5) Определяем ок-ль и восст-ль .
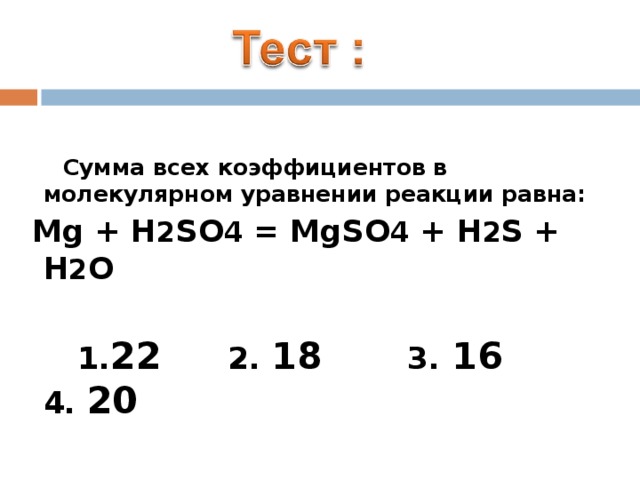
C умма всех коэффициентов в молекулярном уравнении реакции равна:
Mg + H 2 SO 4 = MgSO 4 + H 2 S + H 2 O
1 . 22 2. 18 3. 16 4. 20

Основные выводы:
- Метод электронного баланса позволяет понять сущность окислительно-восстановительных процессов и помогает в расстановке коэффициентов при записи уравнений химических реакций.











 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к уроки химии "Составление уравнений ОВР методом электронного баланса " (885.5 KB)
Презентация к уроки химии "Составление уравнений ОВР методом электронного баланса " (885.5 KB)
 0
0 903
903 126
126 Нравится
0
Нравится
0



