
Газовые законы
Молекулярная физика. Тепловые явления

Сегодня на уроке
3
1
Познакомимся с изотермическим, изохорным и изобарным процессами.
Вспомним, какое состояние газа описывает уравнение
Клапейрона — Менделеева.
2
4
Узнаем, какие процессы называются изопроцессами.
Узнаем, какими газовыми законами описываются изопроцессы.
2

Уравнение состояния идеального газа
Уравнение, связывающее температуру, давление и объём идеального газа в состоянии теплового равновесия, называют уравнением состояния идеального газа.
Дмитрий Менделеев
1834—1907
2

Уравнение состояния идеального газа
Уравнение Клапейрона — Менделеева справедливо для любой массы газа и связывает между собой параметры одного его состояния.
Д. И. Менделеев
1834—1907
2

Изопроцессы
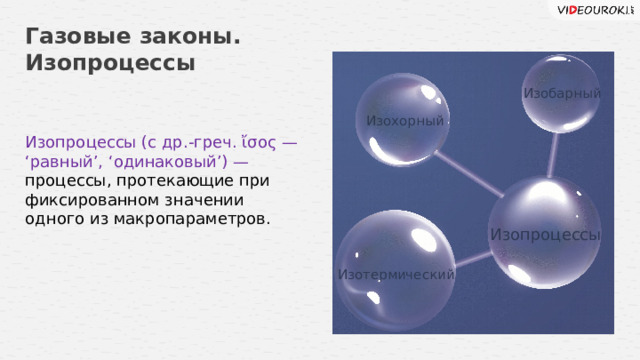
Изотермический
( Т = const)
Изобарный
( p = const)
Изохорный
( V = const)
5
Газовые законы. Изопроцессы
Изобарный
Изохорный
Изопроцессы (с др.-греч. ἴσος — ‘равный’, ‘одинаковый’) —
процессы, протекающие при фиксированном значении одного из макропараметров.
Изопроцессы
Изотермический
5

Давление
Объём
Абсолютная температура
Газовые законы. Изопроцессы
Газовые законы —
количественные зависимости между двумя параметрами газа при неизменном значении третьего.
7

Газовые законы. Изопроцессы
Изотермический процесс
(с др.-греч. θέρμη — ‘теплота’) —
процесс изменения состояния газа при постоянной температуре.
Роберт Бойль
1627—1691
7

Закон Бойля — Мариотта
При постоянной температуре, неизменной массе и неизменном химическом составе газа произведение давления на объём есть величина постоянная.
Роберт Бойль
1627—1691
Эдм Мариотт
1620—1684
7

Газовые законы. Изопроцессы
Уравнение Клапейрона — Менделеева:
Изотермический процесс
(с др.-греч. θέρμη — ‘теплота’) —
процесс изменения состояния газа при постоянной температуре.
Но
7
Газовые законы. Изопроцессы
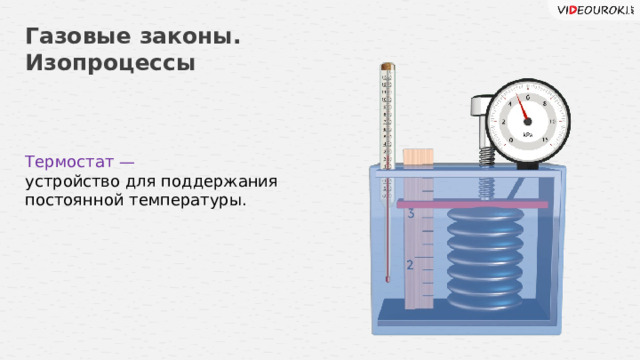
Термостат —
устройство для поддержания постоянной температуры.
7
Газовые законы. Изопроцессы
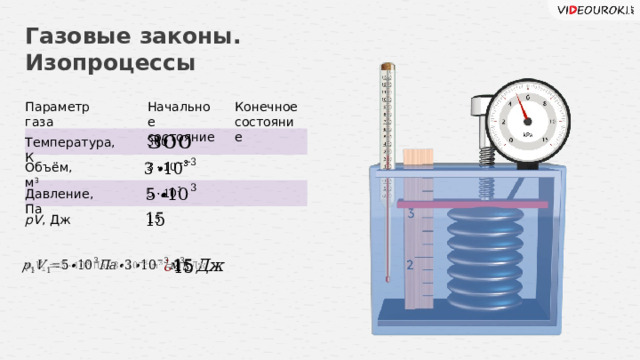
Параметр газа
Начальное
Конечное
состояние
состояние
Температура, К
Объём, м 3
Давление, Па
pV , Дж
7
Газовые законы. Изопроцессы
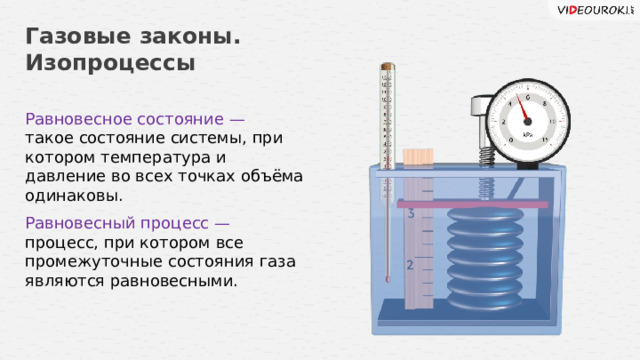
Равновесное состояние —
такое состояние системы, при котором температура и давление во всех точках объёма одинаковы.
Равновесный процесс —
процесс, при котором все промежуточные состояния газа являются равновесными.
7
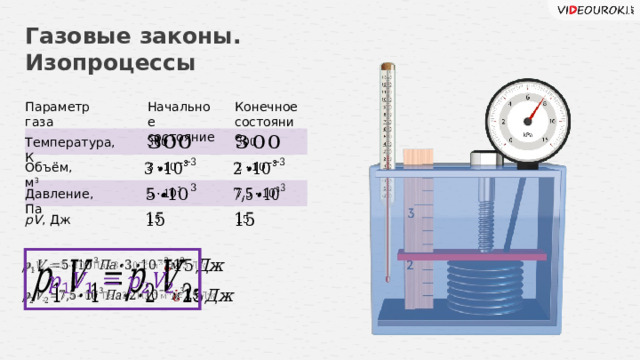
Газовые законы. Изопроцессы
Параметр газа
Начальное
Конечное
состояние
состояние
Температура, К
Объём, м 3
Давление, Па
pV , Дж
7

Газовые законы. Изопроцессы
Реальные газы подчиняются закону Бойля — Мариотта тем точнее, чем меньше их плотность.
При значительном увеличении давления закон Бойля — Мариотта перестаёт выполняться.
7
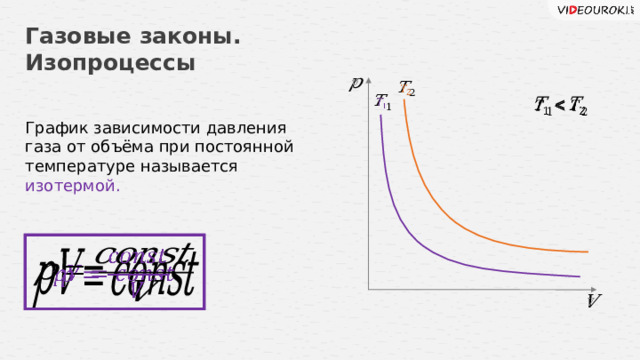
Газовые законы. Изопроцессы
График зависимости давления газа от объёма при постоянной температуре называется изотермой.
7

Газовые законы. Изопроцессы
Изохорный процесс
(с др.-греч. χώρος — ‘место’) —
процесс изменения состояния газа при постоянном объёме.
Жак Шарль
1746—1823
7

Газовые законы. Изопроцессы
Уравнение состояния:
Изохорный процесс
(с др.-греч. χώρος — ‘место’) —
процесс изменения состояния газа при постоянном объёме.
18

Закон Шарля
Если при переходе из начального состояния в конечное масса и молярная масса газа не изменяются, то отношение давления газа к температуре остаётся постоянным.
Жак Шарль
1746—1823
18
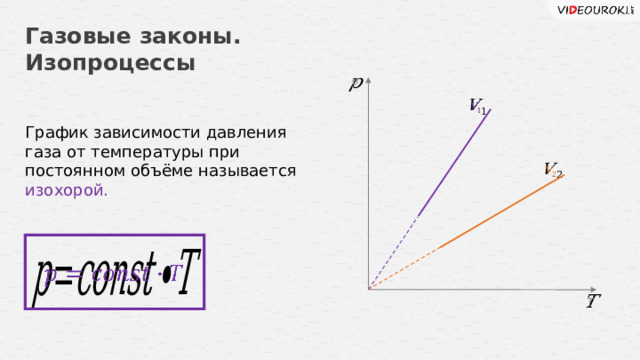
Газовые законы. Изопроцессы
График зависимости давления газа от температуры при постоянном объёме называется изохорой.
18

Газовые законы. Изопроцессы
При низких температурах все газы начинают существенно отличаться от модели «идеальный газ» и при уменьшении температуры превращаются в жидкости.
18
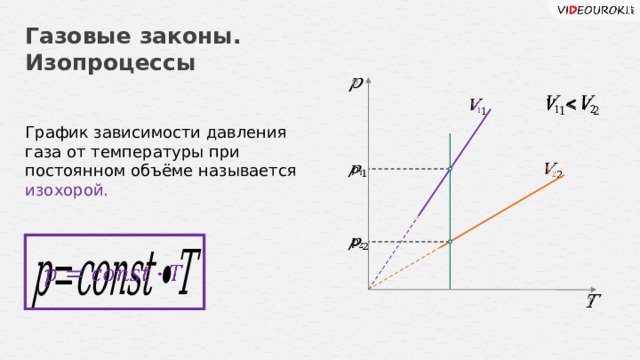
Газовые законы. Изопроцессы
График зависимости давления газа от температуры при постоянном объёме называется изохорой.
18

Газовые законы. Изопроцессы
Изобарный процесс
(с др.-греч. βάρος — ‘тяжесть’) —
процесс изменения состояния газа при постоянном давлении.
Жозеф Гей-Люссак
1778—1850
18

Закон Гей-Люссака
Если при переходе из начального состояния в конечное масса газа и его химический состав не изменяются, то отношение объёма газа к температуре остаётся постоянным.
Жозеф Гей-Люссак
1778—1850
18

Газовые законы. Изопроцессы
Уравнение Клапейрона — Менделеева:
Изобарный процесс
(с др.-греч. βάρος — ‘тяжесть’) —
процесс изменения состояния газа при постоянном давлении.
и
Но
18

Газовые законы. Изопроцессы
Закон Гей-Люссака:
если при переходе из начального состояния в конечное масса газа и его химический состав не изменяются, то отношение объёма газа к температуре остаётся постоянным.
26
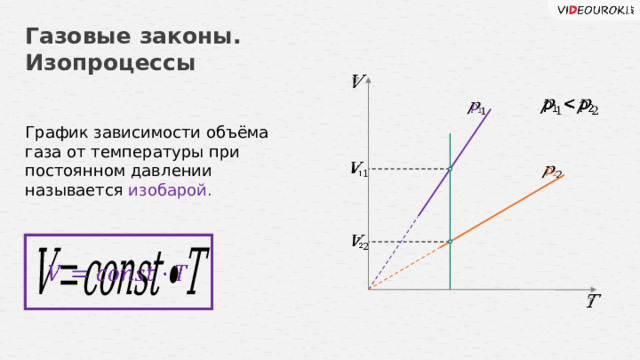
Газовые законы. Изопроцессы
График зависимости объёма газа от температуры при постоянном давлении называется изобарой.
26
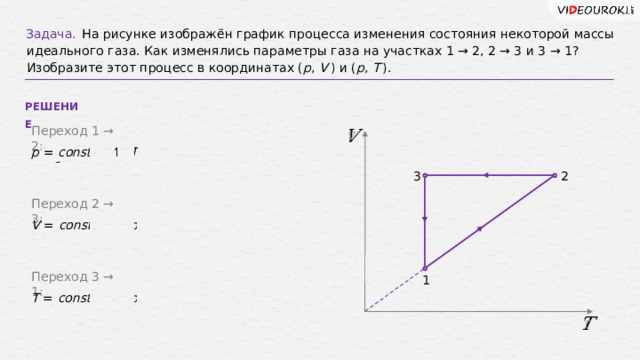
Задача.
На рисунке изображён график процесса изменения состояния некоторой массы идеального газа. Как изменялись параметры газа на участках 1 → 2, 2 → 3 и 3 → 1? Изобразите этот процесс в координатах ( p , V ) и ( p , T ).
РЕШЕНИЕ
Переход 1 → 2:
p = const , V ↑ , T ↑ ⇒ происходит изобарное расширение газа.
2
3
Переход 2 → 3:
V = const , T ↓ , p ↓ ⇒ происходит изохорное охлаждение газа.
Переход 3 → 1:
1
T = const , V ↓ , p ↑ ⇒ происходит изотермическое сжатие газа.
26
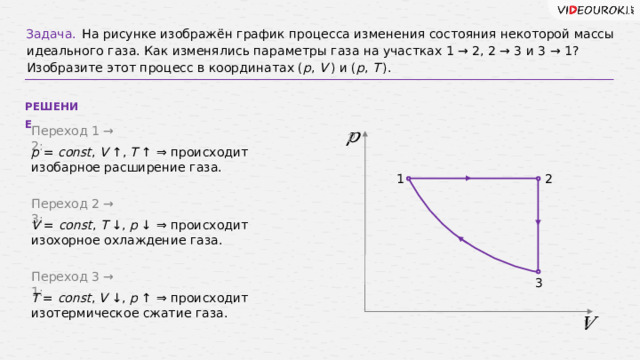
Задача.
На рисунке изображён график процесса изменения состояния некоторой массы идеального газа. Как изменялись параметры газа на участках 1 → 2, 2 → 3 и 3 → 1? Изобразите этот процесс в координатах ( p , V ) и ( p , T ).
РЕШЕНИЕ
Переход 1 → 2:
p = const , V ↑ , T ↑ ⇒ происходит изобарное расширение газа.
1
2
Переход 2 → 3:
V = const , T ↓ , p ↓ ⇒ происходит изохорное охлаждение газа.
Переход 3 → 1:
3
T = const , V ↓ , p ↑ ⇒ происходит изотермическое сжатие газа.
26

Задача.
На рисунке изображён график процесса изменения состояния некоторой массы идеального газа. Как изменялись параметры газа на участках 1 → 2, 2 → 3 и 3 → 1? Изобразите этот процесс в координатах ( p , V ) и ( p , T ).
РЕШЕНИЕ
Переход 1 → 2:
p = const , V ↑ , T ↑ ⇒ происходит изобарное расширение газа.
1
2
Переход 2 → 3:
V = const , T ↓ , p ↓ ⇒ происходит изохорное охлаждение газа.
Переход 3 → 1:
3
T = const , V ↓ , p ↑ ⇒ происходит изотермическое сжатие газа.
26

Газовые законы. Изопроцессы
В реальности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра.
26

Выводы
26

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация "Газовые законы" (17.31 MB)
Презентация "Газовые законы" (17.31 MB)
 0
0 118
118 10
10 Нравится
0
Нравится
0


