
Молекулярно – кинетическая теория
Пьер Симон Лаплас

1. История атомистических учений. Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества.
Представление о том, что все тела построены из мельчайших частиц – атомов , было высказано еще в V в. до н. э. греческим философом Демокритом. Создана теория атомистики была Левкиппом. Однако атомистические воззрения не получили признания и были возрождены лишь во второй половине XVII в. Бойлем. Затем в XVIII–XIX вв. на основе разработок Ломоносова, Дальтона, Больцмана, Максвелла и других была создана классическая молекулярно-кинетическая теория.

«Ничего не существует, кроме атомов и пустого пространства; все прочее – мнение» Демокрит
Левкипп (Leukippos)
(около 500-440 до н. э.). Один из создателей атомистики
Демокрит (Demokritos )
(р. около 460, Абдера (Фракия), - умер около 370 до н. э.).
Один из первых представителей атомизма.
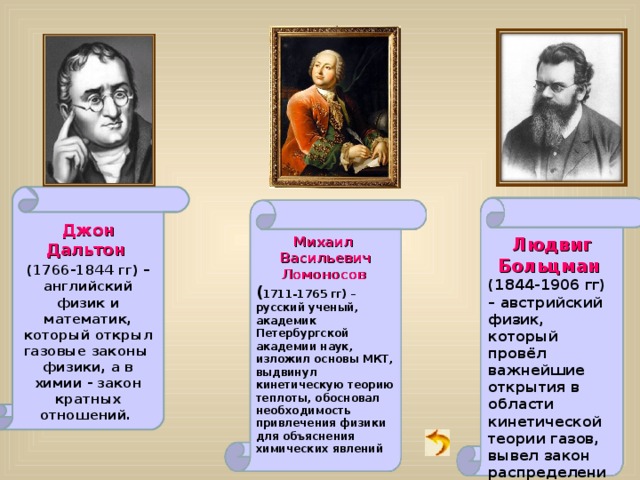
Джон Дальтон
(1766-1844 гг) – английский физик и математик, который открыл газовые законы физики, а в химии - закон кратных отношений.
Михаил Васильевич Ломоносов
( 1711-1765 гг) – русский ученый, академик Петербургской академии наук, изложил основы МКТ, выдвинул кинетическую теорию теплоты, обосновал необходимость привлечения физики для объяснения химических явлений
Людвиг Больцман
(1844-1906 гг) – австрийский физик, который провёл важнейшие открытия в области кинетической теории газов, вывел закон распределения молекул по скоростям, впервые применил законы термодинамики к процессам излучения

Молекулярно-кинетическая теория -
учение, которое объясняет строение и свойства тел движением и взаимодействием атомов и молекул, из которых состоят тела.

Задача МКТ:
Объяснение всех процессов, происходящих в макроскопических телах, на основе предположения о том, что вещество состоит из атомов и молекул, движение которых подчиняется законам механики Ньютона

Основные положения МКТ:
- все вещества состоят из частиц;
- частицы хаотически движутся;
- частицы взаимодействуют друг с другом.

Все вещества состоят из частиц:
Молекулы в свою очередь состоят из еще более мелких частиц – атомов. Различные комбинации из атомов и создают все множество видов молекул. МКТ рассматривает атомы и молекулы как твердые частички сферической формы диаметром в среднем порядка10 -9 –10 -10 м.

Частицы хаотически движутся
Одним из первых подтверждений теплового движения молекул является так называемое броуновское движение .
Хаотичным движением молекул объясняется явление диффузии .

Броуновское движение – движение мелких частиц, взвешенных в жидкости или газе
впервые было обнаружено в 1827 г. английским ботаником Робертом Броуном, правильнее Браун (Brown) (21.12.1773, Монтроз, — 10.6.1858, Лондон)

Диффузия -
это самопроизвольное перемешивание атомов, ионов, молекул в пространстве с неоднородным концентрационном поле, осуществляемое вследствие их теплового движения.

Частицы взаимодействуют друг с другом
Силы межмолекулярного взаимодействия имеют электрическую природу, обусловленную тем, что молекулы состоят из электрически заряженных частиц (положительных – атомных ядер и отрицательных – электронов), которым, как известно, свойственно притяжение – для разноименно заряженных и отталкивание – для одноименно заряженных частиц. Наличие сил притяжения и отталкивания между молекулами отчетливо обнаруживается в свойстве твердых сохранять свою форму при деформации.

2. Масса и размеры молекул. Тепловое движение
Молекула – наименьшая устойчивая частица какого-либо вещества, обладающая его химическими свойствами. Молекула состоит из одного или нескольких атомов одинаковых или различных химических элементов. Атом состоит из положительно заряженного ядра (соединенные протоны и нейтроны), вокруг которого на расстояниях, превышающих размер ядра более чем в 1000 раз, вращаются электроны. Атомы и молекулы электрически нейтральны.
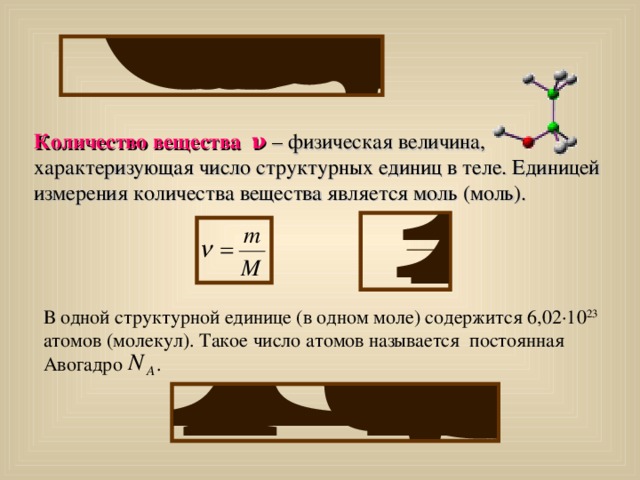
Количество вещества ν – физическая величина, характеризующая число структурных единиц в теле. Единицей измерения количества вещества является моль (моль).
В одной структурной единице (в одном моле) содержится 6,02∙10 23 атомов (молекул). Такое число атомов называется постоянная Авогадро .
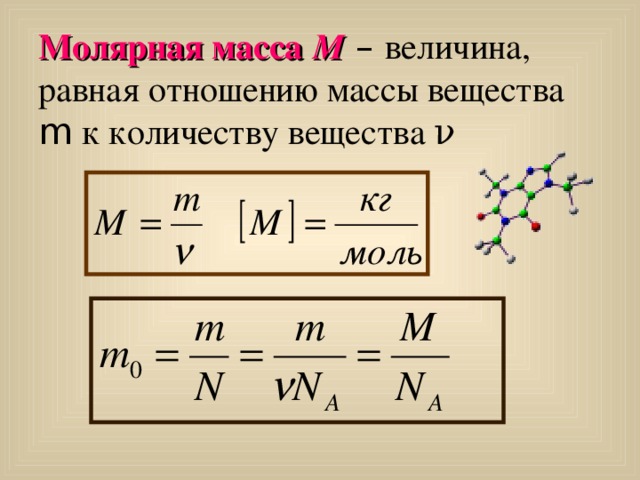
Молярная масса М – величина, равная отношению массы вещества m к количеству вещества ν

3. Абсолютная температура как мера средней кинетической энергии частиц
Тепловое движение – беспорядочное движение молекул вещества.
В жидкостях и газах молекулы беспорядочно движутся, соударяясь друг с другом. В твёрдых телах тепловое движение состоит в колебаниях частиц около положения равновесия. От скорости движения молекул зависит температура тела. Чем больше скорость движения молекул, тем выше температура тела. Обратим внимание на то, что тепловое движение отличается от механического тем, что в нём участвует очень много частиц и каждая движется беспорядочно.

Макроскопические (или термодинамические) параметры -
величины, характеризующие состояние термодинамической системы без учета молекулярного строения тел
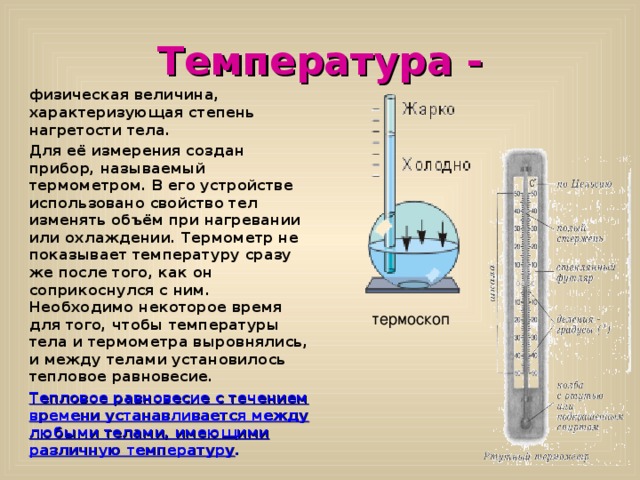
Температура -
физическая величина, характеризующая степень нагретости тела.
Для её измерения создан прибор, называемый термометром. В его устройстве использовано свойство тел изменять объём при нагревании или охлаждении. Термометр не показывает температуру сразу же после того, как он соприкоснулся с ним. Необходимо некоторое время для того, чтобы температуры тела и термометра выровнялись, и между телами установилось тепловое равновесие.
Тепловое равновесие с течением времени устанавливается между любыми телами, имеющими различную температуру .
термоскоп

Тепловое равновесие –
это такое состояние тел, при котором макроскопические параметры сколь угодно долго остаются неизменными. Это означает, что в системе не меняются объём и давление, не происходит теплообмен, отсутствуют взаимные превращения газов, жидкостей, твёрдых тел и т.д. В частности, не меняется столбика ртути в термометре, т.е. температура системы остается постоянной

Физический смысл температуры
Температура характеризует состояние теплового равновесия тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.

Температурная шкала Цельсия
Температурная шкала Цельсия была предложена в 1742 году шведским учёным А. Цельсием и названа в его честь. За ноль градусов шкалы Цельсия принимают температуру таяния льда, а за 100 градусов – температуру кипения воды при нормальном атмосферном давлении (760 мм. рт. ст.). Интервал между этими температурами разделён на 100 равных частей , по 1 градусу Цельсия (1°С).

А. Цельсий Описал стоградусную шкалу термометра, в которой температура кипения воды при нормальном атмосферном давлении была принята за 0°, а температура таяния льда – за 100°. Позже шведский биолог К.Линней «перевернул» эту шкалу, приняв за 0° температуру таяния льда. Этой шкалой мы пользуемся до сих пор, называя ее шкалой Цельсия.
Карл Линей ( 1707- 1778) - шведский естествоиспытатель, натуралист, ботаник, врач, основоположник современной биологической систематики, создатель системы растительного и животного мира, первый президент Шведской АН (, иностранный почетный член Петербургской АН
Андрес Цельсий (1701- 1744) - шведский ученый , астроном и физик.

Температурные шкалы
На практике используются и другие температурные шкалы, например, шкала Кельвина и шкала Фаренгейта. Взаимосвязь шкалы Цельсия, Кельвина и Фаренгейта, видно на рисунке.

Термодинамическая (абсолютная) температура T
Единица термодинамической температуры – кельвин (К).
Термодинамическая (абсолютная) температура T связана с температурой t по шкале Цельсия соотношением
T = t + 273,15
Температура, равная 0 К, называется абсолютным нулем температуры .
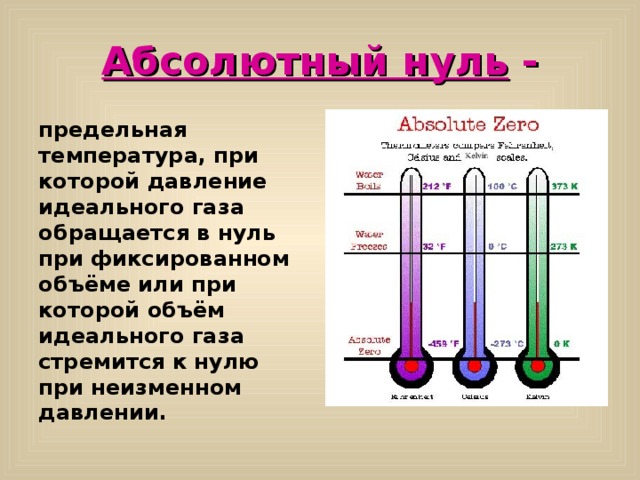
Абсолютный нуль -
предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении.

Основное уравнение молекулярно-кинетической теории .
(1)




 Получите свидетельство
Получите свидетельство Вход
Вход








































 Презентация по физике на тему "Основы МКТ" (6.5 MB)
Презентация по физике на тему "Основы МКТ" (6.5 MB)
 0
0 2130
2130 125
125 Нравится
0
Нравится
0


