
ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ. МАССА И РАЗМЕР МОЛЕКУЛ. КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЕКУЛЯРНАЯ ФИЗИКА. 10 класс
Выполнила: учитель по физике
Маланова Е.Л.
МБОУ СШ № 2
Г. Вилючинск

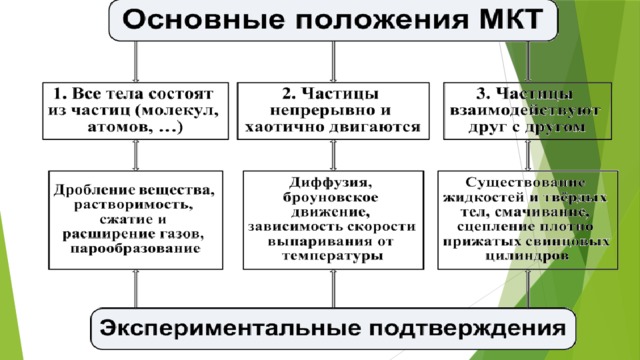
Цель МКТ –это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.

Макроскопические тела - большие тела, состоящие из огромного числа молекул. Тепловые явления – явления, связанные с нагреванием и охлаждением тел.

Броуновское движение
Броуновское движение - это тепловое движение взвешенных частиц в жидкости (или газе). Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества. - открыто английским ботаником Р. Броуном в 1827 г. - дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г. - экспериментально подтверждено франц. физиком Ж. Перреном.

Размеры частиц
Диаметр любого атома составляет около 10 ^-8 см.

Число молекул в веществе
где V – объем вещества, Vo – объем одной молекулы
![Масса одной молекулы где m – масса вещества, N – число молекул в веществе Единица измерения массы в СИ: [m]= 1 кг В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.). Условно принято считать за 1 а.е.м. : 1 а.е.м. m 0C =1,66 * 10 -27 кг 1 а.е.м.](https://fsd.videouroki.net/html/2017/01/12/v_5877470df1a2c/img7.jpg)
Масса одной молекулы
где m – масса вещества, N – число молекул в веществе Единица измерения массы в СИ: [m]= 1 кг В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.). Условно принято считать за 1 а.е.м. :
1 а.е.м. m 0C =1,66 * 10 -27 кг
1 а.е.м.

Относительная молекулярная (атомная) масса вещества
Для удобства расчетов вводится величина - относительная молекулярная масса вещества. Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель - это масса молекулы, а знаменатель - 1/12 массы атома углерода – величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.

Определите молекулярную массу :
1.Мr(О 2 ) 2.Mr(NO 2 ) 3.Mr (H 2 SO 4 ) 4.Mr (C 12 H 22 O 11 )

Ответы:
1.Мr(О 2 ) = 2•16 = 32; 2.Mr(NO 2 ) = 14+2•16 = 46; 3.Mr (H 2 SO 4 ) =2•1+32+4•16 = 98; 4.Mr (C 12 H 22 O 11 ) = 12•12+22•1 +11•16 = 342.
![Количество вещества Количество вещества (ν) определяет относительное число молекул в теле. где N – число молекул в теле, а Na - постоянная Авогадро Единица измерения количества вещества в системе СИ: [ν]= 1 моль 1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг. Запомни! В 1 моле любого вещества содержится одинаковое число атомов или молекул! Но! Одинаковые количества вещества для разных веществ имеют разную массу!](https://fsd.videouroki.net/html/2017/01/12/v_5877470df1a2c/img11.jpg)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N – число молекул в теле, а Na - постоянная Авогадро Единица измерения количества вещества в системе СИ: [ν]= 1 моль 1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг. Запомни! В 1 моле любого вещества содержится одинаковое число атомов или молекул! Но! Одинаковые количества вещества для разных веществ имеют разную массу!

Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро
или постоянной Авогадро:
N a = 6*10 23 моль -1
![Молярная масса Молярная масса (M) - это масса вещества, взятого в одном моле, или иначе - это масса одного моля вещества. M= m o * N a где m o – масса молекулы N a - постоянная Авогадро Единица измерения молярной массы: [M]=1 кг/моль.](https://fsd.videouroki.net/html/2017/01/12/v_5877470df1a2c/img13.jpg)
Молярная масса
Молярная масса (M) - это масса вещества, взятого в одном моле, или иначе - это масса одного моля вещества.
M= m o * N a
где m o – масса молекулы N a - постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.

Масса любого количества вещества
m= m o* N = * N=M* ᶹ
Количество вещества

Число молекул в веществе
Молярная масса
Масса одной молекулы

Связь между относительной молекулярной массой и молярной массой

Задача 1. Вычислите массу одной молекулы серной кислоты , формула которой Н 2 SО 4 .
Задача 2. Рассчитайте, какое число молекул содержится в 50 г алюминия ( Al )?

 Получите свидетельство
Получите свидетельство Вход
Вход











 Основные положения МКТ. (260.04 KB)
Основные положения МКТ. (260.04 KB)
 0
0 4601
4601 433
433 Нравится
0
Нравится
0



