
Казахский национальный медицинский университет имени С.Ж.Асфендиярова
С.Ж.Асфендияров атындағы қазақ ұлттық медицина университеті
Кафедра: Физика
СРС
Орындаған: Байконуров Абылайхан Дауренович Факультет: Фармация мектебі Тобы: ФӨТ 17-001-02 Курс: 1 Тексерген: Умирбекова Замзагуль Климовна
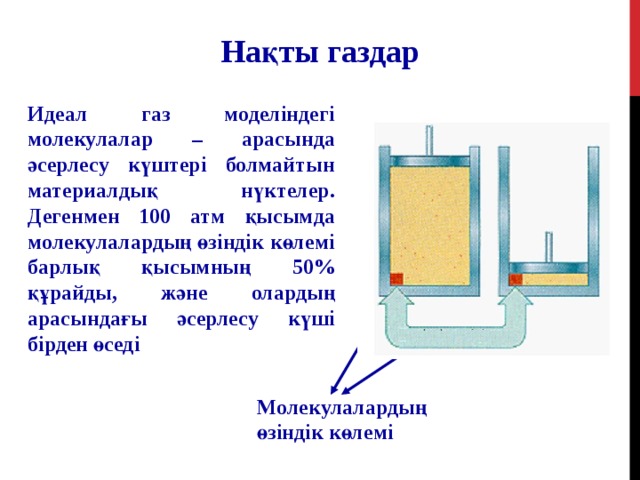
Нақты газдар
Идеал газ моделіндегі молекулалар – арасында әсерлесу күштері болмайтын материалдық нүктелер. Дегенмен 100 атм қысымда молекулалардың өзіндік көлемі барлық қысымның 50 % құрайды, және олардың арасындағы әсерлесу күші бірден өседі
Молекулалардың өзіндік көлемі

Қысым ұлғайғанда сығылғaн газ көлемі молекулалардың өздері алатын көлемге теңеседі

- Идеал газ күйінің теңдеуі төмен қысымда және жоғары температурадағы газдар әрекетін сипаттауға пайдалы.
- Идеал газадың берілген күйден ауытқуы сығылу коэффициентімен Z сипатталады
- Егер Z = 1 болса, идеал газ қасиетіне жақын болады
- Сығылу коэффициенті Z 1-ден өзгеше болса,солғұрлым идеал газадан ауытқуы күштірек болады
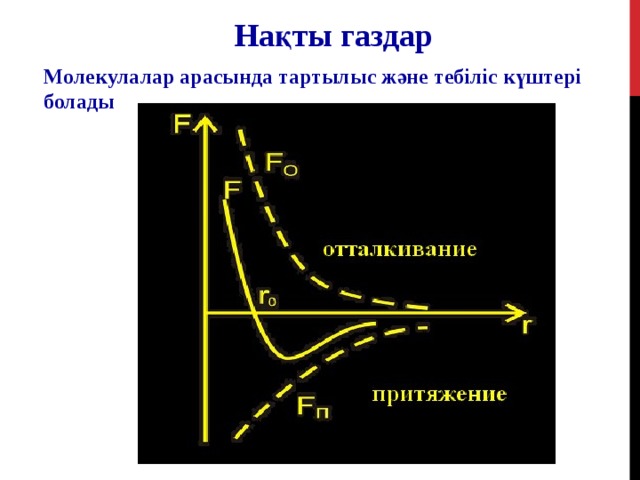
Нақты газдар
Молекулалар арасында тартылыс және тебіліс күштері болады
Тебілу
Тартылу

Молекулалардың потенциялдық және кинетикалық энергиялары арасындағы арақатынас агрегаттық күйлерге бөлу үшін сындық болып табылады

Нақты газ күйінің теңдеуі –Ван-дер-Ваальс теңдеуі
Нақты газдарда келесі ескерілу керек:
- Бөлшектерде өз көлемі болады
- Молекулалар арасында тартылыс және тебіліс күштері бар
Идеал газ күйінің теңдеуі
молекулалардың өз көлемі мен олардың әсерлесуі ескерілетіндей түрлендірілуі қажет
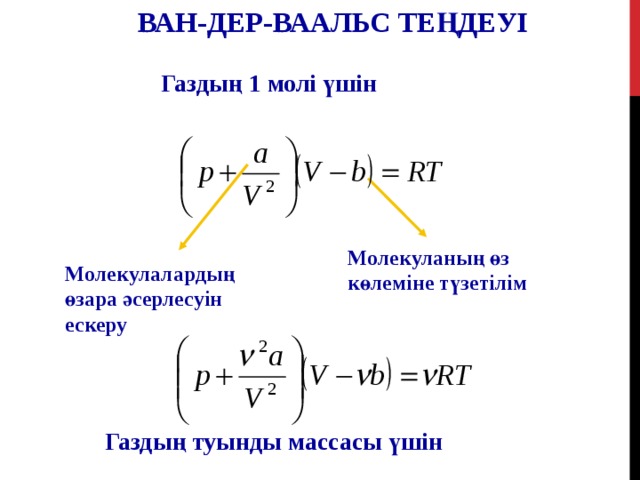
ВАН-ДЕР-ВААЛЬС ТЕҢДЕУІ
Газдың 1 молі үшін
Молекуланың өз көлеміне түзетілім
Молекулалардың өзара әсерлесуін ескеру
Газдың туынды массасы үшін

B- тұрақтысы молекула өлшеміне байланысты: үлкен молекула үшін оның мәні де үлкен
a- молекулалар арасындағы тартылыс күшінің шамасы
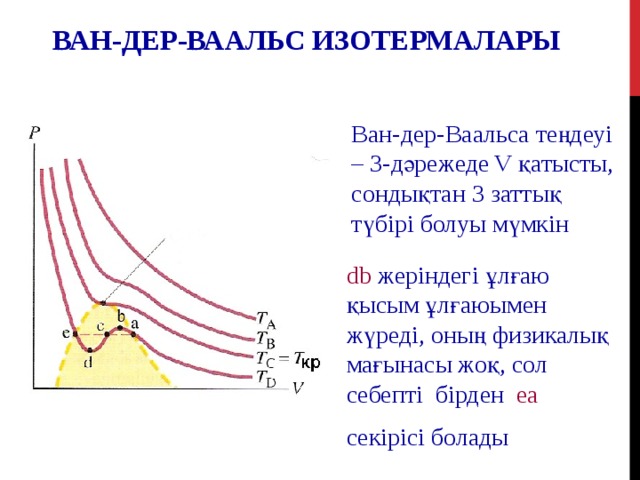
ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫ
Ван-дер-Ваальса теңдеуі – 3-дәрежеде V қатысты, сондықтан 3 заттық түбірі болуы мүмкін
db жеріндегі ұлғаю қысым ұлғаюымен жүреді, оның физикалық мағынасы жоқ, сол себепті бірден ea
секірісі болады
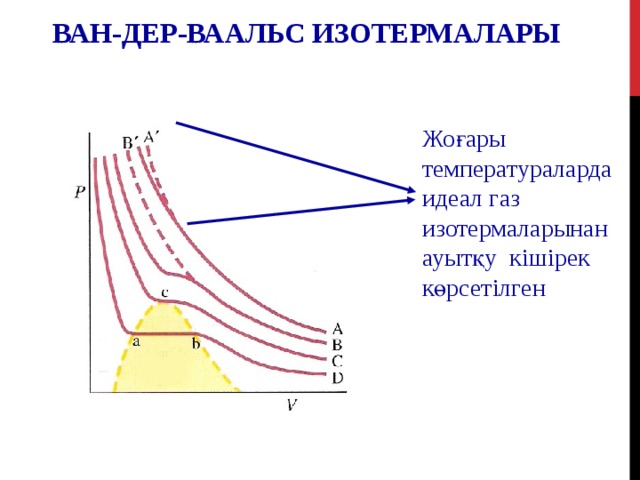
ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫ
Жоғары температураларда идеал газ изотермаларынан ауытқу кішірек көрсетілген

Нақты газдың ішкі энергиясы
Нақты газдың ішкі энергиясы молекулалардың кинетикалық ,сондай –ақ потенциалдық энергияларынан құралады
Газдың 1молі үшін:
Молекулалардың потенциалдық энергиясының қосындысы
Молекулалардың кинетикалық энергиясының қосындысы

 Получите свидетельство
Получите свидетельство Вход
Вход











 Нақты газдар физика (887.81 KB)
Нақты газдар физика (887.81 KB)
 0
0 1632
1632 14
14 Нравится
0
Нравится
0



