Государственное бюджетное профессиональное образовательное учреждение «Челябинский техникум промышленности и городского хозяйства имени Я.П.Осадчего»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ПРАКТИЧЕСКИМ ЗАДАНИЯМ И ЛАБОРАТОРНЫМ РАБОТАМ ПО ХИМИИ ДЛЯ СТУДЕНТОВ
для ппкрс 19.01.17 Повар, кондитер
предмет химия
курс 1, 2 (246 ч.)
для ППКРС 19.01.17 Повар, кондитер
уровень профильный (естественнонаучный
составитель Рогоза Ольга Викторовна
Согласовано на заседании ПЦК
Протокол № 1 от 29 августа 2019 г.
_______________ /Л.А.Бикбулатова/
Челябинск, 2019
Разработчик:
Рогоза О.В., преподаватель химии и биологии
ГБПОУ «ЧТПиГХ им.Я.П.Осадчего»
Задания по выполнению практических заданий по дисциплине «химия» разработаны Рогоза О.В. на основе требований ФГОС среднего общего образования, предъявляемых к структуре, содержанию и результатам освоения учебной дисциплины «обществознание», в соответствии с основной профессиональной образовательной программы по профессии 19.01.17 Повар, кондитер для профессиональных образовательных организаций, рекомендованной ФГАУ «ФИРО» в качестве примерной программы для реализации основной профессиональной образовательной программы СПО на базе основного общего образования с получением среднего общего образования (Протокол № от 27.08.2015 г.
Методические рекомендации обеспечивают реализацию дифференцированного подхода в обучении, позволяют применять опережающий метод познания и практического освоения учебного материала студентами ГБПОУ «ЧТПиГХ им. Я.П.Осадчего».
| № работы | Название работы | Общее количество часов |
| Лабораторная работа№1 | «Моделирование построения Периодической таблицы хим. элементов» | 2 |
| Лабораторная работа№2 | «Устранение жёсткости воды временной и постоянной» | 2 |
| Лабораторная работа№3 | «Характер диссоциации различных гидроксидов» | 2 |
| Лабораторная работа№4 | «Испытание растворов кислот индикаторами»
| 2 |
| Лабораторная работа№5 | «Реакции, идущие с образованием осадка, газа или воды» | 2 |
| Лабораторная работа№6 | «Изучение свойств серной кислоты.»
| 2 |
| Лабораторная работа№7 | «Изучение свойств щелочей и нерастворимых оснований»
| 2 |
| Лабораторная работа№8 | «Изучение свойств солей». | 2 |
| Лабораторная работа№9 | «Гидролиз солей различного типа» | 2 |
| Лабораторная работа№10 | «Распознавание хлоридов сульфатов, карбонатов.»
| 2 |
| Лабораторная работа№11 | «Изготовление моделей молекул органических веществ» | 2 |
| Лабораторная работа№12 | «Изготовление моделей молекул органических веществ.» | 2 |
| Лабораторная работа№13 | Ознакомление с коллекцией каучуков | 2 |
| Лабораторная работа№14 | Ознакомление с коллекцией нефтепродуктов | 2 |
| Лабораторная работа№15 | «Растворение глицерина, взаимодействие его с гидроксидом меди».
| 2 |
| Лабораторная работа№16 | Взаимодействие глюкозы с гидроксидом меди. | 2 |
| Лабораторная работа№17 | Качеств реакция на альдегиды | 2 |
| Лабораторная работа№18 | Качеств. реакция на крахмал | 2 |
| Лабораторная работа№19 | Обнаружение белков в молоке и мясном бульоне | 2 |
| Лабораторная работа№20 | Обнаружение аспирина в готовой лекарственной форме | 4 |
| Лабораторная работа№21 | «Знакомство с образцами полисахаридов»
| 4 |
| Лабораторная работа№22 | «Получение эмульсии растительного масла и бензола» | 4 |
| Лабораторная работа №23 | «Обнаружение воды и сажи, углекислого газа в продуктах горения свечи» | 4 |
| Лабораторная работа № 24 | «Правила работы в лаборатории. Изучение строение пламени. Очистка соли» | 4 |
| Практическое занятие № 1,2. | Относительные атомные и молекулярные массы
| 4 |
| Практическое занятие № 3 | Решение задач на определение массовой доли элементов в сложном веществе | 2 |
| Практическое занятие № 4 | Нахождение протонов. электронов и электронов. Составление электронных формул | 1 |
| Практическое занятие № 5 | Нахождение относительной молекулярной массы | 2 |
| Практическое занятие № 6 | Свойства химической связи | 2 |
| Практическое занятие № 6 | Решение задач | 1 |
| Практическое занятие № 7 | Выход продукции реакции
| 1 |
| Практическое занятие № 8 | Молярная концентрация | 1 |
| Практическое занятие № 9 | Приготовление раствора заданной концентрации. | 1 |
| Практическое занятие № 10 | Получение, собирание и распознавание газов | 2 |
| Практическое занятие № 11 | Оксиды и их свойства Классификация неорганических соединений | 2 |
| Практическое занятие № 12 | Скорость химических реакций | 2 |
| Практическое занятие № 13 | «Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами. Получение изоамилового эфира уксусной кислоты» | 2 |
| Практическое занятие № 14 | Решение экспериментальных задач.
| 2 |
| Практическое занятие № 15 | Изомерия и изомеры. Обнаружение углерода и водорода в органическом соединении | 2 |
| Практическое занятие № 16 | Решение задач на нахождение молекулярной формулы разл. соединений». | 2 |
| Практическое занятие № 17 | Алканы. «Составление структурных формул изомеров и названий алканов по систематической (международной) номенклатуре»
| 1 |
| Практическое занятие № 18 | Алкены. Взаимодействия этилена с бромной водой
| 1 |
| Практическое занятие № 19 | Алкины. Получение этилена дегидратацией этилового спирта | 2 |
| Практическое занятие № 20 | «Арены. Образование солей анилина
| 2 |
| Практическое занятие №21 | Спирты. Изучение растворимости спиртов в воде | 1 |
| Практическое занятие №22 | Глицерин. Изучение восстановительных свойств альдегидов.
| |
| Практическое занятие №23 | Решение задач | |
| Практическое занятие №24 | Ионные уравнения. Реакция ионного обмена в растворах электролитов | |
| Практическое занятие №25 | Распознавание пластмасс и волокон. | |
| Практическое занятие №26 | Решение экспериментальных задач на идентификацию органических соединений | |
| Практическое занятие №27 | Решение экспериментальных задач по неорганической и органической химии | |
| Практическое занятие №28 | Денатурация белка. Цветные реакции белка. | |
| Практическое занятие № 29 | «Обнаружение витамина А в подсолнечном масле. Обнаружение витамина С в яблочном соке. Определение витамина D в рыбьем жире или курином желтке. Действие амилозы слюны на крахмал.» | |
| | 58+42 ч. | |
| Итого | 100ч. | |
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
ПРИ ПРОВЕДЕНИИ ПРАКТИЧЕСКИХ РАБОТ
При работе в химической лаборатории существуют общие правила, которые необходимо строго соблюдать.
1. Перед каждой лабораторной работой следует изучить по учебнику относящийся к ней теоретический материал. Тогда лабораторные занятия будут полезными и продуктивными.
2. Начинать опыты, только внимательно прочитав полное описание работы и уяснив технику ее выполнения.
3. Все лабораторные работы выполнять индивидуально или парами по указанию преподавателя.
4. Приступать к выполнению задания только после разрешения преподавателя.
5. Внимательно прочесть надпись на этикетке, прежде чем взять вещество.
6. Не брать реактивы в большем количестве, чем требуется для опыта.
7. Опыт производить всегда в чистой посуде.
8. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку.
9. Не следует путать пробки от разных склянок, а также пипетки для взятия реактивов. Чтобы внутренняя сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
10. Не уносить реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место немедленно после использования.
11. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щелочи и не переносить их на рабочее место.
12. Все опыты, сопровождающиеся выделением ядовитых летучих и дурно пахнущих веществ, проводить только в вытяжном шкафу.
13. Нагревая пробирки, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
14. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
15. Реактивы не пробовать на вкус.
16. При работе с газоотводной трубкой убирать спиртовку из-под пробирки с реакционной смесью нужно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удален из нее. В противном случае жидкость засосет в реакционную пробирку, и может произойти растрескивание пробирки.
17. Осторожно пользоваться спиртовками. Спиртовку нельзя зажигать, наклоняя ее к другой горящей спиртовке. Чтобы погасить спиртовку следует накрыть ее сверху колпачком.
18. Реактивы не брать руками. После окончания эксперимента руки тщательно вымыть.
19. Не загромождать свое рабочее место лишними предметами, содержать рабочее место в чистоте.
ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицинской помощи, – порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо немедленно обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
Основные правила первой помощи сводятся к следующему:
1. При ранении стеклом удалите осколки из раны, смажьте рану раствором иода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо раствором соды (в случае ожога кислотой), либо разбавленной уксусной кислотой (в случае ожога щелочью), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог питьевой содой и забинтовать.
4. При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды, а затем промыть разбавленным раствором питьевой соды (при попадании кислоты) или 1 % раствором борной кислоты (при попадании щелочи).
После ознакомления с правилами техники безопасности при работе в химической лаборатории каждый учащийся должен расписаться в журнале по технике безопасности.
Знаки, обозначающие правила техники безопасности
при выполнении химических опытов, их расшифровка

Запрещается брать вещество руками
Запрещается оставлять вещества открытыми

Едкое вещество-кислота! Разрушает и раздражает кожу, слизистые оболочки.

Едкое вещество-щелочь! Разрушает и раздражает кожу, слизистые оболочки.

Токсичное и физиологически опасное вещество.

Токсичное и физиологически опасное вещество.

Токсичное и физиологически опасное вещество.

Токсичное и физиологически опасное вещество.
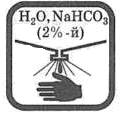
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды (NaHCO3).
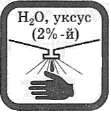
Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором уксусной кислоты.

Определяя вещество по запаху, не наклоняйтесь к сосуду, а направляйте к себе газ рукой, не делайте глубокого вдоха
Пробирку закрепляйте в пробиркодержателе у отверстия.
Зажигайте спиртовку спичкой. Гасите спиртовку, накрывая пламя колпачком

Нагревайте сначала всю пробирку или стеклянную пластину, затем, не вынимая ее из пламени, ту часть, где находится вещество.

Нагревайте вещества в верхней части пламени, так как она самая горячая.

Используйте для удерживания нагреваемых предметов (фарфоровой чашки, металлической, стеклянной и фарфоровой пластинок) тигельные щипцы.
Используйте шпатель для твердых веществ
Перемешивание растворов в пробирке проводите быстрым энергичным встряхиванием или постукиванием.
Для перемешивания веществ в химическом стакане используйте стеклянную палочку, на которую надет небольшой отрезок резиновой трубки, совершая ею круговые движения, чтобы не разбить дно сосуда.
Лабораторная работа № 1
Тема: Моделирование построения периодической таблицы Д.И, Менделеева.
Цель: Смоделировать периодическую таблицу Д.И. Менделеева и найти закономерности
в изменении свойств химических элементов.
Студент должен:
Знать: периодический закон и периодическую систему химических элементов Д.И. Менделеева; характеристику химических элементов по таблице Д.И. Менделеева: основные закономерности изменения свойств химических элементов в группах и периодах.
Уметь: давать характеристику химических элементов по таблице Д.И. Менделеева записывать схемы строения атомов химических элементов, электронные формулы, их графическое изображение.
Теоретическое обоснование
В 1896 году Д.И. Менделеев открыл периодический закон химических элементов: «Свойство простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
За основу периодической системы он берет не только атомную массу, но и химические свойства элементов.
Изменение химических свойств при последовательном переходе от элемента к элементу происходит посредством отрицания. Внутри периода происходит отрицание одних свойств (металлических) другими, прямо противоположными (неметаллическими).
Каждый период завершается благородным элементом, который так же является отрицанием предыдущего.
Новый период начинается с элемента, как бы повторяющего свойства предшествующего, но это повторение происходит на иной, более высокой основе.
В периодической системе видно, как количественные изменения (атомная масса) приводят к качественным (химические свойства) и, дойдя до определенного предела, незначительное изменение количества приводит к резкому изменению качества - скачку, например от F к Ne, отNe к Na.
Таким образом, свойства химических элементов по мере возрастания их атомных масс имеют периодический характер.
Периодический закон был оформлен Д.И. Менделеевым в виде периодической системы элементов.
Период - это горизонтальный ряд элементов, в котором свойства изменяются от типичного металла до типичного неметалла и заканчиваются благородным газом (за исключением пока седьмого периода).
Группа - вертикальная группировка элементов, в которой один под другим размещены сходные между собой элементы.
В современной периодической системе всего восемь групп. Каждая из них делится на главную и побочную подгруппы.
Главные подгруппы образованы вертикальными рядами элементов, начинающихся с элементов малых периодов, в которых сверху вниз нарастают металлические свойства.
Побочные подгруппы составляют только элементы больших периодов, все они являются металлами и объединяются по сходным признакам.
В 1911 году Резерфорд высказал гипотезу о планетарном строении атома. Согласно этой гипотезе атом представляет собой систему из очень малого по размерам ядра (10 -12 -10 -13см), вокруг которого по круговым орбитам движется такое число электронов, что они своим отрицательным зарядом нейтрализуют положительный заряд ядра. Д.Д. Иваненко и Е.Н. Гапон и одновременно В.Гейзенберг в 1932 году предложили протонно-нейтронную теориюстроения атомного ядра. Согласно этой теории атомные ядра состоят из протонов и нейтронов. Так как масса электронов в атоме очень мала, поэтому разности между атомной массой и массой протонов определяется число нейтронов. Массовое число определяет общее число протонов и нейтронов, а порядковый номер - число протонов в ядре и электронов в атоме.
В 1913 году датский ученый Н.Бор на основе квантовой теории излучения М.Планка развилквантовую теорию строения атома. В основу своей теории Бор положил следующие постулаты: электрон может двигаться вокруг ядра атома на по любым орбитам, а только по вполне определенным, дозволенным.
Обозначая орбиту дугой, а число электронов цифрами, схемы атомов по Косселю можно изобразить так: Пример:
1Н 2 Не 3 Li 11 Na 52 Te
+1) +2) +3) ) +11) ) ) +52) ) ) ) )
1 2 2 1 281 2 818186
При движении электронов по этим дозволенным орбитам атом не излучает энергию, излучение и поглощение энергии происходит при переходе электрона с одной орбиты на другую. При этом энергия излучения меняется порциями, или квантами.
Положению электрона на каждой из стационарных орбит соответствует определенный запас энергии атома. Когда электрон движется по первой орбите, прочность его связи с ядром максимальная, а запас энергии минимальный. Такое состояние атома называется нормальным.
Если подвести энергию к атому, то электрон переместится на одну из более удаленных орбит; при этом прочность связи его с ядром уменьшится, а запас энергии атома увеличится. Такое состояния атома называется возбужденным.
Для характеристики орбиты Бор ввел квантовое число, впоследствии получившее названиеглавного п. Число орбит элемента определяется номером периода. Так как периодов семь, то различают 1, 2, 3, 4, 5, 6, 7-й уровни энергии, которые называют также квантовыми слоями.
Общее число электронов в квантовом слое (энергетическом уровне) соответствует 2п , где п - номер слоя.
У элементов главных подгрупп число электронов на последнем квантовом слое равно номеру группы, предпоследний слой - законченный (2,8,18 электронов), на остальных число электронов равно 2п2. Пример:
15 Р ) ) ) 52 Те ) ) ) ) ) 85 At ) ) ) ) ) )
28 5 2 8 18 18 6 2 8 1832 18 7
У элементов побочных подгрупп число электронов на последнем квантовом слое равно двум (исключение Си, Аg, Аu, Nb, Мо, Сг, Ru, Rh, Рt — 1 электрон, у Рd — 0),
предпоследний квантовый слой не закончен, на остальных составляет 2п2.
Пример: 
Электрон может находиться в любой точке пространства вокруг ядра. Поэтому квантовая механика вводит понятие электронного облака. Электронное облако может иметь разную геометрическую форму. У атома водорода, обладающего одним электроном, орбиталь сферически симметрична и называется 1$ — орбиталыо (1 -квантовое число, s - тип орбитали). Так называемые орбитали первого типа — s -орбитали. Орбитали второго типа-р - орбитали являются вытянутыми. Область нахождения электрона - то по одну , то по другую сторону от ядра. Эти смежные облака образуют вместе нечто вроде гантели.
Орбитали третьего типа — d — орбитали имеют более сложную форму - они представляют собой как бы две скрещенные гантели, а -f- орбитали образуют еще более сложные облака (орбитали четвертого типа).
Пример: 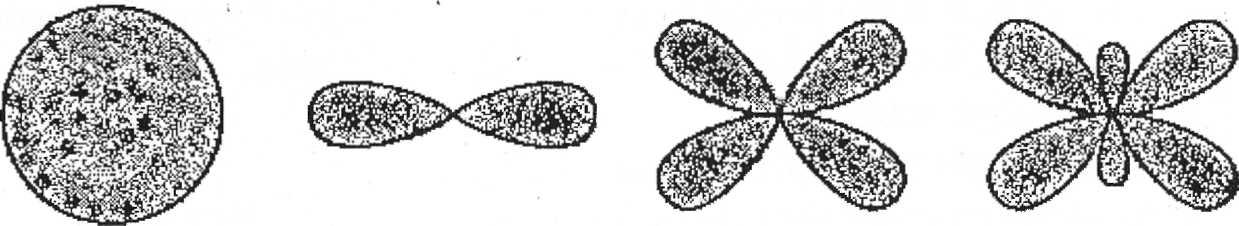
Форма электронного облака определяется вторым орбитальным квантовым числом l, состояние электрона при различных значениях l называют энергетическими подуровнями электрона в атоме и обозначают буквами s,р,d,f. Максимальное число электронов, размещающихся на каждом подуровне, равно:
S-2 электрона ($2);
р - 6 электронов (р6);
d-10электронов (d10 );
f-14 электронов(f14);
распределение электронов в атомах по энергетическим уровням и подуровням
изображают в виде так называемых электронных формул (электронных конфигураций).
Например, электронная формула (конфигурация) атома натрия, занимающего 11-е место в
периодической системе, выразится так:
11 Nа 1s2 2s2 2р6 Зs1.
Структуру электронных оболочек атомов часто изображают графически при помощиэнергетических ячеек (электронных структур).
Каждый электрон обладает еще и внутренним движением. Эффект, вызванный внутренним движением электрона вокруг собственной оси, характеризуется четвертым
квантовым числом - спиновым т$ это вращение электрона может иметь два противоположных направления: по часовой стрелке и против часовой стрелки.
Таким образом, атом состоит из ядра и электронов, ядро - из протонов и нейтронов.
+
Число электронов е и протонов р , а также заряд ядра определяются порядковым номером элемента (установлен Мозелем в 1913 году), а число нейтронов п - по разности между атомной массой и порядковым номером например:
для атома ^ Р - 15 р+, 15 е и 31-15 = 16 п°
Элементы в периодической системе Д.И. Менделеева расположены строго последовательно в порядке возрастания заряда ядер их атомов. Величина положительного заряда атомного ядра, возрастает от элемента к элементу на единицу. Эти количественные изменения обуславливают качественные изменения, повторение свойств в новом периоде происходит на более высокой основе. Поэтому периодический закон Д.И. Менделеева в настоящее время формулируется так:
Свойства химических элементов находятся в периодической зависимости от заряда их атомных ядер.
Ход работ:
-
Изучить теоретическое обоснование.
-
Выполнить предложенные задания.
-
Составить отчет.
Задание № 1
Расположить химические элементы 2,3,4 периодов в порядке возрастания относительных атомных масс, разделить их на ряды, начинающиеся щелочным металлом и заканчивающиеся инертным газом.
Выявить:
-
Закономерности изменения свойств химических элементов в рядах, объяснить почему.
-
Закономерности изменения валентности в кислородных соединениях химических элементов, объяснить
-
Закономерности изменения валентности по в водородных соединениях химических элементов.
Задание № 2
Ряды химических элементов в которых свойства изменяются последовательно (металлические усиливаются, а неметаллические ослабевают) расположить друг под другом.
Выявить:
-
Закономерности изменения свойств химических элементов от периода к периоду, объяснить почему.
-
Определить группы сходных элементов.
Задание № 3
Записать схемы строения атомов химических элементов, электронные формулы и их графическое изображение, дать общую характеристику химических элементов периодической таблицы Д.И. Менделеева.
Таблица1. Варианты заданий
Характеристики
1в
II в
III в
IV в
Ув
VI в
VII в
алюминий
кремний
сера
цинк
кальций
бром
фосфор
1 Знаки химических элементов
2 Число е" ,р+ , п°
3Аг (элемент)
4Количество энергетических уровней
5Формула высшего оксида
6Формула летучего водородного соединении
7Количество валентных электронов
8Номер группы, подгруппа Схема строения атомов химических элементов
10Электронная формула химических элементов
11Графическое изображение электронной формулы
Контрольные вопросы:
-
Формулировка периодического закона Д.И. Менделеева.
-
Что называется периодом?
-
Что такое группа?
-
Как изменяются свойства химических элементов в периодах и почему?
-
Как изменяются свойства химических элементов в группах и почему?
Содержание отчета:
-
Напишите номер, тему и цель работы.
-
Напишите решение заданий, результаты представьте в виде таблицы №1
-
Устно ответьте на контрольные вопросы.
Литература: Ю.М. Ерохин Химия, Москва «Академия» 2002.
Т.Е. Рудзитис
Ф.Г. Фельдман Химия 10 и 11 класс, Москва, «Академия», 2003 Ю.М. Ерохин
В.И. Фролов сборник задач и упражнений по химии, Москва, «Академия», 2003
Лабораторная работа №2
«Устранение жёсткости воды временной и постоянной»
Цель: закрепление знаний по теме «Растворы», формирование понятия «жесткость» воды, развитие умений по устранению жесткости воды; продолжить формирование умения проводить химические реакции.
Оборудование: набор реактивов и лабораторной посуды для проведения реакций.
ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ
Выполняя опыты, нужно пользоваться растворами только указанной концентрации и соблюдать рекомендуемую дозировку. Не делать дополнительных опытов без разрешения преподавателя.
Следует аккуратно работать с реактивами: внимательно читать этикетки, не уносить реактивы общего пользования на свои рабочие столы, во избежание загрязнения реактивов держать склянки с растворами и сухими веществами закрытыми, не путать пробки, не высыпать и не выливать обратно в склянки неиспользованные или частично использованные реактивы.
Если во время работы будет пролита кислота или щелочь, удалять их следует быстро, так как эти реактивы портят стол и другие предметы, и осторожно, чтобы не прожечь одежду и не повредить руки.
При нагревании растворов на электроплитке будьте внимательны: избегайте термических ожогов.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Важнейшим свойством природных вод является их жесткость. Если в воде
находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в
такой воде затрудняется образование пены при стирке белья или мытье рук, вследствие
чего возникает ощущение жесткости. Отсюда и возникло понятие "жесткой" воды.
Жесткость природных вод более всего обусловлена содержанием в них
растворимых солей кальция и магния.
Для промышленного водоснабжения жесткая вода почти всегда является
нежелательной, а иногда и недопустимой, нежелательна она и для бытовых нужд. К тому
же некоторые соли, обусловливающие постоянную жесткость природных вод,
способствуют разрушению (коррозии) металлических и бетонных конструкций.
Возможность коррозии бетона следует учитывать при строительстве зданий и
сооружений и предусматривать меры защиты. В каждом отдельном случае надо, прежде
всего, выяснить характер возможного воздействия среды на бетон, в том числе и
природных вод. Для этого необходимо знать их важнейшую характеристику - жесткость.
Жесткость, вызванная присутствием гидрокарбонатов кальция и магния,
называется временной жесткостью, поскольку устраняется при кипячении.
Жесткость, обусловленная хлоридами и сульфатами этих металлов, не устраняется
при кипячении. Этот вид жесткости называется постоянной жесткостью.
Суммарная жесткость воды носит название общей жесткости.
В промышленности жесткая вода, используемая для питания паросиловых
установок, приносит особенно большой вред. При работе паровых котлов в жесткой воде, содержащей Са(НСОз)2, Mg(HCO3)2 или CaSO4, на внутренней поверхности стенок котла образуется слой накипи, уменьшающий их теплопроводность и тем самым понижающий коэффициент полезного действия установки. Замедленная теплопередача через стенки котла приводит к их перегреву и вследствие этого к ускоренной коррозии (окислению кислородом воздуха). В результате прочность стенок котла постепенно понижается, что может привести к его взрыву.
Образование осадка (накипи) при использовании воды, обладающей временной
жесткостью, связано с выпадением в осадок малорастворимых карбонатов - СаСОз и
MgCO3. Если в воде присутствует сульфат кальция, то он выпадает в осадок из-за резкого
понижения его растворимости при нагревании. Особенно прочная, но вместе с тем
пористая, малотеплопроводная накипь образуется при одновременном содержании в воде
гидрокарбонатов и сульфата кальция.
Соли магния (MgCl2 и MgSO4) и СаСl2, содержащиеся в воде, не приводят к
образованию в котлах накипи, так как они хорошо растворимы в воде, но вызывают
коррозию стенок и металлической арматуры. Эти соли, как электролиты, способствуют
протеканию электрохимических процессов на поверхности стали и тем самым ускоряют
процесс ее коррозии под действием воды и кислорода. Кроме того, MgCl2 и MgSO4, как
соли слабого основания и сильных кислот, гидролизуются, повышая концентрацию
водородных ионов и, создавая кислую среду, что также ускоряет процесс коррозии стали.
Методы устранения и снижения жесткости воды.
Устранение или снижение жесткости воды называют умягчением. Его осуществляют различными методами.
-
Метод кипячения. Он позволяет устранить только временную (карбонатную) жесткость, обусловленную наличием в воде хорошо растворимых гидрокарбонатов кальция, магния и железа. При этом катионы Са2+, Mg2+,Fe2+ осаждаются в виде нерастворимых соединений.
Сa(HCO3)2 = СaCO3 + СО2 + H2O
Mg(HCO3)2 = MgCO3 + СО2 + H2O
-
Химическая обработка воды (реагентный метод). Этот метод позволяет устранить как временную жесткость, так и постоянную. Сущность его заключается в обработке воды специальными реагентами, образующими с ионами, вызывающими жесткость, малорастворимые соединения. К числу таких реагентов относятся: сода Na2CO3, негашеная CaO и гашеная Ca(OH)2извести, различные фосфаты натрия (Na3PO4, Na6P6O18) и др. Обработка известью позволяет связать и растворенный в воде углекислый газ. Использование фосфатов натрия предпочтительнее, так как образующие фосфаты кальция, магния и железа менее растворимы, чем соответствующие их карбонаты и гидроксиды.
CaSО4 + Na2CО3 = CaCО3↓+ Na2CО3
MgCl2 + Na2CО3 = MgCО3↓ + 2NaCl
3. Ионообменный метод. Это современный физико – химический метод основан на способности некоторых веществ, не растворимых в воде, стехиометрически обменивать свои ионы на ионы внешней среды (воды, растворов электролитов). Вещества, обладающие такими свойствами, называют ионообменниками (ионообменными сорбентами) или сокращенно ионитами. Большинство ионитов – твердые, ограниченно набухающие вещества, аморфной или кристаллической структуры. Они состоят из каркаса (матрицы) и закрепленных на нем ионогенных (активных функциональных) или комплексообразующих групп.
Литература:
1) страница 62-68. Тупикин Е.И. Химия в строительстве: учебное пособие для ССУЗов/ Е.И.Тупикин. – М.: Дрофа, 2010. – 174 с., ил.
2) страница 82-85. Габриелян О.С. Химия. 11 класс. Базовый уровень: Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. – 223, 1с.: ил.
Экспериментальная часть (Ход работы)
Опыт 1. Качественное определение жесткости воды с помощью раствора мыла.
В пробирках под номерами 1,2,3 находятся соответственно водопроводная, водопроводная кипяченая, дистиллированная вода. В каждую пробирку опускают по одинаковому кусочку мыла, сильно встряхивают в течение 1-2 мин, добиваясь более полного его растворения. Далее вода отстаивается. Сделайте выводы – опишите наблюдаемое.
Опыт 2. Устранение некарбонатной жесткости воды с помощью реакций ионного обмена.
Получите воду с постоянной, некарбонатной жесткостью. Для этого в пробирку с водой добавьте 1-2 капли хлорида кальция. Устраните некарбонатную жесткость: к полученному раствору добавьте раствор карбоната натрия. Что наблюдаете? Составьте уравнения реакций.
Сделать общий вывод.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое жесткость воды?
2. Виды жесткости воды.
3. В каких единицах выражается жесткость воды?
4. Какому содержанию Са2* и Mg2+ соответствует жесткость 1 мэкв/л?
5. Как определить временную жесткость воды?
6. Как определить общую жесткость воды?
7. Как определить постоянную жесткость воды?
8. Известковый способ умягчения воды.
9. Известково-содовый способ умягчения воды.
10. Ионнообменный способ умягчения воды.
Лабораторная работа '№4
Тема: Испытание растворов солей индикаторами. Гидролиз солей.Сравнение свойств неорганических соединений
Цель:
-
выяснить при каких условиях возможен. гидролиз соли;
-
научиться предсказывать.результаты экспериментов.гидролиза по формуле соли;
-
уметь писать уравнения гидролиза;
-
уметь предсказывать, по изменению окраски индикатора, среду раствора;
-
соблюдать правила техники безопасности при выполнении опытов;
-
осуществлять самоконтроль за результатами своей работы
Реактивы и оборудование:
-
индикаторы - лакмус, фенолфталеин, метиловый оранжевый, универсальный
-
NазРО4 , Nа2СОз, Nа2SОз, AlCI3, РЬ(NОз)з, ZnS04, NаNОз, KCl и
Na2S04 -
ящик, стеклянная палочка, вата.
Ход работы
Опыт №1. Изменение окраски индикаторов в растворах кислот и щелочей
-
Налейте в три пробирки понемногу дистиллированной воды и прибавьте раствор лакмуса до хорошо заметной окраски. Отметьте цвет лакмуса в водной среде. В одну из пробирок С раствором лакмуса прибавьте несколько капель кислоты, а в другую - щелочи. Наблюдайте изменение цвета индикатора.
-
Проделайте то же самое с фенолфталеином.
-
Повторите опыт с метиловый оранжевым.
Наблюдения поместите в таблицу:
| Индикатор | Окраска индикатора | ||
| в воде | в щелочи | в кислоте | |
| № 1. Лакмус | | | |
| № 2. Фенолфталеин | | | |
| № 3. Метиловый оранжевый | | | |
Опыт № 2.
В растворы солей NазРО4 , Nа2СОз, Nа2SОз, AlCI3, РЬ(NОз)з, ZnS04, NаNОз, KCl и Na2S04 прилейте по капле соответствующего (ожидаемой среде раствора) индикатора.
Задание: Опишите ваши наблюдения,
Составьте уравнение гидролиза (где он протекает). Укажите среду раствора соли.
Фома отчета:
Запись 'наблюдений по ходу опытов, выводы по результатам опытов зафиксируйте в тетрадь.
Контрольные вопросы
1. Какова концентрация ионов. н+ в чистой воде?
-
Прибавьте каплю фенолфталеина к раствору жидкого стекла (канцелярский клей), который является водным раствором силиката натрия NаzSiОз Что наблюдается? Что можно сказать о силе кремниевой кислоты?
-
Зная, что растворы щелочей растворяют жиры, объясните применение соды как
моющего .средства. -
Почему в таблице растворимости веществ в воде отсутствуют сведения, например, о
. сиmrкате аммония, карбонате меди?
Лабораторная работа №5
Тема: Реакции, идущие с образованием осадка, газа или воды.
Цель работы: Закрепление навыков работы с реактивами и написания уравнений реакций.
Задание: Проделать реакции, идущие с образованием осадка, газа, воды.
Оборудование: Штатив с пробирками, держатель.
Реактивы: цинк, р-ра соляной кислоты, р-ра серной кислоты, барий, р-ра гидроксида натрия, раствор фенолфталеина.
Методика выполнения:
1. В пробирку налейте 1-2 мл раствора серной кислоты и добавьте чуть - чуть бария. Что наблюдаете? Запишите уравнения реакции.
2. В пробирку поместите гранулу цинка и прилейте в неё 1-2 мл соляной кислоты. Что наблюдаете? Запишите уравнения реакции.
3. В пробирку налейте 1-2 мл раствора гидроксида натрия и добавьте 2-3 капли р-ра фенолфталеина. Затем прилейте 1-2 мл соляной кислоты. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Контрольные вопросы:
1. В каких 3х случаях реакции идут до конца?
2. Напишите уравнение реакций между цинком и фосфорной кислотой.
Лабораторная работа № 3
Тема: Получение, собирание и распознавание газов
Цели:
-
ознакомится на практике с индивидуальными свойствами карбонатов;
-
усвоить качественную реакцию на карбонат – ион и ион аммония;
-
научиться собирать прибор для получения газов и способам собирания газов;
-
закрепить умения применять знания, полученные на теоретических занятиях;
-
ознакомится на практике с индивидуальными свойствами солей аммония;
-
уметь применять знания, полученные на теоретических занятиях;
-
соблюдать правила техники безопасности при выполнении опытов;
-
осуществлять самоконтроль за результатами своей работы
Оборудование:
-
индикаторы – розовая лакмусовая бумажка, фенолфталеин,
-
NH4CI (сухой), Ca(OH)2 (сухой), NH4NO3, NH4OH (конц.)
-
индикаторы – лакмус,
-
мел, мрамор, HCI, NaOH, Na2CO3(сода);
-
ящик, штатив, пробирки, пробирка с газоотводной трубкой, горелка, чашка кристаллизационная, держатель, стаканчик, стеклянная палочка, сухое горючее.
Ход работы
Опыт 1. Получение аммиака и растворение его в воде
-
В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония (NH4CI) и порошок гидроксида кальция Ca(OH)2 (опыт удается лучше, если известь слегка влажная).
-
Приготовленную смесь насыпать в пробирку, или колбу на 1/3 ее объема.
-
Закройте пробирку пробкой с газоотводной трубкой, конец которого опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз.
-
Нагрейте смесь в пробирке.
-
Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите ее в кристаллизационную чашку с водой и откройте пробку.
-
После заполнение пробирки водой закройте ее отверстие пробкой и выньте пробирку из воды. В полученный раствор поместите красную лакмусовую бумажку – она синеет.
-
затем к раствору добавьте несколько капель фенолфталеина – появится малиновое окрашивание.
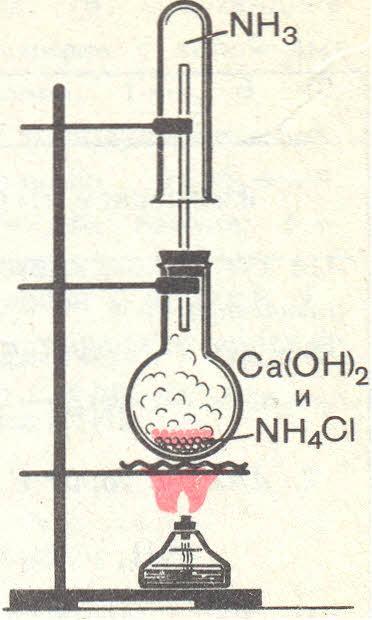
Прибор для получения аммиака
Задание
-
О выделении какого газа свидетельствуют сделанные вами наблюдения? Напишите уравнения соответствующей реакции.
-
Какое вещество образуется при растворении полученного газа а воде?
-
Какие наблюдения этот вывод подтверждает? Напишите уравнение данной реакции.
Опыт № 3. Взаимодействие солей аммония со щелочами (качественная реакция на катион аммония)
-
В одну пробирку поместите немного порошка NH4CI,
-
В другую -нитрат аммония NH4NO3
-
В обе пробирке прилейте по 1-2 мл раствора гидроксида натрия и слегка нагрейте.
Выделяется газ с резким запахом.
-
В струе выделяющегося газа поместите розовую лакмусовую бумажку, смоченную дистиллированной водой. Бумажка _________
Задание
-
Какой газ выделяется при взаимодействии солей аммония со щелочью?
-
Напишите уравнение соответствующих реакций.
-
Как можно отличить соли аммония от других солей?
Опыт № 4. Качественная реакция на карбонат – ион. (Распознавание карбонатов)
-
В одну пробирку положите немного мела, а в другую пробирку – питьевой соды.
-
В обе пробирке влейте несколько капель HCI.
-
В обеих пробирках происходит «вскипание». выделяется газ, от действия которого известковая вода мутнеет.
Задание:
-
На основе выполнение опытов сделайте вывод, что является характерной реакцией на карбонат – ион.
-
Напишите уравнение соответствующей реакции.
Контрольные вопросы
-
Гидрокарбонат аммония иногда применяется при выпечки кондитерских изделий. Какие свойства гидрокарбоната аммония при этом используются?
-
К каким электролитам (сильным или слабым) можно отнести соли аммония?
-
Раствор аммиака называют в воде –аммиачной водой и гидроксидом аммония. Обоснуйте эти названия.
-
Составьте уравнение реакций, при помощи которых из аммиака получают азотную кислоту.
-
Перечислите способы получения солей аммония?
-
Докажите опытным путем, что скорлупа куриного яйца содержит карбонат кальция. Наблюдения подтвердите уравнениями реакций.
-
Легче или тяжелее воздуха углекислый газ? Во сколько раз?
-
Из следующих утверждений верно лишь то, что углекислый газ
а) окрашен, б) легче воздуха, в) имеет запах, г) содержится в атмосферном воздухе.
Лабораторная работа №6
«Изучение свойств серной кислоты»
Цели:
1. Рассмотреть общие и специфические свойства разбавленной и концентрированной серной кислоты
2. Конкретизировать общие знания учащихся о свойствах серной кислоты в свете теории электролитической диссоциации на примере разбавленной серной кислоты.
3. Выявить характерные свойства концентрированной серной кислоты, обусловленные наличием в её составе серы высшей степени окисления.
4. Закрепить знания учащихся об окислительно-восстановительных реакциях на примере свойств концентрированной серной кислоты
5. Совершенствовать умения учащихся работать с лабораторным оборудованием и реактивами
6. Совершенствовать умение пользоваться компьютерной техникой для получения знаний по предмету.
7. Закреплять приемы безопасной работы при проведении лабораторных опытов.
Развивающие:
Продолжить формирование логического мышления, умения сравнивать, анализировать, обобщать и делать выводы
Воспитывающие:
Продолжать воспитание в обучающихся самостоятельности, уверенности в себе, добросовестного отношения к обучению, умение организовывать свою познавательную деятельность.
Тип урока: изучение нового материала
Вид урока: урок-практикум, урок-исследование
Методы и приёмы: фронтальная беседа, работа в парах, групповая работа, иллюстративно-словесный метод
Реактивы: разбавленная серная кислота, цинк (гранулы), магний (стружка), раствор фенолфталеина, раствор гидроксида натрия, раствор карбоната натрия, раствор хлорида бария, оксид меди (II).
Оборудование: , спиртовка, пробиркодержатель, стеклянная палочка, мерная ложечка, спички.
Технические средства обучения: ноутбуки, проектор. экран
Ход урока
I. Организация.
II. Изучение нового материала.
Учитель называет тему: «Свойства серной кислоты», открывает презентацию. Предлагает учащимся определить цели урока в соответствии с эпиграфом к уроку.
Перед началом урока учитель на каждую парту кладет по две схемы “Серная кислота” (которую учащиеся будут заполнять в ходе урока(Приложение №1) и инструкционная карта лабораторной работы(Приложение №2)
В ходе урока учитель работает по следующему плану:
-
Называем формулу серной кислоты – H2SO4 (учитель демонстрирует слайд, обучающиеся записывают в тетради) (Приложение №3)
-
Определяем степени окисления атомов в молекуле серной кислоты.
-
Составляем структурную формулу серной кислоты
-
Определяем тип связи, распределение электронной плотности в молекуле серной кислоты.
-
Обосновываем (переходим) к физическим свойствам серной кислоты (Демонстрируем слайд)
-
Переходим к изучению химических свойств H2SO4. Поясняем, что H2SO4 обладает как химическими свойствами кислот, так и особенными (специфическими) свойствами.
Рассматриваем общие химические свойства H2SO4
Работа в парах:
С этой целью вам предстоит выполнить лабораторную работу по инструктивным карточкам которые лежат на столах обучающихся. Уравнения , проведенных реакций записываем в схемы-конспекты, которые тоже есть на ваших столах.
Прежде чем приступить к выполению лабораторной работы вспоминаем правила техники безопасности.
а) серная кислота - сильный электролит. Обучающиеся составляют уравнение диссоциации в свои таблицы
б) Разбавленная серная кислота реагирует с металлами, стоящими в электрохимическом ряду напряжений до водорода. Например, с магниемили цинком:
![]()
.
H2SO4 реагирует с оксидами металлов. Например, с оксидом меди (II). Эта реакция идет при повышенной температуре.
![]()
Этот опыт проводит учитель демонстративно. В пробирку с помощью мерной ложечки помешаем немножко оксида меди (II) (на кончике мерной ложечки) и 5 мл разбавленной H2SO4. Закрепляем пробирку у основания горлышка пробиркодержателем, зажигаем спиртовку и начинаем греть. В ходе протекания реакции видно, что раствор приобретает голубую окраску. Просим ребят записать уравнение данной реакции в схему - конспект.
г) Серная кислота реагирует с основаниями, причем как с растворимыми, так и нерастворимыми. Например, с гидроксидом натрия.
![]()
д) Серная кислота реагирует с солями, если в ходе реакции выделяется газ или выпадает осадок. Предлагаем учащимся провести два опыта, пользуясь инструкционными картами. Один опыт с карбонатом натрия, другой с хлоридом бария.
Уравнения реакции записываются в схему – конспект. По окончани лабораторной работы учитель предлагает обучающимся проверить уравнения проведенных реакци по слайду представленному на экране..
Учитель: Поднимите руки у кого в составленных уравнениях реакций нет ошибок, у кого одна ошибка, две ошибки. Запишите домашнеее задание : в рабочей тетради ко всем проведенным реакциям составить полные и краткие ионнные уравнения.
Переходим к изучению специфических свойств H2SO4.
Так как в H2SO4 сера находится в высшей положительной степени окисления, то она может только принимать электроны, поэтому она является кислотой-окислителем и взаимодействует как с активными металлами, так и с металлами, стоящими в электрохимическом ряду напряжений металлов после водорода (Cu, Hg, Ag). В ходе этих реакций образуется не водород, а H2S, S или SO2 в зависимости от концентрации кислоты и от положения металла в ряду напряжений.
Работа в группах .Каждая группа , используя ноутбук, находит виртуальный опыт, описывающий свойства концентрированной серной кислоты, составляет уравнения прошедших на экране реакций в схему-конспект
1.Перваю группа даст описание взаимодействия серной кислоты с медью- неактивным металлом, стоящим в ряду напряжения после водорода.
По окончании просмотра представитель этой группы записывает составленное уравнение реакции на доске. ученики в схему-конспект. Преподаватель отмечает, что концентрированная кислота не реагирует со многими металлами при обычных условиях (Fe, Cr, Au, Pt, Al)
2.Вторая группа, просмотрев опыт, опишет взаимодействие серной кислоты с цинком, по окончании просмотра опыта, запишите уравнение реакции на доске, все обучающиеся записывают его в свои схемы-конспекты.
Zn+2H2SO4=ZnSO4+SO2↑+2H2O
3.Третья группа описывает просмотренный на ноутбуке опыт обугливания сахара.
По окончании работы в группах, представитель группы, записав уравнение просмотренной реакции и записав её уравнение на доске , дает описание опыта и результаты, обучающиеся фиксируют всю инфрмацию в схеме-конспекте.
Учитель: серная кислота не может реагировать при обычных условиях с железом, хромом и алюминием, но при нагревании происходит химическая реакция. При этом выделяется SO2, H2S или образуется свободная S.
8Al+15H2SO4=4Al2(SO4)3+3H2S↑+12H2O
Запишем уравнение реакции.
Серная кислота является окислителем и в реакциях с неметаллами
C+2H2SO4=2SO2↑+CO2↑+2H2O
III. Закрепление знаний, умений и навыков учащихся
Рефлексия
Учитель: “Мы рассмотрели основные физические и химические свойства серной кислоты. Выполните задание, представленное на экране.
IV. Домашнее задание: прочитать параграф, составить полные и краткие уравнения для реакций, записанных в классе, выполнить упражнение
Лабораторная работа №6
Тема: Изучение свойств серной кислоты.
Цель работы: Закрепление знаний и навыков о свойствах неорганических кислот.
Задание: Изучить свойства серной кислоты.
Оборудование: Штатив с пробирками, держатель
Реактивы: Раствор серной кислоты, гранулы, цинка, кусочки медной проволоки, раствор гидроксида натрия, раствор фенолфталеина, раствор хлорида бария.
Методика выполнения:
Опыт 1. Взаимодействие с металлами.
В 2 пробирки налейте 1-2 мл серной кислоты и поместите в первую гранулу цинка, а во вторую – кусочек медной проволоки. Что наблюдаете?
Напишите уравнения возможных реакций в молекулярной и ионной формах.
Опыт 2. Взаимодействие с основаниями.
В пробирку налейте 1-2 мл раствора гидроксида натрия и добавьте 2-3 капли раствора фенолфталеина. Добавьте 1-2 мл серной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Взаимодействие с солями.
В пробирку налейте 1-2 мл раствора хлорида бария и добавьте 1-2 мл серной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Контрольные вопросы:
1. С какими классами соединений взаимодействует серная кислота?
2. Напишите уравнения реакций, характерных для свойств соляной кислоты в молекулярной и ионной форме.
Лабораторная работа №7
Тема: Изучение свойств щелочей и нерастворимых оснований.
Цель работы: Закрепление знаний и навыков о химических свойствах оснований.
Задание: Изучить свойства щелочей и нерастворимых оснований.
Оборудование: Штатив с пробирками, спиртовка, спички, держатель.
Реактивы: гидроксид натрия, гидроксид бария, гидроксид цинка, гидроксид алюминия, соляная кислота, хлорид железа (III), фенолфталеин.
Методика выполнения:
Опыт №1. Взаимодействие с кислотами
В одну пробирку налейте 1-2 мл гидроксида натрия (или гидроксида бария), в другую 1-2 мл гидроксида цинка (или гидроксида алюминия). Добавьте р-ра фенолфталеина. В обе пробирки налейте по 1-2 мл соляной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Опыт №2. Взаимодействие с солями
В пробирку налить 1-2 мл хлорида железа (III), добавить 1-2 мл р-ра гидроксида натрия. Что наблюдаете?
Напишите уравнение реакций в молекулярной и ионной форме.
Опыт №3. Разложение нерастворимых оснований
В пробирку налить 1-2 мл гидроксида меди (II). Какого он цвета. Нагреть его осторожно. Что наблюдаете? Напишите уравнение реакций.
Контрольные вопросы:
1. Что называется основанием.
2. Что называется щёлочью. Привести примеры.
Лабораторная работа №8
«Изучение химических свойств солей: взаимодействие с металлами, друг с другом. Испытание солей индикаторами. Гидролиз солей различного типа»
Время выполнения - 90 минут
Цель:
-Проводить характерные реакции для солей.
-На основании « ряда напряжений» изучить отношение металлов к растворам солей
- Испытать действие растворов различных солей на лакмус и ф/ф;
-Написать уравнения реакции гидролиза солей, растворы которых имели кислую, щелочную или нейтральную среду.
Теоретическая часть
Соли- это сложные вещества, состоящие из атомов металлов и кислотных остатков. С точки зрения ТЭД – это электролиты, которые в водном растворе диссоциируют на катионы металла и анионы кислотных остатков: СuSO4→Cu2++SO4 2- FeCI3→Fe3++3CIСвойства солей Соли взаимодействуют с водой (хорошо растворимые с основаниями, кислотами, металлами, между собой). По отношению к воде соли подразделяются: на хорошо растворимые, нерастворимые и малорастворимые. Металлы по их активности можно расположить в ряд, получивший название «ряд напряжений металлов». В ряд напряжений вместе с металлами включен и водород. Металлы, стоящие в ряду напряжений до водорода, способны вытеснять водород из кислот. Каждый предыдущий металл ряда напряжений вытесняет все последующие из их солей. Ряд напряжений металлов: К,Na, Ca, Mg, AI, Zn, Cr, Fe, Pb, H, Cu, Hg, Ag, Au. Гидролиз солей При диссоциации воды образуется малое и одинаковое количество ионов Н+ и ОН- . Растворы, в которых концентрации ионов Н+ и ОН+ одинаковы, имеют нейтральную среду. Растворы, в которых преобладают ионы Н+ , имеют кислую среду, а в которых преобладают ионы ОН- - щелочную среду. Нейтральная среда у растворов солей, образованных сильной кислотой и сильным основанием. Например, NaCI,K2SO4. Универсальный индикатор не меняет окраски. Щелочная среда у растворов солей, образованных сильным основанием и слабой кислотой. Например, Na2CO3универсальный индикатор в растворе этой соли окрашивается в синий цвет. В растворе избыток гидроксо-ионов. Кислая среда у растворов солей, образованных слабым основанием и сильной кислотой. Например, раствор ZnCI2. Универсальный индикатор в растворе этой соли обмена между солями и водой относятся к реакциям гидролиза. 40 Со свойствами солей вы встретитесь, проделав данную лабораторную работу.
Порядок выполнения работы.
Оборудование и реактивы: Штатив с пробирками, гранула цинка, медь, растворы солей: СuSO4, ZnSO4, Na3PO4, AgNO3, BaCI2, Na2CO3, ZnCl2, AlCl3, красная и синяя лакмусовые бумажки, ф/ф. Справочные таблицы: Таблица растворимости кислот, оснований, солей «Ряд активности металлов».
Опыт №1. Взаимодействие солей с металлами. Поместить в пробирку 6 капель раствора сульфата меди. В пробирку опустить кусочек цинка. Что наблюдается при этом? Запишите наблюдения и ответьте на вопросы: 1) Какие изменения произошли на поверхности металла? Какое вещество выделилось из раствора медного купороса и что образовалось в растворе? 2) Написать уравнение реакции в молекулярном и ионном виде между сульфатом меди и цинком. 3) Пользуясь электрохимическим рядом напряжений объяснить эту реакцию.
Опыт №2 Взаимодействие солей друг с другом. а) К 1 мл раствора фосфата натрия (Na3PO4) прилить 1-2 капли азотнокислого серебра AgNO3. Что наблюдали? Записать наблюдения и ответить на вопросы: 1) Какое вещество выпало в осадок. Какого цвета осадок? 2) Написать уравнения реакций, назвать полученные вещества и сделать вывод. Отметить, что данные реакции являются качественными. 3) К какому типу реакций следует отнести данные реакции.
Опыт №3 Разложение гидрокарбоната натрия при нагревании. (Демонстрационный) Соберите прибор, как показано на рисунке. В пробирку поместите небольшое количество гидрокарбоната натрия NaHCO3 (четверть чайной ложки), закройте пробирку пробкой с газоотводной трубкой, опустите конец газоотводной трубки в стаканчик с известковой водой. Закрепите прибор в штативе и осторожно нагревайте. После окончания опыта выньте газоотводную трубку из пробирки с известковой водой и после этого прекратите нагревание.
Запишите наблюдения, зарисуйте прибор и ответьте на следующие вопросы:
1.Что наблюдается при нагревании, гидрокарбоната натрия? Что образовалось на стенках внутри пробирки, где находилась соль. Что произошло с известковой водой и о чем это свидетельствует? 2.Запишите реакцию, происходящую при нагревании гидрокарбоната натрия, зная, что белый порошок, получившийся в пробирке,- оксид натрия NaHCO3→ 3.К какому типу химических реакций надо отнести превращение, происходящее с данной солью при нагревании?
Опыт № 4. Гидролиз солей. 1. Отберите в пробирку 0,5 мл раствора испытуемой соли и опустите в раствор универсальный индикатор. 2. Укажите окраску индикатора в растворе соли. 3. Напишите уравнения реакций гидролиза солей, растворы которых имели кислую или щелочную среду. Уравнения реакций запишите в молекулярной и ионной формах.
Составление отчета.
1.Тема
2.Цель работы
3. Оборудование и реактивы
4. Оформить отчет в таблице.
Что делали Что наблюдали Уравнение реакций Выводы Опыт №1. Записать: Название опытов, их описание, наблюдения, составить уравнения в молекулярном и ионном виде. Отметить осадки (↓), выделение газа (↑). 1-й опыт –ОВР Сделать выводы по каждому опыту.
Общий вывод по работе (по цели).
Лабораторная работа №9
Тема: Гидролиз солей различного типа.
Цель работы: Изучение гидролиза солей различного типа.
Задание: Испытать индикатором растворы трёх солей и объяснить результаты наблюдений.
Оборудование: Штатив с пробирками, держатель.
Реактивы: растворы карбоната натрия, хлорида цинка, нитрата калия, индикаторные бумажки.
Методика выполнения.
Гидролизом называют реакции обменного взаимодействия вещества с водой, приводящие к их разложению.
В три пробирки прилейте по 1-2 мл растворов: в первую – карбоната натрия, во вторую – хлорида цинка, в третью – нитрата калия. Испытайте действие растворов на универсальную индикаторную бумажку. Что наблюдаете? Объясните результаты наблюдений и запишите уравнения реакций в молекулярной и ионной формах.
1. Na2CO3 + H2O NaHCO3 + NaOH Соль образована слабой кислотой и сильным основанием.
В ионном виде:
CO2-3 + H2O HCO3- + OH- (Среда щелочная) фенолфталеин малиновый.
2. ZnCl2 + H2O Zn OHCl + HCl соль образована сильной кислотой и слабым основанием
В ионном виде:
Zn2+ + H2O Zn OH+ + H+ (среда кислая) лакмус красный.
3. KNO3 + H2O KOH + HNO3 Соль образована сильным основанием и сильной кислотой
(среда нейтральная, гидролиза не происходит)
Контрольные вопросы:
1. Что такое гидролиз?
2. Почему в таблице растворимости в некоторых клеточках имеются прочерки (стр 150 – 11 кл)
Лабораторная работа №10
«Распознавание неорганических веществ»
Цель работы: закрепить знания об основных классах неорганических
соединений, научиться распознавать кислоты, соли и щелочи.
Оборудование и реактивы: штатив с пробирками, соляная кислота,
растворы гидроксида натрия, карбоната натрия, хлорида натрия, нитрата
серебра, сульфата натрия, хлорида бария, лакмуса, фенолфталеина.
1 Налейте в пробирку 2 мл раствора гидроксида натрия, добавьте
несколько капель фенолфталеина. Что наблюдаете? Сделайте вывод о
способе распознавания щелочей.
2 Налейте в пробирку 2 мл раствора соляной кислоты, добавьте несколько
капель лакмуса. Что наблюдаете? Сделайте вывод о способе
распознавания кислот.
Налейте в пробирку 2 мл раствора карбоната натрия и прилейте 2 мл
соляной кислоты. Что наблюдаете? Сделайте вывод о способе
распознавания карбонатов.
4 Налейте в пробирку 2 мл хлорида натрия и прилейте 2 мл раствора
нитрата серебра. Что наблюдаете? Сделайте вывод о способе
распознавания хлоридов.
5 Налейте в пробирку 2 мл раствора сульфата натрия и прилейте 2 мл
раствора хлорида бария. Что наблюдаете? Сделайте вывод о способе
распознавания сульфатов.
По итогам проведенных опытов заполните таблицу, сделайте вывод.
Образец выполнения работы
Что делали?
Что наблюдали?
Выводы
В пробирку с
Раствор приобрел
Щелочи можно распознавать по
гидроксидом натрия
малиновую окраску
изменению окраски индикатора
добавили
фенолфталеина
фенолфталеин
В пробирку с
Раствор приобрел
Кислоты можно распознавать по
соляной кислотой
розовую окраску
изменению окраски индикатора
добавили лакмус
лакмуса
В пробирку с
Выделение пузырьков газа
Карбонаты распознаются по
карбонатом натрия
выделяющемуся газу при добавлении
прилили соляную
более сильной кислоты
кислоту
Na2CO3 + 2HCl= NaCl + H2O+CO2↑
В пробирку с
Выпадение белого осадка
Хлориды распознаются по осадку,
хлоридом натрия
образующемуся при добавлении
прилили нитрат
нитрата серебра
серебра
NaCl + AgNO3 = NaNO3 + AgCl↓
В пробирку с
Выпадение белого осадка
Сульфаты распознаются по осадку,
сульфатом натрия
образующемуся при добавлении
прилили хлорид
хлорида бария
бария
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
Вывод: с помощью конкретных химических реакций научились
распознавать кислоты, щелочи и некоторые соли – хлориды, карбонаты и
сульфаты.
Распознавание растворов хлорида натрия, карбоната натрия и сульфата натрия
Определим, в какой из колб находятся растворы хлорида натрия NaCI, карбоната натрия Na2CO3 и сульфата натрия Na2SO4. Карбонат натрия можно обнаружить по карбонат-иону с помощью раствора соляной кислоты HCI. Карбонат натрия находится в той пробирке, где выделяется газ.
В какой из оставшихся двух пробирок хлорид натрия? Качественная реакция на хлорид-ион - реакция с нитратом серебра AgNO3. Белый осадок хлорида серебра выпадает в той пробирке, где находится хлорид натрия.
Аценат Натрия можно проверить с помощью FeCl3 (хлорида железа.) Раствор примет темно-красную окраску, за счёт появления ацетата железа(З).
Убедимся в том, что в оставшейся пробирке сульфат натрия. При добавлении хлорида бария выпадает белый осадок. Это сульфат бария.
Значит, в пробирке был действительно сульфат натрия.
Оборудование: колбы, пробирки, штатив для пробирок, пипетки.
Лабораторная работа № 11
«Изготовление моделей молекул некоторых органических веществ»
РАБОТА № 1
Цель: Развитие навыков пространственного изображения молекул кислорода, воды, углекислого газа ,метана, этана, этена, этина, бензола.
Задача: Закрепление знаний по теме Способы существования химических элементов «».
Оборудование: шаростержневые модели, транспортир. Учебное пособие Габриелян О.С. «Химия»
Теоретические основы
В предельных углеводородах (алканы) все углеродные атомы находятся в состоянии гибридизации sp3, и образуют одинарные σ – связи. Угол связи составляет 109,28о. Форма молекул правильный тетраэдр.
В молекулах алкенов углеродные атомы находятся в состоянии гибридизации sp2 , и образуют двойные связи σ и π – связи. Угол связи σ составляет 120о, а π – связь распологается перпендикулярно связи σ. Форма молекул правильный треугольник.
В молекулах алкинов углеродные атомы находятся в состоянии гибридизации sp , и образуют тройные связи одну σ и две π – связи. Угол связи σ составляет 180о, а две π – связи распологаются перпендикулярно друг друга. Форма молекул линейная (плоская).
В молекуле бензола C6H6 шесть атомов углерода связаны σ – связью. Угол связи составляет 120о. Состояние гибридизации sp2. В молекуле образуется
6 π – связь, которая принадлежит шести атомам углерода.
Для пространственного изображения молекул органических веществ важно знать, к какому классу веществ относится соединение, угол связи, форму молекул.
Например: Метан (СH4) относится к классу алканов. Атомы находятся в состоянии гибридизации sp3, значит угол связи 109,28о, форма молекулы тетраэдр, между атомами одинарная σ – связь. Для построения молекулы шаростержневым способом нужно заготовить 4 шара из пластилина. Один шар (атом углерода) большего размера и черного цвета, а три атома (водорода) одинакового размера красного цвета. Соединить шары металическими стержнями под углом 109,28о.
Полусферическая модель атома изготавливается также только шары соединяются методом вдавливания в друг друга.
Выполнение работы
1. Изготовление моделей молекул органических веществ СH4, C2H6,C2H4, C2H2, C6H6.
1.1.Изготовление шаростержневых моделей молекул.
Шаростержневые модели изготавливаются из пластилина и металлических стержней. При изготовлении молекул необходимо знать угол связи и ее кратность.
Атом химического элемента представляется в виде шара. Атом углерода в виде шара изготавливается большего размера, чем атомы водорода и из другого цвета пластилина. Химическая связь изображается металлическими стержнями. Угол химической связи измеряется траспортиром.
1.2.Изготовление полусферических моделей
Полусферические модели изготавливаются из пластилина. Сначала заготавливаются шары для атомов углерода и водорода, затем под определенным углом атомы в виде шаров соединяются друг с другом методом вдавливания. Получаются полусферы атомов.
1.3. Заполните таблицу. Зарисуйте молекулы органических веществ.
Название молекулы, структурная формула, тип связи, угол связи, тип гибридизации, пространственная форма молекулы.
Шаростержневая модель молекулы
Полусферическая модель молекулы
Контрольные вопросы
1. Какие бывают органические соединения по строению углеводородного скелета?
2. Какие бывают органические соединения по наличию функциональных групп?
3. Какие вещества называются гомологами?
4. Какие бывают пространственные формы молекул органических веществ?
5. Какой процесс называется гибридизацией?
7. Дайте понятие σ и π связи?
Лабораторная работа № 12
«Изготовление моделей молекул углеводородов»
Цель работы: изготовление и изучение пространственного строения молекул углеводородов.
Оборудование и реактивы: разноцветный пластилин, спички (палочки, металлические стержни).
Ход работы:
-
Изготовление модели молекулы метана
а) из белого пластилина изготовьте четыре небольших шарика, имитирующих атомы водорода.
б) сделайте еще один шарик черного цвета большего размера (имитация атома углерода)
в) на черном шарике наметьте четыре равноудаленных друг от друга небольших отверстия и вставьте в них спички, к свободным концам которых прикреплены маленькие белые шарики.
2. Изготовление модели молекулы этилена
а) из белого пластилина изготовьте четыре небольших шарика, имитирующих атомы водорода.
б) сделайте еще два шарика черного цвета большего размера (имитация атома углерода)
в) на каждом черном шарике проделайте три небольших углубления, равноудаленных друг от друга примерно на 1200.
г) прикрепите к черным шарикам «атомы водорода» и соедините черные шарики так, как показано на рисунке.
| ФОРМУЛА | СТРУКТУРА МОЛЕКУЛЫ | МОДЕЛЬ |
|
|
|
|
|
|
|
|
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа №13(1)
Тема: Ознакомление с коллекцией каучуков.
Цель работы: Научиться работать с коллекцией и делать её анализ.
Оборудование: Коллекция « Каучуки»
Методика выполнения:
Производство синтетических каучуков основано на реакции полимеризации:
Кат., t˚
n CH2 = CH – CH = CH2 (- CH2 – CH = CH – CH2 -) n
бутадиен 1,3 синтетический бутадиеновый каучук
Каучук – исходное сырьё для получения важнейшего в народном хозяйстве материала – резины.
(ластики, перчатки, плащи, сапоги, шланги, автомобильные покрышки и т.д.)
Рассмотрите предложенные образцы каучуков. Где они применяются? Какие из них получают в результате реакции полимеризации?
Контрольные вопросы:
1. К какому классу органических веществ относятся каучуки?
2. Кто впервые в промышленных масштабах в 1931г получил синтетический каучук?
Лабораторная работа №14(1)
Тема: Ознакомление с коллекцией нефтепродуктов.
Цель работы: Научиться работать с коллекцией и делать её анализ.
Задание: Рассмотреть выданную коллекцию и объяснить какие процессы лежат в основе получения образцов.
Оборудование: Коллекция « Нефть и продукты её переработки»
Методика выполнения:
1. Рассмотрите выданную вам коллекцию. Объясните, почему все нефтепродукты (кроме мазута) называют светлыми.
Запишите формулы углеводородов, образующих фракции светлых нефтепродуктов.
Какие физические процессы лежат в основе их получения?
2. Познакомьтесь со смазочными маслами, получаемыми перегонкой мазута. Какие процессы лежат в основе получения?
Для объяснения используйте материал § 8, стр 55 – 61, учебник 10 кл Химия.
Контрольные вопросы:
1. Назовите физические свойства нефти?
2. Где применяется бензин?
3. Что такое крекинг?
Лабораторная работа №13(2)
_Знакомство с образцами пластмасс и каучуков_
Цель работы:
___Познакомится с образцами пластмасс и каучуков и их применением.
Пояснения к работе
Полимеры – высокомолекулярные соединения, которые характеризуются молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров, называемые также макромолекулами, состоят из большого числа повторяющихся звеньев. Вследствие большой молекулярной массы макромолекул полимеры приобретают некоторые специфические свойства. Поэтому они выделены в особую группу химических соединений.
Получают полимеры из мономеров путем синтеза методами полимеризации или полконденсации. Отдельную группу также составляют олигомеры, которые по значению молекулярной массы
занимают промежуточное положение между низко молярными (мономерами) и высоко молярными соединениями.
Различают неорганические, органические и элементоорганические полимеры.Органические полимеры, в свою очередь, подразделяют на природные(натуральные каучук, шелк, шерсть, хлопок и т.д.), искусственные (получают путем химической обработки природных полимеров) и синтетические(синтетические полимеры, каучуки, волокна и т.д.). В настоящей теме рассматриваются в основном органические синтетические полимеры.
Рассмотрим получение полимеров методом полимеризации(полиприсоединение) - это реакция образования полимеров
путем последовательного присоединения молекул низкомолекуляр-
ного вещества (мономера). Большой вклад в изучении процессов полимеризации внесли отечественные ученые С.В.Лебедев,
С.С.Медведев и др. и зарубежные исследователи Г.Штаудингер, Г.Марк, К.Циглер и др. При полимеризации не образуются побочные продукты и соответственно элементный состав макромолекул не отличается от состава молекул мономеров. В качестве мономеров
используются соединения с кратными связями: C=C, C=N, C=C, C=O, С=С=О, С=С=С, C=N, либо соединения с циклическими группами, способными раскрываться.
В процессе полимеризации происходит разрыв кратных связей или раскрытие циклов у мономеров и возникновение химических
связей между группами с образованием макромолекул, например:
nCH2 = CH2 _(- CH2 – CH2 - )n nCH2 = CH _ ( - CH2 – CH - )n
этилен полиэтилен
nCH = CH _ (- CH = CH - ) C6H5 C6H5
ацетилен полиацетилен стирол полистирол
nH2C = CH-CH = CH2 _ (- CH2 – CH = CH – CH2 - )n
бутадиен полибутадиен (бутадиеновый каучук)
По числу видов участвующих мономеров различают гомополимеризацию (один вид мономера) и с полимеризацию (два и
более видов мономеров).
Полимеризация — самопроизвольный экзотермический процесс (DG
-
Натуральный каучук – аморфное, способное кристаллизоваться твердое тело. Природный необработанный каучук – белый или бесцветный углеводород. Он не набухает и не растворяется в воде, спирте, ацетоне и ряде других жидкостей.
Каучук природный и синтетический. Резина.
Каучуками - называют высокомолекулярные материалы, проявляющие при нормальных условиях высокоэластичные и отчасти пластические свойства.
Каучук имеет огромное нороднохозяйственное значение.
Различают 2 вида каучуков: натуральный и синтетические.
Натуральный каучук – упругая масса, получаемая из млечного сока каучуконосных растений (гевеи). По химическому строению натуральный каучук является полимером изопрена (С5Н8)n, имеет цис-строение:
…– CH2 CH2 - CH2 CH2 –…
\ / \ /
nCH2 = С – CH = CH2 C = С C = С
| / \ / \
CH3 CH3 H CH3 Н
n - 2000÷500, молекулярная масса 300 000 ÷ 350 000.
1 2 3 4
1 2 3 4
Натуральный каучук имеет стереорегулярное строение: звенья изопрена в молекуле каучука всегда соединены однотипно за счет 1-го и 4-го атомов углерода.
…CH2 – С = CH – CH2 - CH2 – С = CH – CH2 - …
| |
CH3 CH3
Натуральный каучук высокой реакционной способностью, легко взаимодействует с серой, окисляется, хорошо растворяется в бензоле, бензине; обладает высокой прочностью при растяжении, морозостойкостью, хорошей эластичностью и износостойкость. Но он не достаточно пластичен и в случае длительного хранения при температуре 100С и ниже кристаллизуется, вязкость его повышается.
Применяется для изготовления технических изделий, резиновых изделий, резинового клея, эбонита.
Синтетические каучуки
Бутадиеновый (дивинильный).
Вспоминаем получение. В 1932 на основе работ академика С.В. Лебедева в нашей стране осуществили промышленное производство (катализатор – Naметаллический).
nCH2= СH – CH = CH2 → ….- CH2 – СH = CH – CH2 - CH2 – CH = CH - …
Строение бутадиенового каучука, получаемого этим методом, было нерегулярное, так как присоединение звеньев происходило не только в положении 1-4 и в положении 1-2.
1 2 3 4
1 2 3 4
….- CH2 – СH = CH – CH2 - CH2 – CH = CH– CH2 - …
1 2 1 2
…CH2 – CH – CH2 - CH –…
| |
CH CH
| | | |
CH2 CH2
Синтетический каучук бутадиеновый благодаря наличию двойных связей в боковой цепи присоединяет серу быстрее, чем натуральный каучук, а потому вулканизация протекает быстрее.
Применяется для изготовления прокладок к машинам и аппаратам в пищевой промышленности и медицине. В смеси с другими каучуками в производстве шин.
Изопреновый каучук (СКИ-3) имеет то же строение, что и природный, обладает рядом преимуществ (хорошая водостойкость, высокие диэлектрические показатели).
Полихлоропреновый каучук (С4Н5Сl)n
nCH2= С – CH = CH2 ….- CH2 – С = CH – CH2 - CH2 – С – CH = CH2 -
| | |
Cl Cl Cl
Хлоропрен полихлоропрен
Молекулярная масса 150000 ÷ 300000
Хлор придает стойкость к действию химических реактивов, света, тепла. Практически не горит, обладает хорошей клеящей способностью, используется в производстве различных марок клея.
Бутадиенстирольный каучук (СКС) получают путем сополимеризации бутадиен 1,3 и стирола.
nCH2= СH–CH = CH2 + m CH2=СH …CH2=СH –CH–CH2-CH2–CH–
| |
C6H5 C6H5
Бутадиен стирол
Применяется в производстве легковых шин, обуви, а с небольшим содержанием стирола для малостойких изделий.
Резина – высокоэластичное, прочное соединение, но менее пластичное, чем каучук.
Состоит из полимерной основы (каучука) и различных добавок.
Вулканизация – переработка каучуков в резину. Вулканизирующим агентом чаще всего бывает сера. За счет этих агентов при вулканизации происходит «сшивание» макромолекул каучука поперечными связями и образуется пространственная вулканизация
трехмерная сетка:
CH3 - S CH3
| | |
(- CH2= СH – C – CH2–)n + …-CH2= СH – C– CH2- …
|
S
|
S
|
…- CH2= СH – C – CH2- …
|
CH3
Задание
Задание. Рассмотрите образцы веществ. Заполните таблицу.
Необходимые принадлежности
(инструменты, стенды, приборы и т.п.)
Вещества: коллекция с образцами каучуков, кусочки резины. Образцы пластмасс (полиэтилен, полихлорвинил, ,полистирол).
Работа в лаборатории
Например:
-
Ознакомиться с различными образцами пластмасс;
-
Результаты занести в таблицу №1
№п/п
Наименование пластмасс
Характер горения.
Отношение к горению.
Реакция на продукт распада.
1Полиэтилен.
2Полихлорвинил
3Полистирол
Лабораторная работа №14(2)
«Ознакомление с продуктами нефти, угля»
Цель работы: На основе коллекционного материала ознакомиться c образцами нефти, угля и продуктами их переработки, каучуками и образцами изделий из резины.
| Оборудование И реактивы | Теоретические основы | Практические основы | |||||||||||||
| Коллекции: «Нефть и продукты ее переработки», «Каучуки и образцы изделий из резины», «Уголь и продукты его переработки». Учебное пособие Габриелян О.С. «Химия» | Природными источниками различных углеводородов являются нефть, уголь, природный газ. Все перечисленное является источником получения энергии, а так же важнейшим химическим сырьем. Нефть – это жидкий, горючий маслообразный минерал, имеющий окраску от светло-желтой до темно-коричневой, легче воды и практически в ней нерастворима. Нефть состоит из алканов, циклоалканов и ароматических углеводородов. Уголь содержит 65 – 90% углерода. Уголь черного цвета твердое вещество отличается большой плотностью и блеском. Каучуки – эластичные материалы, из которых путем специальной обработки получают резину. Сырой каучук липок, непрочен, а при небольшом понижении температуры становится хрупким. Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации – вводят в него серу и нагревают. Вулканизированный каучук называется резиной. Натуральный каучук (НК) представляет высокомолекулярное соединение - полимер формула которого ( - СН2 – С = СН – СН2 -)n / CH3 Синтетические каучуки (СК) производят разного вида. СКБ – продукт совместной полимеризации бутадиена с другими непредельнми углеводородами. Формула СК ( - СН2 – СН = СН – СН2 - )n
| 1. Ознакомление с коллекцией «Нефть и продукты ее переработки».
Рассмотрите коллекцию. Запишите образцы нефти и их отличие по составу. Запишите продукты переработки нефти и их применение.
2. Ознакомление с коллекцией «Каучуки и образцы изделий из резины».
Рассмотрите коллекцию. Запишите образцы каучуков и их отличие по составу. Запишите образцы изделий из резины и их применение.
3. Ознакомление с коллекцией «Уголь и продукты его переработки». Рассмотрите коллекцию. Запишите образцы угля и их отличие по составу. Запишите продукты переработки угля и их применение.
Данные наблюдений занесите в таблицу.
Контрольные вопросы
1. Какие углеводороды входят в состав нефти? 2. Какие существуют методы переработки нефти? 3. Перечислите фракции перегонки нефти? 4. К каким органическим соединениям относятся каучуки? 5. Какие бывают синтетические каучуки? 6. На какие группы делятся каучуки по их назначению?
Сформулируйте вывод по работе.
| |||||||||||||
Лабораторная работа №15
«Растворение глицерина в воде и реакция его с гидроксидом меди(II)»
Выполнение опыта: 1. В пробирку налили по 2 мл воды и глицерина. Смесь перемешали и после растворения глицерина прилили его еще 2 мл. Смесь опять перемешали.
Вывод: Глицерин смешивается с водой в любых пропорциях.
2. В пробирку налили 2 мл раствора NaOH и добавили раствор сульфата меди(II). Наблюдаем выпадение голубого осадка Cu(OH)2.
CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4
Cu2+ + SO42– + 2Na+ + 2OH– → Cu(OH)2↓ + 2Na+ + SO42–Cu2+ + 2OH– → Cu(OH)2↓
К свежеприготовленному гидроксиду меди(II) прилили немного раствора глицерина. Наблюдаем растворение осадка и ярко-синееокрашивание раствора — качественная реакция на многоатомные спирты.
| CH2—OH |
|
| H |
| |
|
|
| CH2—O | O—CH2 | ||
|
|
|
|
| ||
|
|
|
|
| Cu |
|
| 2CH—OH+ Cu(OH)2 |
|
| |||
|
|
| CH—O | O—CH+ 2H2O | ||
|
| |||||
|
|
|
|
| H |
|
|
|
|
|
| ||
| CH2—OH |
|
| CH2—OH | HO—CH2 | |
|
|
|
|
| ||
3.В каждую из пробирок добавили свежеприготовленный Cu(OH)2.
Впробирке с раствором глицерина наблюдаетсяярко-синееокрашивание раствора.
Лабораторная работа №17
«Качественные реакции на альдегиды»
Цель: Изучить реакции окисления, характерные для альдегидов,
научиться проводить качественные реакции на альдегиды;
закрепить навыки работы с лабораторным оборудованием;
развивать аккуратность через оформление навыков, наблюдательность,
Оборудование: нитрат серебра, сульфат меди (II), гидроксид натрия, раствор формалина, аммиачная вода, прибор для нагревания, пробирки.
Правила техники безопасности:
-
Соблюдать правила пожарной безопасности при работе с сухим горючим.
-
Не пробовать реактивы на вкус.
-
Выполнять только опыты, предусмотренные работой.
-
При попадании реактивов на кожные покровы смыть большим количеством воды.
Ход работы
Опыт №1 Реакция серебряного зеркала
Поместить в пробирку 1 каплю 0,2н раствора нитрата серебра, прибавить 3-4 капли раствора аммиака до растворения образующегося осадка. Затем прибавить 1 каплю формалина (40% раствор метаналя) и слегка нагреть до образования черного осадка свободного серебра или зеркального налета на стенках пробирки.
2Ag NO3 + 2 NH4OH→ Ag2O+2NH4NO3+H2O
Напишите уравнение реакции «серебряного зеркала». Реакция серебряного зеркала является качественной реакцией на альдегиды.
Опыт №2 Окисление метаналя гидроксидом меди (II)
В пробирку поместить 1 каплю формалина, 6 капель 2н раствлра гидроксида натрия, 1 каплю 2н раствора сульфата меди(II).Полученный раствор нагрейте до кипения. В результате реакции выпадает осадок меди (I) кирпично-красного цвета.
CuSO4+2NaOH → Cu (OH)2+Na2SO4
-
Напишите уравнения реакций, протекающих при нагревании, помня, что образующийся в конце реакции осадок имеет состав
Cu(OH)2 →CuO →CuOH→ Cu2O.
2. Составьте уравнение реакции взаимодействия ацетальдегида с гидроксидом меди (II).
3. Что общего у данного опыта с реакцией серебряного зеркала? Реакция с гидроксидом меди (II) является качественной реакцией
Сделайте общий вывод о проделанной работе.
Лабораторная работа № 17(а)
Тема: Изучение восстановительных свойств альдегидов
Цели:
-
научиться проводить реакцию окисления спирта в альдегид с помощью оксида меди при нагревании;
-
научиться проводить качественную реакцию на альдегид гидрооксидом меди;
-
соблюдать правила техники безопасности;
-
экономно расходовать реактивы.
-
уметь применять знания, полученные на теоретических занятиях;
Реактивы и оборудование:
-
раствор формалина (метаналя) или этаналя.
-
аммиачный раствор оксида серебра (1)
-
CuSO4 (медный купорос),
-
NaOH (едкий натр)
-
раствор метилового или этилового спирта.
-
медная проволока
-
горелки
-
держалки,
-
сухое горючие,
-
штативы,
-
пробирки.
Ход работы
Приготовление аммиачного раствора оксида серебра (1):
К 2-процентному раствору нитрата серебра AgNO3 прилить раствор аммиака (25-процентный раствор, разбавленный дистиллированной водой в 10 раз) до растворения образующегося вначале осадка.
Опыт № 1. Получение альдегида
-
На конце медной проволоки сделайте 5-6 витков спирали.
-
Налейте в пробирку несколько капель метилового или этиленового спирта, накалите медную спираль в пламени горелки, чтобы медь покрылась черным налетом оксида меди (11), и быстро опустить спираль в пробирку со спиртом. Повторите эту операцию несколько раз. Обратите внимание на запах образующегося альдегида и на изменения, происходящие со спиралью.
-
Составьте уравнение реакции окисления спирта в альдлегид оксидом меди (11).
Тщательно вымойте пробирку раствором соды, а затем чистой водой. Налейте в нее 1-2 мл аммиачного раствора оксида серебра (1) и добавьте по стенке 4-5 капель формалина. После этого поместите пробирку в заранее приготовленный стакан с горячей водой. На стенках пробирке должен образоваться осадок металлического серебра.
Составьте уравнение реакции.
Опыт № 3 Качественная реакция на альдегид. (Реакция окисления с гидроксидом меди)
В пробирку к 3-4 каплям раствора медного купороса (CuSO4) прибавьте 2-3 мл раствора едкого натра (NaOH). К образовавшемуся осадку прилейте 2-3 мл формалина и смесь нагрейте.
Как изменится цвет осадка?
Составьте уравнение реакций взаимодействия сульфата меди со щелочью и образовавшегося при этом вещества с формальдегидом.
Назовите вещества.
Контрольные вопросы
-
Какие соединения относятся к альдегидом? Напишите общую форму альдегидов.
-
Основываясь на строении функциональной группы, поясните, почему для альдегидов характерны реакции присоединения.
-
Согласно схеме, используя материал о генетических связях, составьте уравнения соответствующих химических реакций.
-
При окислении этаналя выделилось 2,7 г серебра. Вычислите, сколько ацетилена (по объему и по массе) потребовалось для получения необходимой массы этаналя.
Лабораторная работа №19
Тема: Обнаружение белков в молоке и мясном бульоне. Растворение и денатурация белков.
Цель работы: Изучение свойств белков.
Задание: Проделать реакции, характеризующие свойства белков и качественную реакцию.
Оборудование: Молоко, мясной бульон, раствор щёлочи (гидроксида натрия или калия), медный купорос (сульфат меди (II), азотная кислота, нашатырный спирт, шерстяные нити).
Методика проведения:
Свойства белков.
1. Биуретовая реакция (фиолетовое окрашивание)
В пробирку налейте 2 мл раствора белка и добавьте 2 мл раствора щёлочи, а затем несколько капель раствора медного купороса (сульфата меди (II)). Что наблюдаете?
2. Ксантопротеиновая реакция (вначале белый осадок, затем желтеет)
В пробирку с 2 мл раствора белка добавьте несколько камель азотной кислоты. Что наблюдаете? Нагрейте содержимое пробирки. Что наблюдаете? Охладите смесь и добавьте к ней по каплям 2-3 мл нашатырного спирта. Что наблюдаете?
3. Определение по запаху серы в белках.
Подожгите несколько шерстяных нитей. Охарактеризуйте запах горящей шерсти.
4. К 3-4 мл раствора белка в воде добавьте несколько капель раствора медного купороса (сульфата меди (II)). Что наблюдаете?
5. Смотрите стр 128-132, Химия 10 класс
Контрольные вопросы:
1. Какие две качественные реакции дают белки.
2. Назовите 6 функций белков.
Лабораторная работа №20
«Обнаружение аспирина в готовой лекарственной форме»
Цели: провести анализ лекарственных препаратов, производных салициловой кислоты; закрепить знания учащихся о качественных реакциях органических соединений и правилах обращения с веществами в повседневной жизни; отработать навыки экспериментального определения органических веществ; способствовать овладению доступными для учащихся научными методами исследования; формировать умения сравнивать строение лекарственных веществ и известных им соединений (фенолы, карбоновые кислоты), выявлять структурную схожесть определенных фрагментов их молекул, и делать выводы о том, что близкие по строению вещества проявляют сходные химические свойства; развивать у учащихся логическое мышление и творческий подход к решению поставленной задачи.
Оборудование: ацетилсалициловая кислота разных производителей, стакан с водой, растворы этилового спирта, гидроксида натрия (или калия), хлорида железа (III), спиртовка, держатель, спички, пробки для пробирок, пипетки.
«Все есть яд, ничто не лишено ядовитости,
И все есть лекарство,
Лишь только доза
Делает вещество ядом или лекарством».
Парацельс
В повседневной жизни человек применяет огромное количество веществ. К сожалению, некоторые из них - не по назначению. Чаще всего в эту категорию веществ попадают лекарственные препараты.
-
Антисептические (греч. anti –отрицание, septikos гниение)– средства, обладающие противомикробным действием и применяются для дезинфекции, смазывания кожи и слизистых оболочек, орошения ран и полостей. К ним относятся: борная кислота, раствор йода, бриллиантовый зеленый, фурацилин, ляпис – AgNO3, протаргол – ZnSO4, перманганат калия, перекись водорода и другие.
-
Антибиотики (греч. anti –отрицание, и bios - жизнь) – органические вещества, образуемые микроорганизмами и обладающие способностью убивать микробов. К ним относятся: пенициллины, стрептомицин, нистатин, тетрациклин, левомицетин, эритромицин, олететрин и ряд других.
-
Анестезирующие (an – отрицание, aisthesis – чувство, ощущение) –вещества, временно блокируют нервные окончания. К ним относятся новокаин, дикаин, лидокоин и другие.
-
Анальгетики (греч. analges - обезболенный) – лекарственные препараты, устраняющие болевые ощущения, путем непосредственного воздействия на ЦНС. Ацетилсалициловая кислота и её производные, амидопирин, анальгин, парацетамол, фенацетин и другие.
Итак, аспирин. Выпуск его налажен с 1899 года как анальгетика с противовоспалительным и жаропонижающим действием.
Зная качественные реакции на функциональные группы и состав молекулы какие вещества можно использовать для определения наличия этих функциональных групп?
На фенольную группу – хлорид железа (III), на карбоксильную группу – индикатор, гидроксид натрия.
Инструктаж по выполнению работы.
На первом этапе вы определяете растворимость аспирина при разных условиях (при обычной температуре и нагревании, используя различные растворители: вода, щелочь, этиловый спирт). На этом этапе доказываете состав вещества и наличие карбоксильной группы.
На втором этапе вы определяете наличие фенольного производного, действуя на образец раствором хлорид железа (III). (учащиеся могут пользоваться методическими рекомендациями учебника на стр. 297-299).
На последнем этапе делаете вывод о соответствии состава препарата с табличными данными.
Инструктаж по технике безопасности.
-
Работа с едкими веществами - щелочами;
-
Работа со спиртовкой;
-
Правила нагревании.
Выполнение работы.
Выдаются образцы аспирина, оформляют результаты опытов.
Методика выполнения работы.
-
Растворимость ацетилсалициловой кислоты.
Разотрите в ступке таблетку выданного образца лекарственного препарата. Перенесите в пробирки по 0,1г лекарства (примерно одна пятая часть таблетки).
а) добавьте в пробирку с образцом аспирина 2 мл воды. Отметьте
растворимость его в холодной воде.
б) нагрейте пробирку с аспирином над пламенем спиртовки. Что
наблюдаете? Составьте уравнение гидролиза ацетил-
салициловой кислоты.
в) в пробирку с образцом аспирина добавьте 2 мл этанола –
С2Н5ОН. Что наблюдаете? Сравните растворимость препарата в
воде и спирте. Составьте уравнение реакции и сделайте вывод.
г) в пробирку с образцом аспирина добавьте 2 мл щелочи – КОН
(или NaOH). Закрыли пробкой и встряхнули. Изменилась ли
растворимость? Составьте уравнение реакции.
-
Определение наличия фенольного соединения.
В пробирку с аспирином добавьте 2 мл воды, 2 капли раствора хлорида железа (III) и нагрейте. Что наблюдаете? Составьте уравнение реакции и сделайте вывод.
Предварительный итог.
Учащиеся делают вывод о соответствии состава исследуемого препарата с табличными данными. Учитель анализирует практическую деятельность учащихся на уроке.
Вопросы:
1. Аспирин используется человеком не только как лекарственный препарат. Многие хозяйки применяют его как консервирующие добавки.
- На чем основано консервирующее действие аспирина?
( В растворе создается кислотная среда, препятствующая размножению бактерий.
В процессе гидролиза аспирина образуется фенольное соединение, которое обладает бактерицидными свойствами).
2. Какое действие на организм человека оказывает салициловая кислота – продукт гидролиза ацетилсалициловой кислоты? (В процессе гидролиза аспирина образуется фенольное соединение, которое оказывает токсическое действие на организм человека, т.к. все соединения фенола достаточно ядовиты).
3.Какими должны быть условия хранения ацетилсалициловой кислоты? (Аспирин нужно хранить в прохладном, темном месте, где нет следов щелочной среды, паров спирта)
Домашнее задание.
Повторить § 32, выполнить задание с карточки.
Дополнительная информация.
Салициловая кислота (орто-гидроксибензойная кислота – С6Н4(ОН)СООН) - бесцветные кристаллы, температура плавления-1590С. применяется в производстве красителей, лекарств и душистых веществ, в пищевой промышленности(консервирование), медицине (как наружное средство антисептического, раздражающего действия), как аналитический реагент.
О Н
СООН
Ацетилсалициловая кислота (аспирин) – сложный эфир салициловой кислоты по фенольному гидроксилу. В состав молекулы входят карбоксильная группа –СООН, и радикал ацетил –СОСН3 (одновалентный остаток уксусной кислоты). Обладает обезболивающим, противовоспалительным и жаропонижающим действием.
О СОСН3
СООН
Лекарственные формы – удобные для применения и рациональные для лечебного эффекта формы, придаваемые лекарствам. Различают лекарственные формы:
-
жидкие (растворы, настои, отвары и др.);
-
мягкие (мази, пасты);
-
твердые (порошки, таблетки);
-
газообразные (аэрозоли).
Карточка №1.
Зная состав лекарственного препарата парацетамола предположите, с помощью какого реактива можно доказать наличие функциональной группы, содержащейся в его молекуле.
О =С NHCH3
OH
Карточка №2
Зная состав лекарственного препарата тетрациклина предположите, с помощью какого реактива можно доказать наличие функциональной группы,
содержащейся в его молекуле.
Карточка №3
Зная состав лекарственного препарата левомицетина предположите, с помощью какого реактива можно доказать наличие функциональной группы, содержащейся в его молекуле.
Приложения.
-
Исследование растворимости ацетилсалициловой кислоты и обнаружение карбоксильной группы.
Разотрите в ступке таблетку выданного образца лекарственного препарата. Перенесите в пробирки по 0,1г лекарства (примерно одна пятая часть таблетки).
а) добавьте в пробирку с образцом аспирина 2 мл воды. Отметьте растворимость его в холодной воде.
б) нагрейте пробирку с аспирином над пламенем спиртовки. Что наблюдаете? Составьте уравнение гидролиза ацетилсалициловой кислоты.
в) в пробирку с образцом аспирина добавьте 2 мл этанола – С2Н5ОН. Что наблюдаете? Сравните растворимость препарата в воде и спирте. Составьте уравнение реакции и сделайте вывод.
г) в пробирку с образцом аспирина добавьте 2 мл щелочи – КОН (или NaOH). Закрыли пробкой и встряхнули. Изменилась ли растворимость? Составьте уравнение реакции.
-
Определение наличия фенольного соединения.
В пробирку с аспирином добавьте 2 мл воды, 2 капли раствора хлорида железа (III) и нагрейте. Что наблюдаете? Составьте уравнение реакции и сделайте вывод
Выводы. Уравнения реакций.
Анализ лекарственных препаратов, производных салициловой кислоты.
Ацетилсалициловая кислота (аспирин)
ОСОСН3 СООН
Производитель –
……………
Форма лекарственного препарата –
…………
1. а) добавили в пробирку с образцом аспирина 2 мл воды
б) нагрели пробирку с аспирином над пламенем спиртовки
в) в пробирку с образцом аспирина добавили 2 мл этанола – С2Н5ОН.
г) в пробирку с образцом аспирина добавил 2 мл щелочи – КОН. Закрыли пробкой и встряхнули.
д) в пробирку с аспирином добавили 2 мл воды, 2 капли раствора хлорида железа (III) и нагрели
……………………
Лабораторная работа № 21
«Знакомство с образцами полисахаридов»
Цель работы: Исследовать химические свойства углеводов и объяснить причины, обуславливающие эти свойства.
Оборудование и реактивы: металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; 1 % раствор глюкозы, 1 % растворы сахарозы, лактозы, фруктозы; крахмал, спиртовой раствор иода, раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5), аммиачный раствор оксида серебра (I). ступка и пестик (1 шт.), пипетка (1 шт.), фарфоровая чашка (1 шт.), шпатель (1 шт.), лопаточка (1 шт.), крахмал, раствор йода (3%), мёд, белый хлеб, горох (рис), колбаса, маргарин, макаронные изделия.
Правила техники безопасности









Теоретические сведения
Крахмал интенсивно накапливается в результате фотосинтеза и откладывается в семенах, клубнях и других частях растений. Семена и клубни содержат 40—70% крахмала, другие части растений — от 4 до 25%.
Многие продукты содержат углеводы. Существует несколько источников крахмала. Наиболее известны пшеница, кукуруза, картофель, рис. Исследуем наличие продуктов на крахмал. Кусочек белого хлеба можно превратить в черный, но только есть его уже нельзя.
Крахмал можно обнаружить на свежем срезе картофелины, в муке. Эту реакцию использовали, чтобы уличить недобросовестных торговцев, добавляющих в сметану «для густоты» пшеничной муки. Если на образец такой сметаны капнуть йодной настойкой, синее окрашивание сразу выявит фальсификацию.
Молекула крахмала очень большая. Она похожа на длинную цепь со многими ответвлениями наружу. В этой молекуле задерживается йод, из-за чего крахмал окрашивается в яркий синий цвет.
Ход работы
ОПЫТ 1. Свойства глюкозы.
Внесите в пробирку 3 капли раствора глюкозы, одну каплю раствора соли меди и прибавьте при взбалтывании несколько капель гидроксида натрия до образования светло-синего раствора (щелочь должна быть в избытке). Что доказывает появление такой окраски раствора? Вспомните реакцию образования глицерата меди.
Полученный раствор нагрейте. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
Задания:
1. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при комнатной температуре. Укажите наблюдения. На наличие каких функциональных групп указывает эта реакция?
2. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при нагревании. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
ОПЫТ 2. Взаимодействие сахаров с гидроксидом меди (II).
Опыт проводят одновременно с растворами различных сахаров.
К 2 мл раствора сахара добавьте 1 мл разбавленного раствора щелочи и 34 капли раствора сульфата меди (II). Встряхните пробирку и перемешайте содержимое пробирки стеклянной палочкой до растворения осадка. Жидкость при этом окрашивается в интенсивно-синий цвет.
Затем поместите все пробирки в нагретую водяную баню. Если сахар окисляется, то, вынув пробирку через 2-3 минуты, вы увидите изменения окраски и появление красного или коричневого осадка.
Задание: Заполните следующие таблицы:
Результаты опыта, проведенного при нормальных условиях
Углевод
Что наблюдается?
Как объясняется?
Результаты опыта, проведенного при нагревании
Углевод
Что наблюдается?
Как объясняется?
ОПЫТ 3. Взаимодействие сахаров с аммиачным раствором оксида серебра (I).
Опыт проводят одновременно с растворами различных сахаров.
Налейте в тщательно вымытые и высушенные пробирки по 1 мл аммиачного раствора оксида серебра (I) и по 1 мл раствора сахара. Пробирки поместите на несколько минут в горячую водяную баню.
Задание: Заполните следующую таблицу:
Результаты опыта, проведенного при нагревании
Углевод
Что наблюдается?
Как объясняется?
Запишите уравнение соответствующей реакции для глюкозы.
ОПЫТ 4. Гидролиз сахарозы.
В пробирку с 5 каплями раствора сахарозы добавьте 1 каплю разбавленного раствора серной кислоты (1:5) и смесь нагрейте на пламени спиртовки. После этого прибавьте 1 каплю раствора сульфата меди (II) и избыток раствора гидроксида натрия. Зачем нужно добавлять именно избыток щелочи? Что наблюдается? Что произошло с сахарозой?
Задания: 1. Ответьте на вопросы, поставленные в тексте опыта.
2. Составьте уравнение реакции гидролиза сахарозы.
3. Опишите все наблюдаемые явления.
4. Напишите все уравнения протекающих реакций.
ОПЫТ 5. Отношение крахмала к воде.
В пробирку с 1 мл воды поместите на кончике шпателя сухого крахмала. Содержимое пробирки взболтайте. Растворяется ли крахмал в воде при комнатной температуре?
Содержимое пробирки порциями залейте при перемешивании в стакан с 5 мл горячей воды. При этом образуется крахмальный клейстер.
Задание: Отметьте наблюдения, происходящие в данном опыте. Сделайте вывод о растворимости крахмала в холодной и горячей воде.
ОПЫТ 6. Взаимодействие крахмала с иодом.
В пробирку внесите 5-6 капель крахмального клейстера и одну каплю спиртового раствора иода. Что при этом наблюдается?
Задание: Отметьте наблюдения, происходящие в данном опыте. Объясните происходящие явления.
ОПЫТ 7. Отношение крахмала к гидроксидам металлов.
В пробирку внесите 5 капель крахмального клейстера, одну каплю сульфата меди (II) и 5 капель раствора гидроксида натрия. Смесь нагрейте на пламени спиртовки, не доводя до кипения. Что при этом наблюдается?
Задания: 1. Отметьте наблюдаемые явления, происходящие в этом опыте.
2. Какой можно сделать при этом вывод?
3. Происходит ли окисление крахмала гидроксидом меди (II)?
ОПЫТ 8. Кислотный гидролиз крахмала.
Налейте в химический стакан 3-5 мл крахмального клейстера и 0,5-1 мл раствора серной кислоты. Стакан поставьте на электроплитку и кипятите 4-5 минут. Следите за тем, чтобы не произошло обугливание. Для определения, прошел ли гидролиз, отберите пипеткой 3-4 капли раствора (гидролизата) в пробирку и прибавьте каплю раствора иода. Если получился раствор желтоватого цвета, гидролиз крахмала закончен.
Теперь необходимо определить конечный продукт гидролиза – глюкозу.
В пробирку внесите 5 капель гидролизата, 2 капли раствора сульфата меди (II) и несколько капель раствора щелочи до появления синей окраски раствора. Смесь слегка нагрейте на пламени спиртовки. Что наблюдается?
Задания: 1. Отметьте наблюдаемые явления, происходящие в этом опыте.
2. Напишите схему гидролиза крахмала.
3. Объясните все происходящие явления.
4. Напишите уравнение реакции качественного определения глюкозы.
ОПЫТ 9. Ферментативный гидролиз крахмала.
Под действием фермента слюны амилазы (птиамина) происходит гидролиз крахмала.
Разжуйте хорошо маленький кусочек черного хлеба и поместите его в пробирку. Внесите в нее 1 каплю раствора сульфата меди (II) и несколько капель раствора гидроксида натрия до образования раствора слабо-голубого цвета. Пробирку с содержимым нагрейте на пламени спиртовки. Что наблюдается?
Задания: 1. Опишите наблюдения, происходящие в опыте.
2. Запишите уравнения протекающих реакций.
3. Сравните условия ферментативного и кислотного гидролиза крахмала.
ОПЫТ 10. Качественная реакция на крахмал (иодная проба).
-
К 1-1,5 мл раствора крахмала добавьте 1 каплю иодной воды. Что наблюдается? Полученную жидкость нагрейте на пламени спиртовки. Какие происходят изменения? Затем охладите содержимое пробирки под струей холодной воды. Что наблюдается?
Задание: Запишите все происходящие наблюдения. Оформите наблюдения в виде схемы.
-
Разотрите мёд. Накапайте на него раствор йода. Наблюдайте за изменением цвета.
-
Накапайте на крахмал раствор йода. Наблюдайте за изменением цвета.
-
Возьмите маленький кусочек белого хлеба и накапайте на него раствор йода. Что Вы наблюдаете?
-
Разотрите горох (зерна риса). Добавьте немного воды и перемешайте. Накапайте йод. Что Вы наблюдаете?
-
Возьмите ложку йогурта, поместите в фарфоровую чашу прилейте 1-2 мл. раствора йода. Наблюдайте за изменением цвета.
-
Нанесите на свежий разрез маргарина каплю раствора йода. При наличии крахмала поверхность маргарина на разрезе окрашивается в синий цвет.
-
На свежеприготовленные отварные макаронины капните раствором йода. Наблюдайте за изменением цвета
Заполните таблицу
Вещество
Реакция с йодом
Заключение
Мед Хлеб Йогурт Маргарин Макаронные изделия Крупа горох (рис)
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Какие органические вещества относятся к классу углеводов? Откуда возникло это название?
2. На какие группы делятся углеводы?
3. Какие химические реакции подтверждают тот факт, что глюкоза – вещество с двойственной химической функцией?
4. Какая реакция, характерная для альдегидов, не свойственна глюкозе?
5. Приведите уравнение реакции, с помощью которой можно различить глюкозу и сахарозу.
6. Какие виды брожения дает глюкоза? Напишите уравнения реакций всех известных вам видов брожения глюкозы.
7. Приведите пример реакций этерификации с участием целлюлозы (не менее двух).
8. Приведите структурную формулу мальтозы.
9. Приведите структурную формулу фрагмента молекулы целлюлозы и уравнение реакции гидролиза целлюлозы. Укажите условия.
10. Массовая доля крахмала в картофеле составляет 20 %. Какую массу глюкозы можно получить из 1620 кг картофеля, если выход продукта составляет 75 % от теоретического?
11. При гидролизе сахарозы получилось 270 г смеси глюкозы и фруктозы. Какая масса сахарозы подверглась гидролизу?
12. С помощью каких реакций можно доказать наличие в молекуле глюкозы: а) альдегидной группы; б) пяти гидроксильных групп?
13. На основе электронных представлений о химических связях поясните процесс образования циклических форм глюкозы (пиранозных и фуранозных) из альдегидной.
14. С помощью каких реакций можно осуществить следующие превращения: сахароза ® глюкоза ® глюконовая кислота ® глюкаровая (сахарная) кислота?
15. Получите из глюкозы 4 разные калиевые соли, в состав которых входит углерод.
16. Какие из перечисленных ниже веществ могут попарно вступать в реакции: сахароза, муравьиная кислота, воды, гидроксид меди (II)? Напишите уравнения реакций и укажите условия их протекания.
17. Вычислите массу 10 % раствора глюкозы, подвергшегося брожению, если известно, что при этом выделилось столько же газа, сколько его образуется при полном сгорании 35 мл этанола (плотность 0,8 г/мл).
18. Как распознать с помощью одного реактива глицерин, уксусный альдегид, уксусную кислоту, глюкозу? Напишите уравнения реакций.
19. Имея в своем распоряжении из органических веществ только глюкозу, получите два сложных эфира, в состав молекул которых входят по 5 атомов углерода.
Лабораторная работа №22
«Получение эмульсии растительного масла и бензола»
ЦЕЛЬ РАБОТЫ: определение устойчивости различных эмульсий; выявление зависимости максимального объёма пены от концентрации пенообразователя; определение изменения пены во времени.
ПРИБОРЫ И РЕАКТИВЫ: мерный цилиндр с притёртой пробкой на 50-100 см3, бензол, растительное масло, бура Na2B4O7∙10H2O, жидкое мыло, 2%-ный раствор мыла.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
Опыт 1. Приготовление эмульсий бензола и масла в воде.
1. Налейте в четыре пробирки до половины их объёма воду.
2. В первую пробирку добавьте 8-10 капель бензола, во вторую 8-10 капель растительного масла, закройте пробирки пробками, несколько раз энергично встряхните и поставьте в штатив.
3. В третью пробирку добавьте 5 капель 2%-ного раствора мыла и 8-10 капель бензола, также энергично перемешайте содержимое пробирки и поставьте её в штатив.
4. В четвёртую пробирку насыпьте 3 микрошпателя буры Na2B4O7∙10H2O, встряхните её до полного растворения соли. Добавьте 8-10 капель масла и после сильного взбалтывания (2-3 мин) поместите в штатив.
5. В каких пробирках эмульсия быстро расслаивается? Какой вывод можно сделать об устойчивости эмульсии в остальных пробирках? Какую роль играют мыло и бура? Объясните их влияние на стабильность эмульсии.
Опыт 2. Получение пены.
1. В цилиндр ёмкостью 50-100 см3 налейте 10 мл воды и 1 мл жидкого мыла.
2. Встряхивайте эту смесь в течение 15-20 сек.
3. После прекращения встряхивания включите секундомер, одновременно отметив объём образовавшейся пены. Наблюдайте изменение объёма во времени.
4. Затем повторите этот опыт при разбавлении раствора в 2 и 4 раза. Полученные результаты запишите в таблицу 6 и постройте графики:
а) зависимости максимального объёма образовавшейся пены от концентрации пенообразователя;
б) изменения объёма пены во времени.
Таблица 7
| Концентрация пенообразователя |
| ||||
| С1 | С2=С1/2 | С3=С1/4 |
| ||
| Время, сек. | Объём пены, V, см3 | Время, сек. | Объём пены, V, см3 | Время, сек. | Объём пены, V, см3 |
|
| | | | | |
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Какие системы относят к грубодисперсным системам? Что общего у них с коллоидными системами? 2. Что такое эмульсия? Какова их классификация? 3. Объясните причину неустойчивости эмульсий.4. Нарисуйте схему расположения молекул эмульгатора на капельке дисперсной фазы в эмульсиях М/В и В/М.5. В чем сущность явления обращения фаз эмульсии?
Лабораторная работа №23
«Обнаружение воды, сажи, углекислого газа в продуктах горения свечи»
Оборудование: парафин, оксид меди (II), сульфат меди (II), известковая вода, медная проволока , лабораторный штатив (или проборкодержатель), пробирки, пробка с газоотводной трубкой, спиртовка, спички, вата.
Соберите прибор, как показано на рисунке.
Смесь 1 — 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.
После изменения окраски сульфата меди (П) следует прекратить нагревание.
Наблюдения:
– парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород – в воду:
СnH2n+2 + (3n+1) CuO → n CO2↑ + (n+1) H2O + (3n+1) Cu
– выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды вследствие образования нерастворимого карбоната кальция:
СО2 + Cа(OН)2 → СаCO3↓ + H2O
– сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат CuSO4 · 5Н2О.
Вывод: по продуктам окисления парафина СО2 и H2O установили, что в его состав входят углерод и водород.
Контрольные вопросы:
1. Почему помутнел раствор известковой воды?
Напишите уравнение реакции, считая условно формулу парафина С16Н34.
2. Почему белый порошок сульфата меди (П) стал голубым? Напишите уравнение реакции, учитывая, что безводному сульфату меди (П) присоединяется 5 молекул воды.
3.Что произошло с чёрным порошком оксида меди (П).
Сделайте выводы.
Заполняем таблицу в тетради по ходу проведения опытов.
№ опыта
Мои действия
Что наблюдаю
Вывод
1
Поджёг свечу.
Плавится парафин (тает как лёд).
Таяние парафина (его плавление)-это физическое явление. При физическом явлении состав вещества не меняется, изменяется лишь агрегатное состояние, форма, размер.
А)Внёс стекло в среднюю часть пламени.
Б) Держал пробирку вверх дном.
В) В пробирку налил извест-ковую воду.
Стекло покрылось чёрным налётом.
Пробирка запотела.
Вода помутнела.
При внесении стекла в среднюю часть пламени на стекле образуется чёрный налёт-сажа (углерод).
Пробирку, которую держал вверх дном запотела – значит одним из продуктов горения является Н2О (вода).
При приливании известковой воды в пробирку она мутнеет = углекислый газ один из продуктов горения.
2
Накрыл двумя разными ёмкостями 2 одинаковые горящие свечи.
Свеча горит дольше под большей ёмкостью.
Свеча горит дольше под большей ёмкостью = там больше кислорода, значит, кислород поддерживает горение.
В состав парафина входят органические вещества с которыми познакомимся позже.
Допишите уравнения реакций (самостоятельно).
С7 Н16 + О2
гентан
С8 Н16 + О2
октан
С17Н36 + О2
Гентадекан
Вывод: наблюдал за горящей свечой, я пришёл к выводу, что горение свечи это не только физическое явление, но и химическое, так как в результате образовались два новых вещества.
Лабораторная работа №24
Тема: Правила работы в лаборатории. Изучение строение пламени. Очистка соли
Цели:
-
ознакомиться с правилами работы в лаборатории, правилами техники безопасности, методикой проведения лабораторных опытов, правилами ведения тетради для лабораторных работ;
-
изучить строение пламени;
-
научиться способам разделения смесей;
Оборудование: свеча, спички, стеклянная трубка, тигельные щипцы, фарфоровая чашка, штатив, воронка, фильтр, вода в стакане, поваренная соль, речной песок, стеклянная палочка, горючее, лучинка, цветные карандаши.
Ход работы
Опыт № 1. Ознакомление с правилами техники безопасности при работе в лаборатории
Используйте типовую инструкцию по работе в химической лаборатории.
Опыт № 2. Изучение строения пламени
Возьмите стеклянную трубку и внесите один ее конец в пламя свечи как можно ближе к фитилю. Поднесите горячую лучинку к другому концу стеклянной трубки. Нарисуйте, что вы увидели, и попробуйте дать объяснение.
Тигильными щипцами возьмите фарфоровую чашку и внесите ее в среднюю (светящуюся) часть пламени свечи. Внимательно наблюдайте за тем, что происходит с поверхностью чашки. Объясните ваши наблюдения.
Задание: Как с помощью лучинки или полоски плотного картона доказать, что температура пламени в разных его точках различна?
Попробуйте сформулировать вывод из опытов с обычной свечой.
Выводы:
Самая горячая часть пламени______________________
(внутреняя? внешняя?)
Нагревать вещества нужно во ______________ части пламени.
Опыт № 3. Очистка загрязненной поваренной соли
Рассмотрите выданную вам смесь поваренной соли и речного песка.
Вспомните, какими физическими свойствами (агрегатное состояние при обычных условиях, запах, цвет, растворимость в воде) обладают а) поваренная соль и б) речной песок.
а) поваренная соль- ___________________
б) речной песок - _____________________
Подумайте, как разделить компоненты смеси, используя различия в их физических свойствах.
Какое оборудование вам потребуется для очистки поваренной соли?
Выполняйте опыт согласно пунктам таблицы, которая приведена ниже.
ПРАКТИЧЕСКИЕ ЗАДАНИЯ
| Практическое занятие № 1,2. | Относительные атомные и молекулярные массы
|
| Практическое занятие № 3 | Решение задач на определение массовой доли элементов в сложном веществе |
| Практическое занятие № 4 | Нахождение протонов. электронов и электронов. Составление электронных формул |
| Практическое занятие № 5 | Нахождение относительной молекулярной массы |
Тема: Выполнение упражнений на составление электронных формул атомов элементов. Выполнение упражнений на составление окислительно-восстановительных реакций
Цель:
-
Научиться составлять электронные формулы химических элементов по периодической системе.
-
По электронной формуле определять химический элемент.
-
Уметь давать характеристику химическому элементу по периодической системе химических элементов.
-
Научиться по алгоритму составлять окислительно-восстановительные реакции.
Оборудование: Периодическая система химических элементов.
Ход работы
Задание 1.
-
Записать схему строения атомов элементов: натрия и фтора и их электронные формулы строения электронных оболочек.
-
Дать характеристику этим элементам по плану:
а) Положение элементов в периодической системе.
б) Металл или, неметалл данный элемент? Почему?
в) Сравните химическую активность данных элементов с элементами «соседями».
г) Запишите формулы оксидов, гидрооксидов этих элементов и укажите характер этих соединений: 1) основной; 2) кислотный; 3) амфотерный.
3. По электронной формуле определите химический элемент.
1S22S22P63S23P3
Укажите его порядковый номер, номер периода и номер группы, количество электронов на последней оболочке.
Форма отчета:
Ответить на каждый вопрос письменно по ходу выполнения задания.
Задание 2.
-
По алгоритму решите окислительно-восстановительные реакции
CuS + HNO3 → Cu(NO3)2 + S + NO +H2O
K2SO3 + H2SO4 + KMnO4 → K2SO4 + MnSO4 + H2O + KOH.
Алгоритм решения:
-
Расставьте степени окисления всех элементов.
-
Подчеркните и выпишите элементы, которые поменяли степени окисления.
-
Составьте уравнения электронного баланса (процесс отдачи и присоединение электронов атомами).
-
Укажите окислитель и восстановитель.
-
Исходя из правила, что отданных и присоединенных электронов должно быть одинаково, найдите коэффициенты и расставьте их в общее уравнение реакций.
ІІ. Запишите определения: окислитель, восстановитель, процесс окисления, процесс восстановления.
ІІІ. Какие из проведенных реакций являются окислительно-восстановительными и почему? Укажите окислитель и восстановитель:
а) N2O5 + H2O → 2HNO3
б) CuSO4 + Fe → FeSO4 + Cu
в) 2Fe + 3CI2 → 2FeCI3
Форма отчета:
Заполните таблицу, которая представлена ниже.
| Уравнения химических реакций и степени окисления атомов | Уравнения электронного баланса | Определения окислителя и восстановителя |
| 1. 2. 3. 4. | | |
Практическое занятие № 6
Тема: Решение задач. Генетическая связь между основными классами органических веществ
Цель работы: Научиться распознавать органические вещества среди предложенных; осуществить предложенные превращения веществ.
Реактивы: СаС2, вода, бром, спиртовка, этанол, уксусная кислота, глюкоза, глицерин, сульфат меди, NaOH, лакмус, натрий, алюминий или магний, ацетат калия, амиловый спирт, песок, концентрированная Н2SO4, крахмал, белок, спиртовый раствор йода, концентрированная НNO3.
Ход работы
Задание 1.
Как на опыте осуществить превращение: ацетат калия → уксусная кислота → изоамиловый эфир уксусной кислоты.
Задание 2
Проведите характерные реакции на глюкозу и дайте пояснения эксперименту.
Задание 3.
С какими нижеуказанными растворами веществ будет реагировать свежеполученный гидрооксид меди (II): хлорид железа (II); серная кислота, гидрооксид кальция, глицерин, этанол, уксусная кислота, глюкоза белок, крахмал? Проведите вначале анализ, затем на опыте докажите возможность тех или иных реакций.
Задание 4
Осуществите практически следующие превращения:
С2Н2Вr4
С аС2С2Н2
СО2
Напишите уравнение соответствующих реакций.
Задание 5
В пяти пробирках даны следующие вещества без надписей:
А) этанол, б) уксусная кислота, в) глюкоза, г) глицерин, д) этаналь.
Опытным путем определите каждое из выданных вам веществ.
Напишите уравнение соответствующих реакций.
Задание 6
В двух пробирках находятся: белок и крахмал, распознать каждое из веществ.
Оформите результаты эксперимента, заполнив таблицу.
| № опыта | Наблюдения | Уравнения реакции | Выводы | |
| №1 |
|
|
| |
| №2 |
|
|
| |
| №3 |
|
|
| |
| №4 |
|
|
| |
| №5 | | | | |
| №6 |
|
|
| |
Список используемой литературы
-
Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования. — М., 2014.
-
Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей социально-экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2014.
-
Габриелян О.С., Остроумов И.Г., Сладков С.А., Дорофеева Н.М. Практикум: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
-
Ерохин Ю.М., Ковалева И.Б. Химия для профессий и специальностей технического и естественнонаучного профилей: учебник для студ. учреждений сред. проф. образования. —М., 2014.
Интернет-источники
-
www.hemi.wallst.ru (Образовательный сайт для школьников «Химия»).
-
www.enauki.ru (интернет-издание для учителей «Естественные науки»).
-
www.hvsh.ru (журнал «Химия в школе»).
-
www.hij.ru (журнал «Химия и жизнь»).
-
www.chemistry-chemists.com (электронный журнал «Химики и химия»).
| Практическое занятие № 7 | Выход продукции реакции
|
| Практическое занятие № 8 | Молярная концентрация |
Практическая работа №9
Тема: Приготовление раствора заданной концентрации.
Цель работы: выработать навыки приготовления раствора заданной концентрации:
Задание:
1. Приготовить 100г 10% раствора карбоната натрия (Na2CO3)
2. Приготовить 100г 15% раствора хлорида натрия (NaCl)
Оборудование: весы учебные с разновесами, колба коническая( на 100мл), колба мерная (на 50мл), цилиндр измерительный, стеклянная палочка, листочки бумаги.
Реактивы: Хлорид натрия, карбонат натрия, вода.
Основной теоретический материал:
Массовая доля растворённого вещества - это отношение его массы m в-ва к массе раствора m р-ра. Её принято обозначать буквой СО
m в-ва
W (Омега): = ---------
m р-ра
Эта величина выражается в долях единицы или в процентах.
Например: приготовить 200г 10% р-ра NaCl
m NaCl
W= ----------- = 0,1 = 10% m NaCl = 200г * 0,1 = 20г NaCl
200 г р-ра
m воды = 200г – 20г = 180г
Значит надо взять 20г NaCl и растворить в 180г воды.
Молярная концентрация – это отношение количества растворённого вещества v ( в молях) к объёму раствора V (в литрах) её принято обозначать буквой С:
v
С= ------
V
Например, если 1л раствора серной кислоты содержит 2 моль H2SO4 значит молярная концентрация равна 2 моль/л , обозначают так:
2M H2 SO4
Выполнение работы:
Приготовление раствора хлорида натрия. Рассчитайте массы хлорида натрия и воды, которые необходимы для приготовления раствора с заданной массовой долей растворённого вещества. Взвесьте на весах (вспомните из курса физики правила взвешивания) требуемую порцию соли и с помощью цилиндра отмерьте необходимый объём дистиллированной воды (вспомните правила измерения объёма жидкостей).
Навеску соли внесите в колбу, прилейте к ней воду и перемешайте стеклянной палочкой до полного растворения соли. Полученный раствор сдайте преподавателю.
В тетради для практических работ запишите формулу соли и массовую долю её в приготовленном вами растворе, приведите все необходимые расчёты и опишите проделанные вами операции.
Приготовление раствора карбоната натрия. Вычислите массу вещества, необходимую для приготовления определённого объёма раствора заданной молярной концентрации.
Взвесьте на весах требуемое количество карбоната натрия и пересыпьте его в мерную колбу, в которую предварительно налейте дистиллированную воду до 1/3 её объёма. Встряхивайте колбу, добиваясь полного растворения вещества. Если соль полностью не растворилась, добавьте ещё дистиллированной воды, но не более 3/4 объёма колбы. После полного растворения соли можно доливать воду до метрии (риски). Полученный раствор сдайте преподавателю.
Запишите формулу соли и молярную концентрацию приготовленного вами раствора в тетради. Приведите все необходимые расчёты и опишите проведенные вами операции.
Контрольные вопросы:
1. Что такое массовая доля растворённого вещества?
2. Что такое молярная концентрация?
3. Как приготовить 200г 10% р-ра пищевой соды?
Практическая работа №10
Тема: Получение, собирание и распознавание газов.
Цель работы: Развитие умений и навыков по получению, собиранию и распознаванию газов.
Задание: Получить, собрать и распознавать водород, кислород, углекислый газ, аммиак.
Оборудование: Штатив с пробирками, спиртовка, лучинка, спички, стеклянная трубочка.
Реактивы: Цинк, раствор соляной кислоты, раствор перекиси водорода, оксид марганца (IV), кусочки мрамора, раствор уксусной кислоты, известковая вода, раствор хлорида аммония, раствор гидроксида натрия, лакмусовая бумажка.
Методика выполнения:
Вариант №1
В пробирку поместите две гранулы цинка и прилейте в неё 1-2 мл соляной кислоты. Что наблюдаете? Запишите уравнение реакции.
Накройте вашу пробирку пробиркой большего диаметра, немного заходя за край меньшей пробирки. Через 1 – 2 минуты поднимите большую пробирку вверх и, не переворачивая её, поднесите к пламени спиртовки. Что наблюдаете? Что можно сказать о чистоте собранного вами водорода? Почему водород собирали в перевёрнутую пробирку?
Вариант №2
В пробирку объёмом 20 мл прилейте 5 -7 мл раствора пероксида водорода. Приготовьте тлеющую лучинку (подожгите её и, когда она загорится, взмахами руки погасите). Поднесите к пробирке с пероксидом водорода, куда предварительно насыпьте немного (на кончике шпателя) оксида марганца (IV). Что наблюдаете? Запишите уравнение реакции.
Вариант №3
В пробирку объёмом 20 мл поместите кусочек мрамора и прилейте раствором уксусной кислоты. Что наблюдаете? Через 1 -2 минуты внесите в верхнюю часть пробирки горящую лучинку. Что наблюдаете? Запишите уравнение реакций в молекулярной и ионной формах.
В пробирку налейте 1 -2 мл прозрачного раствора известковой воды. Используя чистоту стеклянную трубочку, осторожно продувайте через
раствор выдыхаемый вами воздух. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной форме.
Вариант№4
В пробирку прилейте 1 – 2 мл раствора хлорида аммония, а затем такой же объём раствора щёлочи. Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной форме.
Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. Что наблюдаете? Осторожно понюхайте выделяющийся газ. Что ощущаете?
Контрольные вопросы:
1. Из каких реактивов получают водород?
2. Из каких реактивов получают кислород?
3. Из каких реактивов получают углекислый газ?
4. Из каких реактивов получают аммиак?
| Практическое занятие № 11 | Оксиды и их свойства Классификация неорганических соединений |
Практическая работа №12
Тема: Скорость химических реакций.
Цель работы: Изучение скорости реакции при взаимодействии различных веществ с водой.
Задание: Сравнить скорость реакций взаимодействие с водой различных веществ и записать уравнения происходящих реакций.
Оборудование: Штатив с пробирками, спиртовка
Реактивы: Натрий, кальций, железо, оксид кальция, вода.
Основной теоретический материал:
Скорость реакции - это количество вещества, реагирующего в единицу времени.
Для протекания химической реакции необходим контакт, соприкосновение взаимодействующих веществ. Одна и та же реакция может протекать с различной скоростью в зависимости от количества реагирующего вещества в единице объёма.
Скорость реакции зависит также от температуры. Для проведения некоторых реакций необходимо нагревание, по крайней мере вначале. В дальнейшем высокая температура в экзотермических реакциях может сохраняться. Для эндотермических реакций необходим постоянный подвод энергии.
Скорость реакций зависит от ряда факторов: от природы реагирующих веществ, от содержания реагирующих веществ в единице объёма, от температуры.
Выполнение работы:
1. Опустите в 4 пробирки по небольшому кусочку натрия, кальция, железа, оксида кальция.
2. В пробирки с натрием, кальцием добавьте понемногу воды. Щелочные и щёлочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые гидроксиды – щёлочи.
Запишите уравнения соответствующих реакций.
3. Менее активные металлы, такие как железо, взаимодействует с водой только в раскалённом виде. Прокалите кусочек железа на спиртовке и опустите в пробирку с водой.
Сравните результат.
3Fe + 4 H2O = Fe3O4 + 4 H2↑
(FeO * Fe2O3)
4. Проведите реакцию взаимодействия оксида кальция с водой (гашение негашеной извести)
Напишите уравнение реакции.
Контрольные вопросы:
1. Что такое скорость химической реакции?
2. От чего зависит скорость реакции?
3. Напишите уравнения реакций:
K + H2O = K2O + H2O =
Ba + H2O = BaO + H2O =
Практическое занятие №12
Тема: Скорость химических реакций. Химическое равновесие
Цели:
-
изучить влияние концентрации реагирующих веществ на сдвиг химического равновесия;
-
изучить влияние температуры, катализатора на скорость химических реакций;
-
уметь применять знания, полученные на теоретических занятиях;
-
соблюдать правила техники безопасности при выполнении опытов;
-
осуществлять самоконтроль за результатами своей работы
Оборудование и реактивы: 0,4 % KI, 0,8 % KI, CuSO4, раствор I, FeCI3, NH4 SCN, NH4CI, H2O2 крахмальный клейстер, горячая вода.
Ход работы
Опыт 1. Влияние концентрации реагирующих веществ, температуры и катализатора на скорость взаимодействия иодида калия с пероксидом водорода:
2KI + 3 H2O2 = 2KOH + 2H2O + I2 + O2
В четыре пронумерованных пробирки налейте по 3 мл раствора иодида калия разной концентрации и температуры согласно приведенной ниже таблице. Добавьте во все пробирки несколько капель крахмального клейстера для обнаружения йода. Затем прилейте, по возможности одновременно, во все пробирки по 2 мл перекиси водорода одинаковой концентрации. Наблюдения запишите в таблицу.
| № пробирки | Содержание пробирки | Последовательность посинения растворов | Влияние какого фактора сказалось на υ p |
| 1 | 0,4 % KI при комнатной температуре | | |
| 2 | 0,4% KI горячий | | |
| 3 | 0,4 % KI с CuSO4 |
| |
| 4 | 0,8 % KI
|
| |
Опыт 2. Влияние концентрации веществ на сдвиг химического равновесия
-
В пробирку налейте 10 мл воды и прилейте 1-2 капли растворов хлорида железа (III) FeCI3 и роданида аммония NH4SCN
Произошла реакция: FeCI3 + 3NH4SCN → Fe (SCN)3 + 3 NH4CI;
-
Полученный раствор разлейте поровну в 4 пробирки;
-
В первую прилейте 1 мл раствора хлорида железа (III) FeCI3;
-
Во вторую 1 мл NH4SCN, взболтайте;
-
В третью положите несколько кристалликов NH4CI, взболтайте;
-
Четвертую пробирку оставьте для сравнения.
Задание:
-
Как изменились цвета растворов в 1,2,3 случаях?
-
Объясните изменения цвета растворов с точки зрения смещения химического равновесия;
-
Сделайте вывод, используя принцип Ле-Шателье.
Контрольные вопросы
-
Чем отличаются обратимые реакции от необратимых.
-
От каких факторов зависит скорость химических реакций?
-
Во сколько раз изменится скорость реакции
2А +В → А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза.
4. Как измениться скорость реакции
2Fe + 3 CI2 = 2 FeCI3, если давление в системе увеличится в 5 раз?
5. Почему скоропортящиеся продукты хранят в холодильнике?
6. Как объяснить, что для гидролиза сахарозы в лабораторных условиях ее раствор подкисляют и затем кипятят, а в пищеварительном тракте гидролиз идет при температуре всего 36,5 0С, да еще значительно быстрее?
7. Как надо изменить концентрацию веществ, давление и температуру гомогенной системы
PCI5 → PCI3 + CI2 – 129 кДЖ, чтобы сместить равновесие в сторону разложения PCI5?
Практическая работа №13
Тема «Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами. Получение изоамилового эфира уксусной кислоты»
Цель работы: 1. Познакомиться со свойствами карбоновых кислот на примере уксусной кислоты.
2. Закрепить навыки работы с реактивами.
Задание: Изучить свойства уксусной кислоты, вспомнить её формулу и написать уравнения всех реакций.
Оборудование: Штатив с пробирками, спиртовка, спички, держатель.
Реактивы: раствор уксусной кислоты, лакмус, цинк, оксид меди (II), мел (CaCO3), раствор гидроксида натрия.
Методика выполнения:
1. Налейте в четыре пробирки по 2 мл раствора уксусной кислоты. Осторожно понюхайте этот раствор. Что ощущаете? Вспомните, где вы применяете уксусную кислоту дома.
2. В одну пробирку с раствором уксусной кислоты добавьте несколько капель раствора лакмуса. Что наблюдаете? Затем нейтрализуйте кислоту избытком щёлочи. Что наблюдаете? Запишите уравнение проведённой реакции.
3. В три оставшиеся пробирки с раствором уксусной кислоты добавьте: в одну – гранулу цинка, в другую – несколько крупинок оксида меди (II) и подогрейте её, в третью – кусочек мела или соды. Что наблюдаете? Запишите уравнения проведённых реакций.
Контрольные вопросы:
1. Что такое карбоновые кислоты? Дать определение.
2. Где применяют уксусную кислоту.
3. Какие свойства являются общими для неорганических и карбоновых кислот? Подтвердите свой ответ уравнениями реакций.
4. Запишите уравнения реакций с теми же веществами для муравьиной кислоты.
5. Где применяют муравьиную кислоту?
Практическая работа №14
Тема: Решение экспериментальных задач
Цель работы: Развитие умения и навыков в решении экспериментальных задач.
Задание: Получите сульфат железа (II) не менее чем тремя способами.
Оборудование: Штатив с пробирками
Реактивы: железо, серная кислота, оксид железа (II),
гидроксид железа (II)
Методика выполнения:
Сульфат железа (II) это средняя соль, которую можно получить
3 способами:
1. Способ: при взаимодействии железо + серная кислота
2. Способ: оксид железа (II) + серная кислота
3. Способ: гидроксид железа (II) + серная кислота
Запишите уравнения реакций. Проделайте все 3 способа получения сульфата железа (II)
Контрольные вопросы:
1. Напишите уравнения реакций получения 3 способами хлорида Ca
2. Напишите уравнения реакций получения 3 способами сульфата натрия.
Тема: Выполнение упражнений на составление структурных формул изомеров и названий по систематической номенклатуре (ЮПАК) алканов
Цель работы: Научиться составлять структурные формулы и давать названия алканам по систематической номенклатуре.
Оборудование: Таблица, карточки.
Ход работы
1. Дайте определение изомеров, гомологов.
2. Дать названия веществам:
а ) СН-СН-СН2- СН2- СН3
СН3
б) СН 3-СН-СН2- СН3
СН2
СН3
В) СН3-СН2-С-СН3
СН3
Г
) СН 3-СН-СН2- СН3
СН3 СН3
3. Изобразите структурные формулы веществ.
А) 2, 2, 4 триметилгексан
Б) 2, 2 диметил, 3, 4 диэтилгексан.
В) 3, 3, 4, 4 тетраметилоктан
4. Какие вещества называются предельными углеводородами. Напишите формулы и названия первых четырех гомологов алканов.
5. Что называется радикалами? Напишите формулы и названия радикалов, которые можно вывести из первых шести предельных углеводородов.
Форма отчета: Заполнение таблицы в тетрадях.
| № задания | Формулы | Названия | Определение (формулировки) |
|
|
|
|
|
Практическое занятие № 20
«Образование солей анилина. Бромирование анилина. Образование солей глицина.»
Цель работы:
1. Изучить химические свойства белков.
2. Выполнить и запомнить качественные реакции на белки.
Оборудование и реактивы: спиртовка, держатель для пробирок, пробирки, раствор гидроксида натрия (10-12 %), раствор сульфата меди (II) (0,5 моль/л), водный раствор яичного белка (готовится из расчета 1 мл белка на 5 мл насыщенного раствора поваренной соли), насыщенный раствор ацетата свинца, насыщенный раствор сульфата меди (II), концентрированная азотная кислота, концентрированная соляная кислота, концентрированная серная кислота, насыщенный раствор сульфата аммония, этиловый спирт, концентрированный раствор гидроксида натрия, концентрированный раствор аммиака, раствор ацетата свинца (0,5 моль/л).
ХОД РАБОТЫ
ОПЫТ 1. Свертывание белков при нагревании.
2-3 мл раствора белка налейте в пробирку и нагрейте в пламени спиртовки до кипения. Что при этом наблюдается? Чем можно объяснить это явление? Содержимое пробирки разбавьте водой. Растворяется ли осадок, если нет, то почему?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 2. Осаждение белков солями тяжелых металлов.
В две пробирки налейте по 1-2 мл раствора белка и медленно, по каплям, при встряхивании прилейте в одну из них насыщенный раствор сульфата меди (II), а в другую – насыщенный раствор ацетата свинца. Что наблюдается? Затем содержимое пробирок разбавьте большим количеством воды. Что наблюдается при этом?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод о действии солей тяжелых металлов на белок.
ОПЫТ 3. Осаждение белков минеральными кислотами.
Налейте в одну пробирку 1 мл концентрированной азотной кислоты, в другую – 1 мл концентрированной соляной кислоты, в третью – 1 мл концентрированной серной кислоты. Каждую пробирку наклоните и осторожно влейте в нее по стенке 1-1,5 мл раствора белка так, чтобы он не смешивался с более тяжелым слоем кислоты, затем пробирку поставьте в штатив. Что наблюдается на границе раздела двух жидкостей?
Затем пробирки встряхните. Какие изменения происходят при этом в пробирках?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод об отношении белка к концентрированным кислотам.
ОПЫТ 4. Высаливание белков сульфатом аммония.
В пробирку налейте 1-1,5 мл раствора белка, прилейте равный объем насыщенного раствора сульфата аммония. Смесь слегка встряхните. Что наблюдается? Что происходит с белком?
Смесь разбавьте большим количеством воды. Что происходит с осадком? Какой вид свертывания белка наблюдается?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 5. Осаждение белков этиловым спиртом.
В пробирку налейте 1-1,5 мл раствора белка, прилейте 2-3 мл этанола. Что наблюдается? Проверьте, растворяется ли осадок в воде. Какой вид свертывания белка наблюдается?
Задания:
1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 6. Цветные реакции на белки.
а) Ксантопротеиновая реакция.
К 1 мл раствора белка добавьте 5-6 капель концентрированной азотной кислоты до появления белого осадка или мути от свертывания белка. Реакционную смесь нагрейте до окрашивания осадка в желтый цвет. В процессе гидролиза, происходящем при этом, осадок может частично растворяться. Смесь охладите и добавьте к ней осторожно, по каплям, избыток концентрированного раствора аммиака. Окраска при этом переходит в оранжевую. Данная реакция является качественной на белки.
Задания:
1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
б) Биуретовая реакция.
В пробирку налейте 1-2 мл раствора белка, равный объем концентрированного раствора щелочи и 2-3 капли разбавленного раствора сульфата меди (II). Содержимое пробирки тщательно перемешайте. Жидкость при этом окрашивается в ярко-фиолетовый цвет. Эта реакция также является качественной на белки.
Задания:
1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
в) Сульфгидрильная реакция.
В пробирку налейте 0,5 мл раствора ацетата свинца и 2 мл раствора гидроксида натрия до растворения образовавшегося осадка гидроксида свинца (II). В результате получается плюмбит натрия Na2PbO2. В другую пробирку налейте 2 мл белка и прилейте из первой пробирки столько же плюмбита натрия.
Смесь нагрейте до кипения. При нагревании белок гидролизуется, и образуется сероводород, который вступает во взаимодействие с раствором Na2PbO2 с образованием черного или черно-коричневого осадка сульфида свинца PbS.
Задания:
1. Запишите все соответствующие наблюдения.
2. Напишите уравнения реакций образования гидроксида свинца (II) и плюмбита натрия.
3. Что позволяет обнаружить данная реакция в белке?
ОПЫТ 7. Образование солей анилина
В пробирку налейте 0,5 мл анилина и 3 мл дистиллированной воды. Взболтайте. Что наблюдаете? В пробирку добавьте соляной кислоты до полного растворения анилина в воде. Добавьте в пробирку 1—2 мл раствора щёлочи. Что наблюдаете?
Вопросы
1. Почему при добавлении соляной кислоты происходит растворение анилина? Напишите соответствующее уравнение реакции.
2. Почему при добавлении щёлочи анилин выделяется из водного раствора? Напишите уравнение реакции.
ОПЫТ 8. Бромирование анилина
В пробирку налейте 0,5 мл анилина и 0,5 мл дистиллированной воды. Прибавьте по каплям бромной воды до появления осадка.
Задания:
1. Почему обесцвечивается бромная вода?
2. Каково строение образующегося осадка? Напишите уравнение реакции.
ОПЫТ 9. Амфотерные свойства аминокислот
В пробирку налейте 2—3 мл раствора карбоната натрия и всыпьте щепотку глицина. Что наблюдаете? Напишите уравнение реакции.
Поместите в пробирку немного кристалликов глицина, смочите их несколькими каплями соляной кислоты и нагрейте. Что наблюдаете? Вылейте несколько капель образовавшегося раствора на часовое стекло. Наблюдайте образование при охлаждении кристаллов соли глицина. Напишите уравнение реакции.
Задания:
1. Какие свойства глицина проявляются в каждой из этих реакций?
2. Сравните форму кристаллов глицина и гидрохлорида глицина. Чем они отличаются?
ОПЫТ 10. Получение медной соли глицина
В пробирку, содержащую 2 мл раствора глицина, добавьте 1 г порошка оксида меди (II) и нагрейте до кипения.
Задания:
1. Чем обусловлено появление голубой окраски раствора?
2. Каково строение образующейся соли?
Практическая работа №21
«Спирты. Изучение растворимости спиртов в воде»
Цель: Изучить растворимость спиртов в воде. Провести реакцииокисления спиртов различного строения хромовой смесью, получить диэтиловый эфир и глицерат меди.
Ход работы
Опыт № 1 Растворимость спиртов в воде
В отдельные пробирки прилейте по 1—2 мл этилового и изоамилового (изопентилового) спиртов. Добавьте к ним по 2—3 мл воды и взболтайте. Отметьте, что этиловый спирт полностью растворился в воде, а изоамиловый спирт отделяется при отстаивании в виде маслянистого слоя над водой.
Вопросы к опыту:
1. В чем причина различного «поведения» спиртов в воде?
2. Почему изоамиловый спирт отслаивается над водой, а не наоборот?
3. Какие органические жидкие вещества при смешивании с водой будут отслаиваться над водой?
Опыт № 2 Получение глицерата меди
В пробирку налейте около 1 мл 10% -ного раствора сульфата меди(II) и добавьте немного 10% -ного раствора гидроксида натрия до образования голубого осадка гидроксида меди(II).
К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета.
Вопросы к опыту:
1. Какая реакция лежит в основе получения гидроксида меди(II)? Напишите уравнение этой реакции.
2. Почему при добавлении глицерина к осадку гидроксида меди(II) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(II).
3. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(II)?
Опыт № 3 Окисление этилового спирта хромовой смесью
В пробирке смешайте 2 мл 5% -ного раствора дихромата калия, 1 мл 20%-ного раствора серной кислоты и 0,5 мл этилового спирта. Отметьте цвет раствора. Осторожно нагрейте смесь на пламени горелки до начала изменения цвета. При этом ощущается характерный запах уксусного альдегида, образующегося в результате реакции.
Вопросы к опыту:
1. Почему цвет раствора меняется с оранжевого до синевато-зеленого? Напишите уравнение реакции окисления этилового спирта.
2. Можно ли заменить серную кислоту в данной реакции на соляную?
| Практическое занятие №22 | Глицерин. Изучение восстановительных свойств альдегидов.
|
| Практическое занятие №23 | Решение задач. Веществ. Идентификация Проба Бельштейна
|
Практическое занятие №21
Тема: Спирты. Изучение растворимости спиртов, окисление спиртов различного строения хромовой смесью. Получение диэтилового спирта. Получение глицерата меди
Цели:
-
изучить физические свойства спиртов;
-
изучить качественную реакцию на многоатомные спирты;
-
соблюдать правила техники безопасности;
-
экономно расходовать реактивы
-
уметь применять знания, полученные на теоретических занятиях;
Реактивы и оборудование: этанол, изоамиловый спирт, вода, CuSO4, NaOH, глицерин, дихромат калия (K2Cr2O7).
Ход работы
Опыт 1. Растворимость спиртов в воде
В отдельные пробирки прилейте по 1-2 мл этилового и изоамилового (изопентилового) спиртов. Добавьте к ним по 2-3 мл воды и взболтайте.
Отметьте растворимость этих спиртов.
Задания:
-
В чем причина различного «поведения» спиртов в воде?
-
Почему изоамиловый спирт отстаивается над водой, а не наоборот?
-
Какие органические жидкие вещества при смешивании с водой будут отслаиваться водой?
Опыт № 2. Свойства глицерина
-
К 1 мл воды в пробирке прилейте равный объем глицерина и взболтайте смесь. Затем добавьте еще столько же глицерина.
Что можно сказать о растворимости его в воде?
-
На лист фильтрованной бумаги нанесите 2-3 капли глицерина и отдельно несколько капель воды. Наблюдайте время от времени, какая жидкость быстрей испарится.
Как объяснить результаты опыта?
Опыт 3. Получение глицерата меди
В пробирку налейте около 1 мл 10% - ного раствора сульфата меди (II) и добавьте немного 10% - ного раствора гидроксида натрия до образования голубого осадка гидроксида меди (II).
К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета.
Задания:
-
Какая реакция лежит а основе получения гидроксида меди(II)? Напишите уравнение этой реакции.
-
Почему при добавлении глицерина к осадку гидроксида меди(II) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(II).
-
Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(II)?
Опыт 4. Окисление этилового спирта хромовой смесью
В пробирке смешайте 2 мл 5%-ного раствора дихромата калия, 1 мл 20%-ного раствора серной кислоты и 0,5 мл этилового спирта. Отметьте цвет раствора. Осторожно налейте смесь на пламени горелки до начала изменения цвета. При этом ощущается характерный запах уксусного альдегида, образующегося в результате реакции.
Задания:
-
Почему цвет раствора меняется с оранжевого до синевато-зеленого? Напишите уравнение реакции окисления этилового спирта.
-
Можно ли заменить серную кислоту в данной реакции на соляную?
Контрольные вопросы
-
Запишите уравнение реакций получения этанола в промышленности.
-
На примере пентанола запишите изомеры: углеводородной цепи, изомеры функциональной группы. Назовите эти изомеры по систематической номенклатуре.
-
Запишите уравнения реакции полного взаимодействия пропанола и пропантриола с натрием и хлороводородом. Дайте названия полученным веществам.
-
Чем отличаются по строению одноатомные спирты от многоатомных.
Практическое занятие №22
Тема: Растворение глицерина, взаимодействие его с гидроксидом меди.
Цель работы: Изучение свойств глицерина.
Задание: Проделать качественную реакцию на глицерин и изучить его растворимость в воде.
Оборудование: Штатив с пробирками, пипетка, держатель.
Реактивы: Глицерин, раствор сульфата меди (II), гидроксида натрия или калия.
Методика выполнения:
1. К 1 мл воды в пробирке прилейте 1 мл глицерина и смесь взболтайте.
Затем добавьте ещё 1 мл глицерина и ещё раз перемешайте смесь. Что можно сказать о растворимости глицерина в воде?
2. К 2 мл раствора щёлочи в пробирке прилейте несколько капель раствора медного купороса ( сульфата меди (II)). Что наблюдаете? К полученному осадку прибавьте по каплям глицерин и смесь взболтайте. Что наблюдаете? Напишите уравнения реакций. Используйте материал стр 72- 72, химия 10 кл.
Контрольные вопросы:
1. К какому классу органических соединений относится глицерин?
2. Где используют глицерин?
Практическое занятие № 24(а)
Тема: Реакции ионного обмена в водных растворах электролитов
Цели:
-
выяснить при каких условиях реакции ионного обмена практически осуществимы;
-
научиться предсказывать результаты таких реакций, а также правильно подбирать вещества
для получения того или иного соединения путем ионного обмена; -
закрепить умения писать уравнения реакций ионного обмена в молекулярном, полном и сокращенном ионном виде;
-
соблюдать правила техники безопасности при выполнении опытов;
-
осуществлять самоконтроль за результатами своей работы.
Реактивы и оборудование: хлорид железа (Ш) FеСlз, гидрооксид натрия NaOH, серная кислота H2S04, хлорид бария ВаСI2, карбонат натрия Na2CO3
Ход работы
Опыт №1. Реакции, идущие с образованием осадка
В первую пробирку налейте хлорид железа (Ш) FеСlз и прилейте к нему раствор NaOH.
Во вторую пробирку налейте хлорид бария ВаСI2 и серную кислоту H2S04.
Задание: Какие изменения происходят в 1 и 2 пробирках
Составьте уравнения происходящих реакций в молекулярном, ионном и
Опыт №2. Реакции, идущие с выделением газа
В пробирку налейте Nа2СОз, и прилейте серную кислоту сокращенном ионном виде.
Задание: Какие изменения происходят в 1 и 2 пробирках
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде.
Опыт № 3. Реакции, идущие с образованием малодиссоциирующего вещества
В одну пробирку налейте 3 мл раствора гидроксида натрия и добавьте 2-3 капли фенолфталеина, раствор приобретает малиновый цвет. Затем прилейте раствор серной или уксусной кислоты до обесцвечивания.
В другую пробирку налейте примерно 5 мл сульфата меди (II) и добавьте немного раствора гидроксида натрия. Образуется голубой осадок гидроксида меди (II). Прилейте в пробирку серную кислоту до растворения осадка.
Задание:
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде.
Поясните, почему в первой пробирке произошло обесцвечивание раствора, а во второй растворение осадка.
Каким общим свойством обладают растворимые и нерастворимые основания?
Контрольные вопросы
1. Укажите какие из перечисленных ниже веществ относятся к электролитам, и напишите уравнения их электролитической диссоциации: HNO3 ; NaOH; С2Н5ОН; FеСlз; АI2(SО4)З; KMnO4; СНзСООН; Сu(NО3)2 ; Си(ОН)2 ; NH3.
2. Какие вещества нужно взять, чтобы осуществились реакции: а) Са2 + CO32-=СаСОз; б) Сu2+ + 20Н-= Сu(ОН)2; в) Pb2+ + S2- = PbS?
3. В морской воде обнаружены ионы: Na+; Са2+; Mg2+; CI-, Br-, SO42-, НСОз-. Какие вещества
(напишите их формулы) содержатся в морской воде?
-
Напишите формулы веществ, в растворах которых содержатся ионы;
a) Ca2+; б) FеЗ+ и SO42-; в) H+ и Н2РО4-; г) Сг3+ и NO3- д) Mg2+ и CI-;) K+ и MnO4
Практическое занятие №24(б)
Реакция ионного обмена в растворах электролитов.
Цель работы: ознакомиться на практике с реакциями ионного обмена различных типов и условиями их протекания.
Оборудование и реактивы: штатив с 4 пробирками, соляная кислота, растворы хлорида бария, сульфата меди, сульфата натрия, гидроксида натрия, карбоната натрия, фенолфталеин
Ход работы:
-
В пробирку налейте 2 мл раствора хлорида бария и добавьте столько же раствора сульфата натрия. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
-
В пробирку налейте 2 мл раствора сульфата меди и прилейте раствор гидроксида натрия. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
-
Налейте в пробирку 2 мл раствора карбоната натрия, добавьте 1мл соляной кислоты. Что наблюдаете? Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
-
Налейте в пробирку 2 мл гидроксида натрия, добавьте каплю фенолфталеина. Что наблюдаете? Затем добавьте по каплям соляную кислоту до полного обесцвечивания раствора. Сделайте вывод и напишите уравнение химической реакции в молекулярном и сокращенном ионном виде.
По итогам проведенных опытов заполните таблицу, сделайте вывод об условиях протекания реакций ионного обмена до конца.
| № | РАСТВОРЫ | НАБЛЮДЕНИЕ | ХИМИЧЕСКИЕ РЕАКЦИИ (молекулярные, полные ионные и сокращенные ионные уравнения) |
| 1
|
|
|
|
| 2
|
|
|
|
| 3
|
|
|
|
| 4
|
|
|
|
Вывод:_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата:
Практическая работа №25
Тема: «Распознавание пластмасс и волокон.
Цель работы: 1. Научиться определять выданные образцы.
Оборудование: штатив с пробирками, спиртовка, спички.
Реактивы: Полиэтилен, фенолформальдегидная смола (пластмассы), хлопок, шерсть, капрон (волокна) р-р HNO3, H2SO4, NaOH.
Задание №1
Вам предложены образцы двух пластмасс из следующего перечня: полиэтилен, поливинилхлорид, фенопласт. Используя таблицу, определите, какие именно пластмассы вам выданы. Напишите формулы структурных звеньев выданных вам пластмасс.
| Название пластмассы | Физические свойства, определяемые органолептически | Отношение к нагреванию | Характер горения |
| Полиэтилен | Жирный на ощупь. В виде плёнки, прозрачный, эластичный | Размягчается, в размягченном состоянии легко меняет форму, вытягивается в нить | Горит ярким пламенем с запахом расплавленного парафина. Продолжает гореть вне пламени |
| Поливинилхлорид | Эластичный, в толстых слоях жесткий. Прозрачный или непрозрачный | Размягчается и разлагается с выделением хлороводорода | Горит коптящим пламенем. Ане пламени гаснет |
| Фенолоформальдегидная смесь | Непрозрачная, неэластичная, хрупкая | Не размягчается, разлагается | Загорается, при длительном пребывании смолы в пламени ощущается характерный запах фенола |
Задание №2
Вам предлагаются образцы – нити или ткани – трёх волокон из следующего перечня: хлопок, шерсть, натуральный шёлк, вискозное волокно, ацетатное волокно, капрон. Используя таблицу, определите, какие именно волокна вам выданы.
| Название волокна | Характеристика горения и его результат | Отношение к концентрированным кислотам и щёлочам | ||
| HNO3 | H2SO4 | NaOH | ||
| Хлопок | Быстро сгорает, ощущается запах жжёной бумаги. После сгорания остаётся серый пепел | Растворяется, раствор бесцветный | Растворяется | Набухает, но не растворяется |
| Вискозное | То же | Растворяется, раствор бесцветный | Растворяется. Раствор красно - коричневый | Растворяется |
| Шерсть и шёлк натуральный | Горит, ощущается запах палёного пера. Образуется хрупкий чёрный шарик | Жёлтое окрашивание | Разрушается | растворяется |
| Ацетатное | Горит в пламени, вне его гаснет. Спекается в тёмный не хрупкий шарик | Растворяется, раствор бесцветный | Растворяется | Желтеет и растворяется |
| Капрон | При нагревании размягчается, плавится, образуя твёрдый не хрупки блестящий шарик. | Растворяется, раствор бесцветный | Растворяется, раствор бесцветный | Не растворяется |
Контрольные вопросы:
1. Какие полимеры называют искусственными? В чём их отличие от природных?
2. Что такое волокна? Какие натуральные волокна (животного и растительного происхождения) и искусственные волокна вы знаете?
Все ответы на задания и результаты опытов записать в тетрадь.
Практическая работа №26
Тема: «Решение экспериментальных задач на идентификацию органических соединений»
Цель работы:
1. Научиться распознавать вещества
Задание №1
В двух пробирках без этикеток содержатся следующие вещества:
1 вариант: этиловый спирт и муравьиная кислота;
2 вариант: растворы глюкозы и глицерина;
3 вариант: растворы глюкозы и этанола;
4 вариант: растворы сахарозы и глюкозы;
Получите две пробирки в соответствии с номером вашего варианта. Предложите способ экспериментального определения содержимого каждой пробирки. После одобрения вашего предложения приступите к практическому распознаванию веществ.
Задание №2
С помощью одного реактива докажите, что глюкоза является веществом с двойственной функцией.
Задание №3
Вам выданы пробирки с растворами, в одной из которых содержится глицерин, в другой – формальдегид, в третьей – глюкоза. С помощью одних и тех же реактивов определите каждое вещество.
Задание №4
Докажите опытным путём, что картофель и белый хлеб содержат крахмал, а спелое яблоко – глюкозу.
Оборудование: Штатив с пробирками
Реактивы: этиловый спирт, муравьиная кислота, глюкоза, глицерин, сахароза, гидроксид меди (II).
Контрольные вопросы:
1. Что называется спиртами?
2. Что называется карбоновыми кислотами?
3. Что такое углеводы?
Тема: Знакомство с коллекцией металлов.
Цель работы: Познакомиться с коллекцией и научиться описывать физические свойства металлов.
Задание: Опишите физические свойства выданных в коллекции «Металлы» веществ.
Оборудование: Коллекция «Металлы», справочник по металлам (курс физики)
Методика выполнения: Опишите физические свойства выданных металлов (например, алюминия, меди, цинка, свинца, олова и др.), используя план: 1) агрегатное состояние при комнатной температуре; 2)цвет; 3)блеск; 4)пластичность; 5)тепло – и электропроводность; 6)твёрдость по относительной шкале твёрдости (см. справочник); 7)плотность (см. справочник); 8) температуры плавления и кипения (см. справочник); сформулируйте вывод, в котором перечислите общие физические свойства металлов.
Контрольные вопросы:
1. Какие физические свойства характерны для металлов?
2. Что такое электрохимический ряд напряжений металлов? Какими двумя правилами, ряда напряжений характеризуются свойства металлов?
Тема: Знакомство с коллекцией металлов.
Цель работы: Познакомиться с коллекцией и научиться описывать физические свойства металлов.
Задание: Опишите физические свойства выданных в коллекции «Металлы» веществ.
Оборудование: Коллекция «Металлы», справочник по металлам (курс физики)
Методика выполнения: Опишите физические свойства выданных металлов (например, алюминия, меди, цинка, свинца, олова и др.), используя план: 1) агрегатное состояние при комнатной температуре; 2)цвет; 3)блеск; 4)пластичность; 5)тепло – и электропроводность; 6)твёрдость по относительной шкале твёрдости (см. справочник); 7)плотность (см. справочник); 8) температуры плавления и кипения (см. справочник); сформулируйте вывод, в котором перечислите общие физические свойства металлов.
Контрольные вопросы:
1. Какие физические свойства характерны для металлов?
2. Что такое электрохимический ряд напряжений металлов? Какими двумя правилами, ряда напряжений характеризуются свойства металлов?
| Что делали | Что наблюдали |
| 1. Рассмотрели смесь | 1. Смесь неоднородна. Хорошо видны кристаллики соли ____ цвета и частицы речного песка цвета – |
| 2. Часть выданной смеси поместили в химический стакан с водой и перемешали стеклянной палочкой | 2. Образовался______________ (мутный? прозрачный? раствор) Через некоторое время________
|
| 3. Закрепили в штатив воронку, вложили в нее фильтр и смочили его водой. По палочке наливали раствор. | 3. Частицы песка остаются на фильтре. В колбе собирается ____________________фильтрат (мутный? прозрачный?)
|
| 4. Закрепили в штативе чашку для выпаривания и налили в нее фильтрат. Нагрели чашку. | 4. По мере испарения воды на стенках чашки появляются кристаллики поваренной соли
|
| Проиллюстрируйте эксперимент | Проиллюстрируйте эксперимент |
Вывод: ______________________________
Контрольные вопросы
-
Чем отличаются чистые вещества от смеси?
-
Перечислите способы разделения смесей.
-
Как оказать первую помощь при попадании на кожу кислот? Щелочей?
-
Какие правила следует соблюдать, при нагревании пробирки с веществами.
Практическое занятие №23
Тема: Обнаружение углерода и водорода в органическом соединении. Обнаружение галогенов (проба Бельштейна)
Цели:
-
научиться доказывать наличие углерода и водорода в составе парафина; наличие хлора в составе хлороформа.
-
уметь применять знания, полученные на теоретических занятиях;
-
соблюдать правила техники безопасности при выполнении опытов;
-
осуществлять самоконтроль за результатами своей работы
Реактивы и оборудование: штатив, прибор, состоящий из пробирки и газоотводной трубки, парафин, оксид меди (II), сульфат меди (II), гидрооксид бария Ba(OH)2, Ca(OH)2, хлороформ, медная проволока, прибор для нагревания, спички.
Ход работы
Опыт 1. Определение углерода и водорода в органическом соединении (парафин)
Соберите прибор, как показано на рисунке. Смесь 1-2 г оксида меди (II) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (II). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (II). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (II). Нижний конец газоотводной трубки должен быть погружен в пробирку с баритовой водой (раствор гидроксида бария) или известковой водой (раствор гидроксида кальция). Нагрейте пробирку в пламени горелки. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только баритовая вода помутнеет, пробирку с ней следует удалить и продолжить нагревание, пока пары воды не достигнут белого порошка сульфата меди (II) и не вызовут его посинения.
После изменения окраски сульфата меди (II) следует прекратить нагревание.
Определение состава продуктов окисления Органического вещества
Вывод запишите в тетрадь.
Задание:
-
Почему помутнел раствор баритовой воды? Напишите уравнение реакции.
-
Почему белый порошок сульфата меди (II) стал голубым? Напишите уравнение реакции.
-
Напишите уравнение реакции горения парафина
C13H28 + CuO→
Опыт 2. Обнаружение галогенов (проба Бейльштейна)
-
Для проведения опыта требуется медная проволока длиной около 10 мс, загнутая на конце петлей и вставленная другим концом в небольшую пробку.
-
Держа за пробку, прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (II), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки.
Определение галогена в хлороформе
Контрольные вопросы
-
Запишите уравнение реакции: C15H32 + CuO →
-
Чем отличаются π (пи) связь от σ (сигма) связи?
-
Изобразите возможные разрывы ковалентной связи в молекуле брома.
-
Дайте определение изомерам.
-
На примере пентана постройте 4 изомера.
-
Дайте определение алканам и запишите общую формулу алканов.
-
Напишите структурные формулы соединений, названия которых:
а) гексан
б) 2 – метилпентан
в) 2,2 диметилбутан
Практическое занятие № 27
Тема: Решение экспериментальных задач
Цели:
-
научиться проводить реакции по распознаванию катионов и анионов и опыты по осуществлению генетической связи между веществами;
-
соблюдать правила техники безопасности;
-
экономно расходовать реактивы;
-
уметь применять знания, полученные на теоретических занятиях;
Реактивы и оборудование:
-
Растворы: KCI, Fe2(SO4)3, AgNO3, NaOH, NH4SCN, HCI, H2SO4, CuSO4
-
Гранулы алюминия
-
Прибор для нагревания
Ход работы
Опыт 1. Дана смесь, состоящая из хлорида калия и сульфата железа (III). Проделайте опыты, при помощи которых можно определить хлорид- ионы CI- и ионы Fe3+
Напишите уравнения в молекулярном и ионном виде.
Опыт 2. Осуществите практически следующие превращения:
Na [ AI (OH)4 ]
AI → AICI3 → AI (OH)3
AI2 (SO4)3
Запишите уравнения реакций в молекулярном и ионном виде.
Опыт 3. Выданы вещества: кристаллогидрат сульфата меди (II), гидрооксид натрия, сульфат железа (III). Пользуясь этими веществами, получите:
а) гидрооксид железа (III);
б) гидрооксид меди (II);
в) оксид меди (II).
Напишите уравнения реакций в молекулярном виде.
Контрольные вопросы
-
На примере гидрооксида цинка, запишите уравнение реакций, доказывающих амфотерность его свойств.
-
Запишите уравнения реакций следующих превращений:
Cu → CuO → CuSO4 → Cu (OH)2 → CuO → Cu
Практическое занятие № 28
Тема: Образование солей анилина. Образование солей глицина. Денатурация белка. Цветные реакции белков.
Цели:
-
научиться проводить качественные реакции на белки.
-
уметь применять знания, полученные на теоретических занятиях;
-
соблюдать правила техники безопасности при выполнении опытов;
-
осуществлять самоконтроль за результатами своей работы
Реактивы и оборудование: Анилин, глицин, бромная вода, белок, концентрированный HNO3, CuSO4, NaOH, прибор для нагревания.
Ход работы
Опыт 1. Образование солей анилина.
В пробирку прилейте 0,5 мл анилина и 3 мл воды. Взболтайте.
Что наблюдается?
В пробирку добавьте соляной кислоты до полного растворения анилина в воде. К раствору добавьте 1-2 мл раствора щелочи.
Что наблюдается?
Задание:
-
Почему при добавлении соляной кислоты происходит растворение анилина? Напишите уравнение реакции.
-
Почему при добавлении щелочи, анилин выделяется из водного раствора? Напишите уравнение реакции.
Опыт 2. Бромирование анилина.
В пробирку налейте 0,5 мл анилина и 0,5 мл воды. Прибавьте по каплям бромной воды до появление осадка.
Задание:
-
Почему обесцвечивается бромная вода?
-
Каково строение образующегося осадка? Напишите уравнение реакции.
Опыт 3. Денатурация белка.
Приготовьте раствор белка. Для этого белок куриного яйца растворите в 150 мл воды. В пробирку налейте 4-5 мл раствора белка и нагрейте на горелке до кипения. Отметьте помутнение раствора. Охладите содержимое пробирки. Разбавьте водой в 2 раза.
Задание:
-
Почему раствор белка при нагревании мутнеет?
-
Почему образующийся при нагревании осадок не растворяется при охлаждении и разбавлении водой?
Опыт 5. Цветные реакции белков.
Ксантопротеиновая реакция. В пробирку налейте 2-3 мл раствора белка и прибавьте несколько капель концентрированной азотной кислоты. Нагрейте содержимое пробирки, при этом образуется желтый осадок. Охладите смесь и добавьте аммиак до щелочной реакции (проба на лакмус).
Наблюдения:
Биуретовая реакция. В пробирку налейте 2-3 мл раствора белка и 2-3 мл гидроксида натрия, затем 1-2 мл раствора медного купороса.
Наблюдения:
Контрольные вопросы
-
Имеют ли белки температуры плавления и кипения?
-
Почему сырое молоко усваивается лучше, чем пастеризованное?
-
С какой целью при отравлении солями тяжелых металлов применяют молоко или сырые яйца?
-
Почему не рекомендуется носить обувь из натуральной кожи в дождливую погоду?
-
Почему белковую пищу нельзя длительно заменять пищей, содержащей жиры и углеводы?
Практическое занятие № 29
Тема: Обнаружение витамина А в подсолнечном масле. Обнаружение витамина С в яблочном соке. Обнаружение витамина Д в рыбьем жире. Действие амилозы слюны на крахмал. аминофенола
Цели:
-
научиться определять наличие витаминов в продуктах питания;
-
научиться проводить реакции на определение лекарственных препаратов;
-
экономно расходовать реактивы;
-
уметь применять знания, полученные на теоретических занятиях;
-
соблюдать правила техники безопасности при выполнении опытов;
-
осуществлять самоконтроль за результатами своей работы
Реактивы и оборудование: Подсолнечное масло, яблочный сок, куриный желток, FeCI3, вода, крахмал, раствор йода, раствор бромной воды, перекись водорода, сырое мяса, кусочек картофеля салициловая кислота, аспирин, салол, NaOH, парацетамол, С2H5OH.
Ход работы
I. Обнаружение витамина А в подсолнечном масле
Опыт 1. В пробирку налейте 1 мл подсолнечного масла и добавьте 2-3 капли 1%-ного раствора FeCI3. При наличии витамина А появляется ярко зеленое окрашивание.
Опыт 2. Определение витамина С в яблочном соке.
Налейте в пробирку 2 мл сока и добавьте вода на 10 мл. Затем влейте немного крахмального клейстера (1 г крахмала на стакан молока). Далее по каплям добавляйте 5% раствор йода до появление устойчивого синего окрашивание, не исчезающего 10 15 секунд. Техника определения основана на том, что молекулы аскорбиновой кислоты легко окисляются йодом. Как только йод окислит все аскорбиновую кислоту, следующая же капля, прореагировав с крахмалом, окрасит раствор в синий цвет.
Опыт 3. Определение витамина Д в рыбьем жире или курином желтке.
В пробирку с 1 мл рыбьего жира прилейте 1 мл раствора брома. При наличии витамина Д появляется зеленовато - голубое окрашивание.
II. Действие ферментов на различные вещества
Опыт 1. Действие амилазы слюны на крахмал.
-
Прополощите тщательно рот водой. Наберите 2-4 мл слюны в маленький мерный цилиндр. Добавьте воды в цилиндр или пробирку до объема 10 мл. Этот раствор содержит фермент амилазу, который вы будите изучать.
-
Смешайте 5 мл раствора крахмала и 1 мл раствора фермента в маленькой мензурки или пробирке. Через 30 секунд после перемешивания возьмите каплю полученного раствора и проверьте ее на содержание крахмала, перемешав ее с каплей раствора йода на предметном стекле. Спустя еще 30 секунд, проверьте следующую каплю смеси на содержание крахмала. Если крахмал еще присутствует, то повторяйте тест каждые 30 секунд до тех пор, пака больше не обнаружите крахмала в смеси. Запишите общее время необходимое для того, чтобы исчез весь крахмал.
-
Две новые порции смеси растворов фермента и крахмала (2,5 мл раствора крахмала и 0,5 мл раствора фермента) в двух пробирках поместите в стаканчики с водой: в одном вода охлаждена с помощью льда или снега до t 100С , а другой – с теплой водой при t 35-400C (приблизительно). Каждые 30 секунд отбирайте по одной капли смеси растворов крахмала и фермента и смешивайте с каплей раствора йода на предметном стекле. Повторяйте это пока не обнаружите, что в растворе исчез крахмал. Запишите затраченное время, сделайте вывод о влиянии температуры на работу фермента.
III. Анализ лекарственных препаратов
Опыт 1. Анализ лекарственных препаратов, производной салициловой кислоты
Объекты исследования.
-
Салициловая кислота (о – гидроксибензойная кислота).
-
Аспирин, ацетилсалициловая кислота (салициловый эфир уксусной кислоты).
-
Салол (фениловый эфир салициловой кислоты).
Напишите структурные формулы указанных соединений. Укажите, в чем составит различие в строении этих соединений, какие функциональные группы входят в состав каждого из соединений (карбоксильная, фенольный гидроксил, сложноэфирная группа). Опишите лекарственное действие этих соединений.
Эксперимент
-
Разотрите в ступке таблетки каждого из этих лекарств. Перенесите в пробирки по 0,1 г каждого лекарства (приблизительно ½ часть таблетки). Для сравнения свойств можно взять аспирин различного производства, например английский, немецкий, российский. Добавьте в каждую пробирку 2-3 мл воды и отметьте растворимость лекарств в воде. Нагрейте на спиртовке пробирки с веществами до кипения. Что наблюдается?
-
Внесите в пробирки приблизительно по 0,1 г лекарственных препаратов и добавьте по 2-3 мл этанола. Что наблюдается? Нагрейте на спиртовке пробирки до полного растворение осадков. Сравните растворимость лекарственных препаратов в воде и этаноле.
-
Взболтайте по 0,1 г препарата с 2-3 мл воды и добавьте по 2-3 мл разбавленного раствора щелочи (NaOH). Изменилась ли растворимость веществ? Объясните наблюдаемые явления, напишите уравнения соответствующих реакций.
-
Взболтайте по 0,1 г каждого препарата с 2-3 мл воды и добавьте несколько капель раствора хлорида железа (III). Что наблюдается? В каких пробирках произошло изменение окраски? Объясните наблюдаемое явление.
Опыт 2. Анализ лекарственных препаратов, производных n – аминофенола
Объекты исследования
-
Парацетамол (n-N-ацелитаминобензол).
-
Фенацетин (1-этокси-4-ацетаминобензол).
Эксперимент
-
Разотрите в ступке таблетки каждого из этих лекарств. Перенесите в пробирки по 0,1 г каждого лекарства (приблизительно 1/5 часть таблетки). Для сравнения свойств можно взять аспирин различного производства, например английский, немецкий, российский. Добавьте в каждую пробирку 2-3 мл воды и отметьте растворимость лекарств в воде. Нагрейте на спиртовке пробирки с веществами до кипения. Меняется ли растворимость лекарств в воде в зависимости от температуры?
-
Внесите в пробирки по 0,1 г лекарственного препарата и добавьте в каждую по 2-3 мл этанола. Отметьте растворимость веществ в этаноле. Нагрейте пробирки до кипения. Что наблюдаете?
-
Взболтайте по 0,1 г каждого препарата с 2-3 мл воды и добавьте несколько капель хлорида железа (III).
Задание:
Что наблюдается?
В какой пробирке произошло изменение окраски?
Объясните наблюдаемое явление.
Контрольные вопросы
-
Напишите структурные формулы парацетамола и фенацетина.
-
Укажите, в чем состоит различие в строении этих соединений
-
Какие функциональные группы входят в состав каждого из соединений (фенольный гидроксил, амид, простой эфир).
-
Опишите лекарственное действие этих соединений.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Методические указания к практическим заданиям по химии (1.13 MB)
Методические указания к практическим заданиям по химии (1.13 MB)
 0
0 1588
1588 45
45 Нравится
0
Нравится
0


