ДОНЕЦКИЙ ИНДУСТРИАЛЬНО-ПЕДАГОГИЧЕСКИЙ ТЕХНИКУМ
Химия
Методические рекомендации
по проведению лабораторных работ
(для студентов высших учебныхзаведений
І-ІІ уровнейаккредитации,
которые осуществляютподготовкумладших специалистов
на основе базового общего среднего образования)
Донецк
2014
Химия. Методические рекомендации по проведению лабораторных работ
(для студентов высших учебных заведений І-ІІ уровней аккредитации, которые осуществляют подготовку младших специалистов на основе базового общего среднего образования). – Донецк: ДИПТ, 2014.
Составитель: Гризодуб Н.В.,преподаватель биологии и химии
Донецкогоиндустриально-педагогическоготехникума.
Издание содержит методические рекомендации по проведению лабораторных работ по химии, составленные в соответствии с программой по дисциплине «Химия» рекомендованной Министерством образования и науки для студентов высших учебных заведений І-ІІ уровней аккредитации, которые осуществляют подготовку младших специалистов на основе базового общего среднего образования, в соответствии с Государственным стандартом базового и полного среднего образования.
Рассмотренона заседании методического совета
Донецкого индустриально-педагогического техникума
(протокол №1от15.09.2014 г.)
© Гризодуб Н.В., 2014
© Издательство «ДИПТ», 2014
СОДЕРЖАНИЕ
Предисловие 4
Общие требования безопасности 5
Требования безопасности в аварийных ситуациях 6
Техника безопасности при работе в лаборатории 7
Правила выполнения лабораторных работ 9
Лабораторная работа № 1 Химические свойства сульфатной кислоты 10
Лабораторная работа № 2 Получение и свойства карбона(IV)оксида 14
Лабораторная работа № 3 Химические свойства металлов 16
Лабораторная работа № 4 Решение экспериментальных задач 20
Лабораторная работа № 5 Качественное определение углерода, водорода и хлора в органических веществах 22
Лабораторная работа № 6 Свойства уксусной кислоты 24
Лабораторная работа № 7 Решение экспериментальных задач 26
Лабораторная работа № 8 Изучение свойств полимеров 28
Лабораторная работа № 9 Изучение и сравнение свойств синтетических моющих средств и мыла 35
Лабораторная работа № 10 Удаление загрязнений с поверхности тканей 38
Заключение 41
Список использованных источников 42
ПРЕДИСЛОВИЕ
Лабораторные занятия являются одним из видов химического эксперимента, применяемого при совершенствовании и закреплении знаний. В процессе проведения занятий студенты глубже и полнее вникают в химические явления и законы, овладевают техникой и изучением свойств веществ.
Для познания студентами сущности химических явлений необходимо учить наблюдать, разъясняя цель и необходимость наблюдений, добиваться самостоятельного объяснения наблюдаемых процессов и умения делать выводы из проводимых опытов.
Ученический эксперимент кроме привития умения и навыков работы в химической лаборатории, кроме закрепления и лучшего усвоения учебного материала должен учить мыслить.
При выполнении лабораторных работ химический эксперимент может использоваться в качестве отправного пункта при простановке проблемы, решение которой создает перспективу в работе и вызывает интерес к теме урока.
Необходимо стремиться, чтобы каждый студент работал индивидуально, но по единому плану. При оценке работы студентов следует учитывать не только химическую грамотность, но и те навыки, которые они приобрели в лаборатории.
Успешное освоение практикума возможно при выполнении следующих условий:
а) изучение теоретического материала данной темы;
б) запись краткого хода работы в лабораторном журнале.
Для записи результатов опытов студенты ведут тетрадь для лабораторных работ, где указываются:
а)тема работы;
б) цель работы;
в) краткий ход;
г) запись уравнений реакций;
д) запись наблюдений и выводов по каждому опыту;
е) общий вывод и ответы на вопросы работы.
ОБЩИЕ ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
К проведению лабораторных работ по химии допускаются студенты, прошедшие инструктаж по охране труда, медицинский осмотр и не имеющие противопоказаний по состоянию здоровья.
Студенты должны соблюдать правила проведения, расписание учебных занятий, установленные режимы труда и отдыха.
При проведении лабораторных опытов и практических занятий по химии возможно воздействие на студентов следующих опасных и вредных производственных факторов:
химические ожоги при попадании на кожу или в глаза едких химических веществ;
термические ожоги при неаккуратном пользовании спиртовками и нагреваний жидкостей;
порезы рук при небрежном обращении с лабораторной посудой;
отравление парами и газами высокотоксичных химических веществ;
возникновение пожара при неаккуратном обращении с легко воспламеняющимися и горючими жидкостями.
Кабинет (лаборатория) химии должен быть укомплектован медицинской аптечкой с набором необходимых медикаментов и перевязочных.
Студенты обязаны соблюдать правила пожарной безопасности, знать места расположения первичных средств тушения. Кабинет химии должен быть оснащен первичными средствами пожаротушения; огнетушителем, ящиком с песком.
Для нагревания жидкостей использовать только тонкостенные сосуды, наполненные жидкостью не более чем на треть. В процессе нагревания не направлять горлышко сосудов на себя и на своих товарищей, не наклоняться над сосудом и не заглядывать в них.
Запрещается пробовать любые растворы и реактивы на вкус, а также не принимать пищу и напитку в кабинете химии.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ В АВАРИЙНЫХ СИТУАЦИЯХ
При разливе водного раствора кислоты или щелочи, а также при рассыпании твердых реактивов немедленно сообщить об этом преподавателю или лаборанту. Не убирать самостоятельно любые вещества.
При разливе легковоспламеняющихся жидкостей или органических веществ немедленно погасить открытый огонь спиртовки и сообщить об этом преподавателю или лаборанту.
При разливе легковоспламеняющейся жидкости и ее воспламенении немедленно сообщить об этом преподавателю и по его указанию покинуть помещение.
В случае, если разбилась лабораторная посуда, не собирать ее осколки незащищенными руками, пользоваться для этой цели щетку и совок.
Приполучении травмы сообщить об этом преподавателю, которому немедленно оказать первую помощь пострадавшему и сообщить администрации техникума.
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ЛАБОРАТОРИИ
При проведение лабораторных работ в лаборатории по химии приходится иметь дело с горючими и легко воспламеняющими жидкостями, щелочами и ядовитыми веществами. Поэтому необходимо соблюдать следующие правила.
Содержать рабочее место в чистоте.
Всегда работать только с небольшими количествами веществ.
Реактивы не следует брать руками. После окончания лабораторных работ руки необходимо тщательно вымыть.
В лаборатории нельзя принимать пищу.
Нельзя пробовать на вкус, за исключением тех случаев, когда это делается по указанию преподавателя.
При определении запаха следует пары вещества направлять к носу взмахом ладони.
Все работы с вредными, взрывоопасными, пожароопасными веществами, с концентрированными кислотами и щелочами проводите в вытяжном шкафу.
При нагревании жидкости пробирку дерите отверстием от себя и от других, находящихся рядом.
Работа с концентрированными кислотами требует максимального внимания и осторожности, особенно при нагревании. Ожоги концентрированными кислотами очень болезненны, сопровождаются трудно заживающими и оставляющими рубцы язвами. Особенно нужно опасаться поражения глаз. Платье и обувь разрушаются от действия концентрированных кислот. При работе необходимо соблюдать следующие правила:
сульфатную кислоту смешивайте с водой, приливая кислоту к воде небольшими порциями; нитратную кислоту смешивайте с сульфатной, приливая нитратную к сульфатной небольшими порциями; пробирки со смесями кислот следует охлаждать водой;
нельзя перемешивать кислоты с какими-либо веществами в пробирке, встряхивать, закрывая ее пальцем, так как при этом неизбежны ожоги от выброшенных из пробирок брызг кислот;
перемешивать кислоты в пробирке можно слегка, ударяя пальцем по нижней части пробирки;
концентрированные кислоты нельзя выливать в раковину во избежание порчи канализационных труб и выброса кислоты из раковины, их следует сливать в специальную посуду.
Работу с ядовитыми веществами (ацетиленом, бромом) производите только в вытяжном шкафу.
Запрещается бросать в раковину кусочки карбида кальция, сливать эфиры, жиры, вязкие растворы - сливайте их в специальную посуду, указанную преподавателем.
Все отработанные реактив сливайте в специальную посуду.
Горячие предметы ставьте только на подставки.
Сосуды с реактивами после употребления закрывать пробками и ставьте на соответствующие места.
При работе с огнеопасными веществами следите, чтобы поблизости не было открытого огня или сильно нагретых предметов.
Посуду с огнеопасными веществами сразу после их использования следует плотно закрыть и убрать в безопасное место.
В случае вспышки горючих жидкостей в пробирке не бросайте ее, а закройте чем - либо отверстие пробирки.
Если горящая жидкость разлилась по поверхности стола, пола, то очаг огня необходимо тотчас же засыпать песком, или воспользоваться огнетушителем. В случае вспышки одежды на работающем следует плотно обернуть горящего полотенцем или одеялом.
ПРАВИЛА ВЫПОЛНЕНИЯ ЛАБОРАТОРНЫХ РАБОТ
Студент должен:
Строго выполнять весь объем домашней подготовки, указанный в описаниях соответствующих лабораторных работ и практических занятий.
Знать, что выполнению каждой работы предшествует проверка готовности студентов, которая производится преподавателем.
Знать, что после выполнения работы подгруппа, которая назначается преподавателем на весь период работы, должна предоставить отчет о проделанной работе с обсуждением полученных результатов и выводов.
Оценка студентов по лабораторной работе выставляется по представлению отчета за работу и выполненного контрольного задания.
В случае если студент пропустил лабораторную работу или практическое занятие по неуважительной причине или уважительной причине – студент должен отработать лабораторную работу или практическое занятие в указанный срок преподавателем.
ЛАБОРАТОРНАЯ РАБОТА № 1
Тема. Химические свойства сульфатной кислоты.
Цель: ознакомиться с химическими свойствами сульфатной кислоты, научиться распознавать сульфат-ионы в растворе.
Задание.Проработайте теоретический материал:
Физические свойства серной кислоты.
Чистая 100%-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около 95 % H2SO4. Затвердевает она лишь ниже -20 °С. Чрезвычайно гигроскопична. Активно поглощает влагу. Смешивается с водой в любых соотношениях. Растворение серной кислоты в воде сопровождается выделением большого количества теплоты, что может привести к закипанию воды и разбрызгиванию кислоты.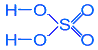
Серная кислота – едкая жидкость, поэтому необходимо избегать попадания ее на кожу и одежду. А если это случится, необходимо быстро смыть ее большим количеством воды, после чего нейтрализовать раствором соды и снова смыть водой.
Необходимо помнить следующее правило:
Помните! Серную кислоту нужно вливать малыми порциями в воду, а не на оборот. Иначе может произойти бурная химическая реакция, в результате которой человек может получить сильные ожоги.

H2SO4 -сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
1) Диссоциация протекает ступенчато:
H2SO4→ H+ + HSO4- (первая ступень, образуется гидросульфат – ион)
HSO4 → H+ + SO42- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+SO4(разб.)=ZnSO4 + H20↑
Zn0 + 2H+ = Zn2+ + H20↑
3)Взаимодействие с основными и амфотерными оксидами:
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
4)Взаимодействие с основаниями:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (реакция нейтрализации)
H+ + OH- =H2O
Если кислота в избытке, то образуется кислая соль:
H2SO4 + NaOH → NaНSO4 + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
2H+ + Cu(OH)2 = Cu2+ + 2H2O
5)Обменные реакции с солями:
образование осадка
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Ba2+ + SO42- = BaSO4↓
Качественная реакция на сульфат – ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах и щелочах)
Концентрированная серная кислота – сильный окислитель за счёт S+6.Она взаимодействует даже с малоактивными металлами, т.е. с металлами до и после водорода, и в отличие от разбавленной кислоты никогда не выделяет водород при этих реакциях. В реакциях с металлами всегда образуется три продукта: соль, вода и продукт восстановления серы.
Концентрированная серная кислота не реагирует с благородными металлами и пассивируетFe, Cr, Ni, Al! Конц. серная кислота пассивируеталюминий, железо, хром, никельобразуя на их поверхности твёрдую нерастворимую плёнку, которая защищает их от дальнейшего окисления. Это свойство используется для перевозки серной кислоты в стальных баллонах.
В реакциях с металлами серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.
Взаимодействие магния с концентрированной серной кислотой:
4Мg + 5H2SO4конц. = 4MgSO4 + H2S + 4H2O
![]()
Mg0-2e=Mg2+4 окисление, восстановитель
S+6 +8e= S-21 восстановление, окислитель
Применение серной кислоты:
в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
в пищевой промышленности –зарегистрирована в качестве пищевой добавки E513(эмульгатор);
в промышленном органическом синтезе в реакциях:
дегидратации (получение диэтилового эфира, сложных эфиров);
гидратации (получение этанола);
сульфирования (получение СМС и промежуточные продукты в производстве красителей);
Применение солей серной кислоты :
Купоросы – техническое название кристаллогидратов сульфатов некоторых тяжелых металлов.Следовательно, купоросы – это соли серной кислоты, кристаллы которых содержат кристаллизационную воду.
Железный купорос FеSО4 • 7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.

Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.

«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.
«Бариевая каша» BaSO4обладает способностью задерживать рентгеновские лучи в значительно большей степени, чем ткани организма. Это позволяет рентгенологам при заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.
Гипс СаSO4 • 2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Охарактеризуйте физические и химические свойства серной кислоты?
Что такое купоросы, область их применения?
1 вариант
Допишите уравнения возможных реакций и уравняйте их методом электронного баланса.
а) K + H2SO4(p) → …; в) Hg + H2SO4(k) → …;
б) Fe + H2SO4 (к) → …; г) Zn + H2SO4(k) → … .
2 вариант
Допишите уравнения возможных реакций и уравняйте их методом электронного баланса.
а) Са + H2SO4(k) → …; в) Pb + H2SO4(p) → … ;
б) Ag + H2SO4(p) → …; г) Cu + H2SO4(k) → … .
Тест «Серная кислота и ее соли»
Какие пары веществ необходимо использовать, чтобы получить сульфатную кислоту?
а) Н2О + SО2 →; б) Н2О + S→; в) Н2О + SО3→
2. Какие из перечисленных металлов реагируют с разведенной сульфатной кислотой?
а) Al; б) Au; в) Ag; г) Cu.
3. С помощью каких реактивов можно определить качественный склад сульфатной кислоты:
а) Cu и BaCl2; б) Mg и BaCl2; в) Zn и NaCl
4. В кислой среде фиолетовый лакмус изменяет окрас на:
а) синий; б) красный; в) не изменяет цвета
5. Какой ряд формул состоит только из формул солей сульфатной кислоты:
а) MgSO4, NaHSO3, Al2(SO4)3;
б) KCl, BaSO4, K2SO4;
в) CaSO4, Na2SO4, Fe2(SO4)3
6. Как правильно растворять кислоту в воде?
а) к воде долить кислоту;
б) к кислоте долить воду;
в) слить в посудину одновременно воду и кислоту.
7. Во время диссоциации сульфатной кислоты в растворе образуются ионы:
а) H+ + SO42-;
б) 2Н+ + SO42-;
в) H+ + SO-.
8. Во время взаимодействия разбавленной сульфатной кислоты с активными металлами выделяется:
а) SO2; б) S; в) H2S; г) H2
9. Степень окисления Сульфура в сульфатной кислоте:
а) +2; б) +4; в) +6; г) -2
10. Купоросы – это:
а) средние соли сульфатной кислоты;
б) кислотные соли сульфатной кислоты;
в) соли сульфатной кислоты, связанные с определенным количеством молекул воды.
ЛАБОРАТОРНАЯ РАБОТА № 2
Тема. Получение и свойства карбона (ΙV) оксида.
Цель: научиться получать и распознавать карбон (ΙV) оксид в лабораторных условиях; исследовать взаимное превращение карбонатов и гидрокарбонатов. Научиться определять наличие карбонат-ионов в растворе.
Задание. Проработайте теоретический материал:
Физические свойства
Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15°С).
Химические свойства
Химически оксид углерода (IV) инертен.
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа:
С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Na2O + CO2 = Na2CO3,
2NaOH + CO2 = Na2CO3 + H2O,
NaOH + CO2 = NaHCO3.
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2.
Получение
Получают углекислый газ термическим разложением солей угольной кислоты (карбонатов), например, обжиг известняка:
CaCO3 = CaO + CO2,
или действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl = CaCl2 + H2O + CO2,
NaHCO3 + HCl = NaCl + H2O + CO2.
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Охарактеризуйте химические свойства диоксида углерода?
Как избавиться от временной жесткости воды?
Какая качественная реакция на карбонат ионы?
Выполните задания
№ 1. Закончите уравнения осуществимых химических реакций:
CO 2+ KOH =
CO + Al =
H2CO3+ K2SO4 =
CO2(изб ) + NaOH =
С O2+ Na2O =
CaCO3+ CO2 + H2O =
CO2+ Ca(OH)2 =
CO + CaO =
CO2+ H2SO4 =
Ca(HCO3)2+ Ca(OH)2=
H2CO3+ NaCl =
C + ZnO =
№2. Осуществите превращения по схеме:
1) Al 4 C 3→ CH 4→ CO 2→ CaCO 3→ Ca( HCO 3)2→ CaCO 3
2) Ca → CaC 2→ Ca( OH )2→ CaCO 3→ CO 2→ C
3) CO2 → H2CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
№3. Решите задачи.
Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим
ЛАБОРАТОРНАЯ РАБОТА № 3
Тема. Химические свойства металлов.
Цель: закрепить знания студентов о химических свойствах металлов, развивать познавательную активность, умение делать обоснованные выводы.
Задание. Проработайте теоретический материал:
Общие физические свойства
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду Au,Ag,Cu,Sn,Pb,Zn,Fe уменьшается.
Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
Электропроводность.Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду Ag,Cu,Al,Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
Твердость.Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
Плотность.Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).Металлы, имеющие r 3 считаются«легкими металлами».
- Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -390C), самый тугоплавкий металл – вольфрам (t0пл. = 33900C). Металлы с t0пл. выше 10000C считаются тугоплавкими, ниже – низкоплавкими.
Общие Химические свойства
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов, или ряду стандартных электродных потенциалов металлов.
Электрохимический ряд напряжений металлов
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb,H2 , Cu, Hg, Ag, Рt, Au-
С помощью этого ряда можно обнаружить какой металл является активным другого. В этом ряду присутствует водород, который не является металлом. Его видны свойства приняты для сравнения за своеобразный ноль.
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
Взаимодействие с простыми веществами
Сильные восстановители: Me0 – ne  Men+
Men+
I. Реакции с неметаллами
С кислородом: 2Mg+ O2  2MgO
2MgO
С серой: Hg + S  HgS
HgS
С галогенами: Ni + Cl2 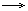 Ni+2Cl2
Ni+2Cl2
С азотом: 3Ca + N2 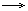 Ca3N2
Ca3N2
С фосфором: 3Ca + 2P 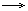 Ca3P2
Ca3P2
С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 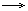 2LiH
2LiH
Ca + H2 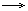 CaH2
CaH2
II. Реакции с кислотами
Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl 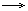 MgCl2 + H2↑
MgCl2 + H2↑
2Al+ 6HCl 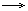 2AlCl3 + 3H2↑
2AlCl3 + 3H2↑
6Na + 2H3PO4 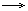 2Na3PO4 + 3H2↑
2Na3PO4 + 3H2↑
Восстановление металлами кислот-окислителей смотри в разделах: «окислительно-восстановительные реакции», «серная кислота», «азотная кислота».
III. Взаимодействие с водой
Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород:
2Na0 + 2H2O →2NaOH + H2↑
Ca0 + 2H2O → Ca(OH)2 + H2↑
Металлы средней активности окисляются водой при нагревании до оксида:
Zn0 + H2O → ZnO + H2↑
Неактивные (Au, Ag, Pt) - не реагируют.
Вытеснение более активными металлами менее активных металлов из растворов их солей:
Fe+ CuSO4 → Cu + FeSO4
Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:
2Na + Sb = Na2Sb,
3Cu + Au = Cu3Au.
Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия?;
Тип химической связи в металлах?
Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов?
Какую плотность имеют легкие металлы. Самый легкий металл?
Что такое электрохимический ряд напряжений металлов?
Лучшие проводники электричества среди металлов?
Тест: Общие свойства металлов
1 вариант
1. На внешнем уровне атомов металлов может находится:
1) 1 электрон;
2) 2 электрона;
3) 3 электрона;
4) чаще от 1 до 3 электронов.
2. Правильными являются утверждения:
А) все металлы пластичны;
Б) при увеличении порядкового номера элемента в периоде металлические свойства элементов увеличиваются;
1) верно только А;
2) верно только Б;
3) верны оба утверждения;
4) оба утверждения не верны. .
3. К тугоплавким металлам относится:
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4)  .
.
4. Нержавеющая сталь содержит:
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4)  .
.
5. Электропроводность металлов увеличивается:
1) при уменьшении температуры;
2) при увеличении температуры;
3) не зависит от температуры;
4) электропроводность разных металлов в зависимости от температуры изменяется по – разному .
6. В электрохимическом ряду напряжения металлов слева направо:
1) восстановительные свойства металлов увеличиваются;
2) восстановительные свойства металлов уменьшаются;
3) окислительные свойства катионов металлов уменьшаются;
4) восстановительные свойства металлов сначала уменьшаются, а затем увеличиваются.
7. Металлы III группы главной подгруппы взаимодействуют с хлором с образованием хлоридов состава:
1)  ; 2)
; 2) ; 3)
; 3)  ; 4)
; 4)  .
.
8. Выберите правильное утверждение:
калий:
1) взаимодействует с водой при нагревании с образованием щелочи;
2)взаимодействует с водой при комнатной температуры с образованием щелочи;
3) взаимодействует с водой при нагревании с образованием оксида;
4) не взаимодействует с водой.
9. Железо взаимодействует с раствором:
1)  ; 3)
; 3)  ;
;
2)  ; 4)
; 4)  .
.
10. Соляная кислота не взаимодействует со всеми металлами ряда:
1)  ; 3)
; 3)  ;
;
2)  ; 4)
; 4)  .
.
11. Металл, который нельзя использовать для вытеснения других металлов:
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4)  .
.
12. В самородном состоянии в природе встречается:
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4)  .
.
13. Метод переработки руд, основанный на химических реакциях, происходящих при высокой температуре, называется:
1) гидрометаллургия; 3) электрометаллургия;
2) пирометаллургия; 4) металлотермия.
14. Водород восстанавливает металл из оксида:
1)  ; 3)
; 3)  ;
;
2)  ; 4)
; 4)  .
.
15. Металл, ускоряющий коррозию железа, – это:
1)  ; 2)
; 2)  ; 3)
; 3)  ; 4)
; 4)  .
.
16. Масса гидроксида натрия, образующегося при растворении 46 г натрия, равна:
1) 40 г; 3) 80 г;
2) 16 г; 4) 20 г.
ЛАБОРАТОРНАЯ РАБОТА № 4
Тема. Решение экспериментальных задач.
Цель: закрепить знания о свойствах металлов и соединений металлических элементов; применить полученные знания при проведении опытов и объяснении их результатов.
Задание. Проработайте теоретический материал:
Генетические связи - это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
металл→основный оксид→щёлочь→соль
Например, K→K2O→KOH→KCl
металл→основный оксид→соль→нерастворимое основание→
→основный оксид→металл
Например, Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu
Среди неметаллов также можно выделить две разновидности рядов:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P2O5→H3PO4→Na3PO4
неметалл→кислотныйоксид→соль→кислота→кислотныйоксид→неметалл
Например, Si→SiO2→Na2SiO3→H2SiO3→SiO2→Si
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Что такое генетическая связь?
Какие разновидности связи вы знаете среди металлов?
Осуществите превращения (по выбору преподавателя):
Na→NaOH→Na2SO4→NaCl
Al → AlCl3→Al(OH)3→ Al2O3
Сu → CuO → CuCl2→Cu(OH)2→CuSO4 → CuCl2 →Cu(OH)2→CuO→Cu
С→СО2→СаСО3 → Са(HCO3)2 →СаСО3→СО2→ C
ЛАБОРАТОРНАЯ РАБОТА № 5
Тема. Качественное определение Карбона, Гидрогена и Хлора в органических веществах.
Цель: исследовать химические свойства Карбона, Гидрогена и Хлора.
Задание. Проработайте теоретический материал:
Благодаря строению органические вещества имеют различныесвойства. Например, молекулы полиэтилена имеют форму неразветвленныхкарбоновых цепей, а молекулы аспирина – форму шестичленных карбоновых колец.
Есть соединения, содержащие в молекуле один атом Карбона, а есть такие, в состав которых входят тысячи этих атомов. Кроме них, молекулы органических веществ могут содержать атомы Гидрогена, Оксигена, Нитрогена, Галогенов, Сульфуру, Фосфора и некоторых других элементов. Органические вещества образуются преимущественно благодаря ковалентным связям, хотя есть среди них и ионы соединения.
Кристаллические решетки органических соединений молекулярные, через это они легкоплавкие, часто имеют запах. В отличие от тугоплавких, устойчивых к нагреву ионных неорганических веществ (температура плавления хлорида натрия составляет 8000С), органические сгорают с образованием воды, углекислого газа и выделением теплоты или разлагаются при нагревании до 300-4000С. Горючесть органических веществ обусловливает их использование в виде топлива и горючего (уголь, древесина, керосин, бензин и т.п.).
Справка:
Парафин – смесь твердых высокомолекулярных насыщенных углеводов белого
и желтого цвета. tпл = 50-550С.
Хлороформ – бесцветная жидкость с характерным запахом; tкип = 61,150С.
Дихлорэтан – бесцветная жидкость с сильным запахом; tкип = 83,50С.
Качественный анализ органического вещества сводится к определению содержания в нем тех или иных элементов. После разрушения молекулы ее атомы образуют характерные минеральные соединения, открываемые обычными качественными реакциями.
О наличии углерода можно судить по обугливанию органических веществ при нагревании. Более общим методом определения С и Н является окисление органического вещества оксидом меди(II) (сжигание с СuO). При этом углерод окисляется до СО2 (обнаружение известковой Са(ОН)2 или баритовой Ba(OH)2 водой по помутнению, а водород образует воду, которая с безводным сульфатом меди(II) дает кристаллогидрат CuSO4•5H2O голубого цвета).
Определение галогенов производят по Бейльштейну.
Проба Бейльштейна. Если внести в пламя окисленную медную проволоку, на которую помещено органическое вещество содержащее галоген, то пламя окрашивается в сине-зеленый цвет.
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Как распознать наличие ионов хлора в веществе?
Как определить наличие углерода в веществе?
Что такое органические соединения?
ЛАБОРАТОРНАЯ РАБОТА № 6
Тема. Свойства уксусной кислоты.
Цель: исследовать физические и химические свойства уксусной кислоты.
Задание. Проработайте теоретический материал:
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается с многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
Химические свойства
Диссоциация
Уксусная кислота диссоциирует по уравнению:
СН3-СООН → СН3СОО¯ + Н+
СН3-СООН + индикатор → красная окраска
рН
СН3-СООН → СН3СОО¯ + Н+
Кислотные свойства
Уксусная кислота проявляет кислотные свойства.
Карбоноваякислота + Me→ Соль и Н2
СН3- СООН + Mg → (CH3-COO)2Mg + Н2
СН3-СООН + MeО → Соль и вода
2СН3- СООН + MgO → (CH3-COO)2Mg + Н2O
СН3-СООН + щёлочь → Соль и вода
СН3- СООН + NaOH → СН3- COONa + Н2O
СН3-СООН + соль → соль* + кислота*
2СН3- СООН + Na2CO3 → 2CH3- COONa + СO2 + Н2O
Области применения уксусной кислоты
70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % – уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности - окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Большое количество уксусной кислоты применяется в химической промышленности, для синтеза малеинового ангидрида, хлоруксусной кислоты, а также для производства ацетатов (солей и эфиров уксусной кислоты).
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Что такое карбоновые кислоты?
Как называется функциональная группа карбоновых кислот?
Какие виды изомерии характерны для карбоновых кислот?
Как диссоциируют в водном растворе карбоновые кислоты? Какова их сила?
Осуществить превращение:
С → CH4 → С2Н4 → С2Н5ОН → СНз-СОН → СНз-СООН → СНз-СООК
Осуществите превращения:
 .
.
6. Даны вещества:
а)  б)
б) 
К какому классу органических веществ относится каждое из веществ? Приведите формулу одного гомолога и одного изомера для каждого из веществ. Назовите исходные вещества.
7. Какой обьем воздуха (н.у.) потребуется для полного сжигания 11,2 л пропана?
ЛАБОРАТОРНАЯ РАБОТА № 7
Тема. Решение экспериментальных задач.
Цель: обобщить и закрепить знания об органических веществах на практике, доказать, что между органическими и неорганическими веществами существует тесная связь.
Задание. Проработайте теоретический материал:
В неорганической химии весьма важным является знание качественных реакций на основные катионы и анионы, а также умение записывать реакции в молекулярном и ионов виде. Нижеприведенная таблица помогает сгруппировать реакции и представить их в компактном виде.
Таблица 1
Характерные химические реакции на ионы
| Катион | Характерные реакции |
| Ag+ | AgNO3 + NaCl = AgCl↓ + NaNO3 Выпадает осадок белого цвета. 2AgNO3 + Na2CrO4 = Ag2CrO4↓ + 2NaNO3 Выпадает осадок желтого цвета. |
| Pb2+ | Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3 Выпадает осадок желтого цвета. |
| Ba2+ | BaCl2 + Na2CrO4 = BaCrO4↓+ 2NaCl Выпадает осадок белого цвета нерастворимый в уксусной кислоте. |
| Ca2+ | CaCl2 + H2C2O4  CaC2O4↓ + 2HCl CaC2O4↓ + 2HCl Выпадает осадок белого цвета. |
| Al3+ | Al2(SO4)3 + 6NaOH(недостаток) = 2Al(OH)3↓ + 3Na2SO4 Выпадаетосадокбелогоцвета. Al(OH)3 +3NaOH(избыток) = Na3[Al(OH)6] Осадок растворяется в избытке раствора щелочи. Na3[Al(OH)6] + NH4Cl(нас.р-р) = Al(OH)3↓ + NH3 + NaCl + NaOH Вновь выпадает осадок белого цвета. |
| Zn2+ | ZnSO4 + 2NaOH(недостаток) = Zn(OH)2↓ + Na2SO4 Выпадает осадок белого цвета. Zn(OH)2 + 2NaOH(избыток) = Na2[Zn(OH)4] Осадок растворяется в избытке раствора щелочи. Na2[Zn(OH)4] +4NH4Cl(нас.р-р) = [Zn(NH3)4]Cl2+ 2NaCl + 4H2O Не наблюдается выпадение осадка – этой реакцией катион Zn2+отличается от катиона Al3+. |
| Cr3+ | CrCl3 + 3NaOH(недостаток) = Cr(OH)3↓ + 3NaCl Выпадает осадок зеленого цвета. Cr(OH)3 + 3NaOH(избыток) = Na3[Cr(OH)6] Осадок растворяется в избытке раствора щелочи. |
| Fe2+
Fe2+ | FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 Выпадает осадок белого цвета. 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Осадокбуреетнавоздухе. FeSO4 + K3[Fe(CN)6] = KFe[Fe(CN)6] ↓ + K2SO4 Выпадает осадок синего цвета. |
| Fe3+ | FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl Выпадаетосадоксинегоцвета. FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl Роданид железа(III) – темно-красного цвета. |
| Cu2+ | CuSO4 + 4NH4OH = [Cu(NH3)4] SO4 + 4H2O Образуется комплексная соль фиолетового цвета. |
| NH4+ | NH4Cl + NaOH  NH3↑ + NaCl + H2O NH3↑ + NaCl + H2O Ощущается неприятный запах. |
| CO32- | Na2CO3 + 2HCl = CO2↑ + 2NaCl + H2O |
| SiO32- | Na2SiO3 + NH4OH = H2SiO3↓ + NH4Cl Выпадает в осадок гель кремниевой кислоты. |
| Cl- | KCl + AgNO3 = AgCl↓ + KNO3 Выпадает осадок белого цвета. AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O Осадок растворяется в избытке раствора аммиака. |
| I- | 2KI + Pb(NO3)2 = PbI2↓ + 2KNO3 Выпадает осадок желтого цвета. |
| SO42- | Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl Выпадает осадок белого цвета. |
| S2- | Na2S + 2AgNO3 = Ag2S↓ + 2NaNO3 Выпадает осадок черного цвета. |
| CH3COO- | 2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4 Ощущается запах уксусной кислоты. |
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Что такое качественная реакция?
Как, имея в своем распоряжении только соляную кислоту, распознать карбонат бария, сульфат бария, сульфит бария? Ответ проиллюстрируйте уравнениями реакций.
Как распознать наличие йода в веществе?
Как определить в двух неизвестных пробирках наличие железа (ΙΙ)сульфат и железа (ΙΙΙ) хлорид?
Предложите способ распознавания растворов хлорида натрия, хлорида бария и хлорида алюминия. Приведите необходимые уравнения реакций, укажите их признаки.
Предложите способ распознавания растворов хлорида калия, хлорида натрия, хлорида магния и хлорида бария. Приведите необходимые уравнения реакций, укажите их признаки.
ЛАБОРАТОРНАЯ РАБОТА № 8
Тема. Изучение свойств полимеров.
Цель: исследовать и сравнить некоторые физические и химические свойства природных, искусственных и синтетических волокон.
Задание. Проработайте теоретический материал:
Полимеры – высокомолекулярные соединения, которые характеризуются молекулярной массой от нескольких тысяч до многих миллионов. Молекулы полимеров, называемые макромолекулами, состоят из большого числа повторяющихся звеньев. Реакцию образования полимера из мономера называют полимеризацией.
Вследствие большой молекулярной массы макромолекул полимеры приобретают специфические свойства и их выделяют в особую группу соединений.
Отдельную группу составляют олигомеры, которые по значению молекулярной массы занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями.
В зависимости от химического состава, строения и взаимного расположения макромолекул свойства полимеров могут меняться в очень широких пределах. Благодаря механической прочности, эластичности, электроизоляционным и другим свойствам изделия из полимеров применяют в различных отраслях промышленности и в быту.
Основные типы полимерных материалов – пластические массы, резины, волокна, лаки, краски, клеи, ионообменные смолы. В технике полимеры нашли широкое применение в качестве электроизоляционных и конструкционных материалов.
Полимеры – хорошие электроизоляторы, широко используются в производстве разнообразных по конструкции и назначению электрических конденсаторов, проводов, кабелей, На основе полимеров получены материалы, обладающие полупроводниковыми и магнитными свойствами. Значение биополимеров определяется тем, что они составляют основу всех живых организмов и участвуют практически во всех процессах жизнедеятельности.
Волокна – природные или искусственные высокомолекулярные вещества, отличающиеся от других полимеров более высокой степенью упорядоченности молекул и, как следствие, особыми физическими свойствами, позволяющими использовать их для получения нитей.
Искусственные волокна – продукты химическое переработки высокомолекулярных природных веществ (целлюлозы, природного каучука, белков).
Синтетические волокна – вырабатываемые из синтетических полимеров (полиамидного, полиэфирного, полиакрилонитрильного и поливинилхлоридного волокон).
Таблица 1
Некоторые свойства пластмасс
| Название пластмассы | Внешний вид | Проба на горение | Отношение к нагреванию |
| Полиметил- метакрилат | Бесцветный или ярких цветов. Прозрачный, блестящий | Горит синеватым пламенем с характерным потрескиванием, распространяя характерный резкий запах эстеров | При нагревании не размягчается, деполимеризуется до мономера, который обесцвечивает раствор брома и калий перманганата |
| Фенол- формальдегидные смолы | Коричневые, черные, бордовые, под мрамор. Твердые, неэластичные | Горят только в пламени спиртовки, коптящим пламенем | При нагревании не размягчаются, распространяют резкий запах фенола |
| Политетрафлуор- этилен | Белый с перламутровым оттенком, жирный на ощупь. Внешним видом напоминает полиэтилен | Не горит | В результате нагревания в пламени становится прозрачным |
| Поливинил - ацетат | Прозрачный, плотный | При термическом разложении и горении ощущается запах этановой кислоты | Распространяет запах этановой кислоты |
| Полиэтилен | Белый с перламутровым оттенком, желтоватый или окрашенный в светлые цвета. Твердый, в тонких листах эластичный. Жирный на ощупь. В тонких пленках прозрачный | Горит слабым синеватым пламенем, капает во время горения, распространяя запах расплавленного парафина | Быстро размягчается и плавится, разлагается, распространяя запах расплавленного парафина |
| Поливинил- хлорид | Белый или окрашенный в разные цвета. Пластикат- эластичный, непластифицированный– твердый продукт | В пламени горит, образуя копоть. Вне пламени не горит. При горении распространяется запах хлороводорода, нижняя часть пламени зеленоватая. Если внести в его пламя медную проволочку, появляется зеленая окраска | Размягчается при 60 °С. При сильном нагревании разлагается с выделением хлороводорода |
| Полистирол | Бесцветный или ярких цветов. Твердый и хрупкий | Горит коптящим пламенем, распространяя сладковатый запах стирола | При нагревании быстро размягчается, вытягивается в нити, раскладывается с выделением стирола |
Таблица 2
Некоторые свойства натуральных, искусственных и синтетических волокон
| Название волокна | Внешний вид | Изменения при нагревании | Проба на горение | Влияние на волокно щелочи и кислоты |
| Разбавленный раствор натрий гидроксида | Концентрированный раствор натрий гидроксида | Разбавленная сульфатная кислота | Концентрированная сульфатная кислота |
| Хлопок | Волокна прямые, одинаковые по толщине | Не плавится | Горит ярким пламенем с образованием ажурного пепла, распространяя запах жженой бумаги | Теряет прочность при кипячении | Набухает, а иногда разрушается | Разрушается | Разрушается |
| Шерсть | Волнистые волокна с незначительным блеском | Вследствие сильного нагревания спекается | Горит плохо, распространяя запах жженого волоса или рога | Растворяется при кипячении | Разрушается | Заметных изменений не происходит | Набухает |
| Вискоза | Одинаковые по толщине, гладкие волокна, со стекловидным блеском или матовые | Не плавится | Горит ярким пламенем, распространяя запах жженой бумаги | При комнатной температуре изменения не происходят | Сильно набухает и теряет прочность | Разрушается | Разрушается |
| Ацетатное волокно | Одинаковые по толщине волокна, гладкие, мягкие, шелковистые | Плавится, образуя маленький блестящий, светлый шарик | Горит, образуя маленький липкий шарик. Запах продуктов горения кислый | Медленно разрушается | Растворяется | Разрушается | Разрушается |
| Капрон | Волокна одинаковые по толщине, гладкие, со стекловид ным блеском, сухие, упругие | Плавится, образуя твердый, блестящий, темный ша рик | Горит плохо даже в пламени, распространяя неприятный запах | Не взаимодействует | Не взаимодействует | Не взаимодействует | Растворяется в течение 5-10 мин |
| Нейлон | Волокна одинаковые по толщине, гладкие со стекловидным блеском | Плавится, скручиваясь | Горит голубоватым пламенем,распространяяхарактерныйзапах прелыхорехов | Не взаимодействует | Не взаимодействует | Не взаимодействует | Растворяется |
| Лавсан | Волокна одинаковые по толщине, округленные, матовые | Плавится, Образуя твердую смолу | Горит вспышками коптящим пламенем, распространяя резкий запах . | Взаимодействует только при кипячении | Растворяется при кипячении | Обугливается | Разрушается при кипячении |
| Нейлон | Волокна одинаковые по толщине, скрученные, матовые | Плавится, Образуя шарик неправильной формы | Горит коптящим пламенем, распространяя резкий запах. | Не взаимодействует | Растворяется при кипячении | Не взаимодействует | Не взаимодействует |
Для грамотного использования потребителями изделий из пластмасс (полимеров) на изделиях имеется маркировка, указывающая полимер.
| Рис. 1
Полиэтилен-
терефталат | Рис. 2
Полиэтилен
низкого давления | Рис. 3
Поливинил-
хлорид | Рис. 4
Полиэтилен
высокого давления |
|
Рис. 5
Полипропилен |
Рис. 6
Полистирол |
Рис. 7
Другие
|
|
Низкая химическая активность делает полимеры относительно безопасными в экологическом плане, но современные исследования выявили и возможность нанесения полимерами вреда.
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Дайте определения следующим понятиям:
Полимеры;
Мономеры;
Степень полимеризации.
В чем разница между реакциями полимеризации и поликонденсации?
Благодаря чему из полиэтилена можно вырабатывать и пленку и посуду?
Какие полимеры называются термореактивными?
Дайте классификацию волокон.
Выберите из предложенных вариантов ответов правильный:
Полимеры – это органические вещества, имеющие большую молекулярную массу, молекулы которых состоят из множества одинаковых повторяющихся групп атомов.
Молекулы мономеров называют макромолекулами.
Структурное звено совпадает по химическому составу с молекулой мономера в том случае, когда полимер получен реакцией полимеризации.
Реакцией поликонденсации называется процесс объединения множества одинаковых молекул мономера в макромолекулу полимера.
Стереорегулярные полимеры имеют строго упорядоченное строение макромолекул.
Поливинилхлорид получают с помощью реакции сополимеризации.
Полиэтилен обладает большей химической стойкостью по сравнению с золотом и платиной.
Полистирол сгорает на воздухе с выделением большого количества сажи.
Термопластичность – это способность полимера размягчаться при нагревании и затвердевать при последующем охлаждении.
Термореактивные полимеры перерабатывают в готовые изделия способом литья под давлением.
Пластификатор – это вещество, облегчающее механическую переработку пластмассы за счет повышения ее пластичности.
Тефлоновые покрытия можно эксплуатировать при температуре 500 °С.
Эластомеры – это полимерные материалы, обладающие свойством эластичности.
Бутадиенстирольный каучук обладает повышенной водо- и маслостойкостью.
Капрон, лавсан, нейлон являются синтетическими волокнами.
Синтетические волокна получают путем химической переработки природного волокнистого материала целлюлозы.
Синтетическое волокно нитрон получают реакцией полимеризации.
Капрон и нейлон являются полиэфирными волокнами.
ЛАБОРАТОРНАЯ РАБОТА № 9
Тема. Изучение и сравнение свойств синтетических моющих средств и мыла.
Цель: исследовать моющее действие растворов мыла и стирального порошка.
Задание. Проработайте теоретический материал:
Мыла – это натриевые или калиевые соли высших жирных кислот, гидролизующихся в водном растворе с образованием кислоты и щелочи.
Образовавшаяся щелочь эмульгирует, частично разлагает жиры и освобождает таким образом прилипшую к ткани грязь. Карбоновые кислоты с водой образуют пену, которая захватывает частицы грязи. Калиевые соли по сравнению с натриевыми лучше растворимы в воде и поэтому обладают более сильным моющим свойством.
Гидрофобная часть мыла проникает в гидрофобное загрязняющее вещество, в результате поверхность каждой частицы загрязнения оказывается окруженной оболочкой гидрофильных групп. Они взаимодействуют с полярными молекулами воды. Благодаря этому ионы моющего средства вместе с загрязнением отрываются от поверхности ткани и переходят в водную среду. Так происходит очистка загрязненной поверхности моющим веществом.
Состав мыла
Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли – жидкие мыла.
Мыло – натриевые или калиевые соли высших карбоновых кислот, полученные в результате гидролиза жиров в щелочной среде
Строение мыла можно описать общей формулой:
R – COOМ,
где R – углеводородный радикал, M – металл.
| Твёрдое мыло — RCOONa |
| Жидкое мыло – RCOOK |
Преимущества мыла:
а) простота и удобство в использовании;
б) хорошо удаляет кожное сало
в) обладает антисептическими свойствами
В жесткой воде моющая способность мыла резко снижается. Растворимые натриевые или калиевые соли жирных кислот вступают в реакцию обмена с имеющимися в жесткой воде растворимыми кислыми карбонатами щелочно-земельных металлов, главным образом кальция:
2С15Н31СООNa + Са(НСО3)2 → (С15Н31СОО)2Са + 2NaНСО3.
2С17Н35СООNa + СаСI2 =(C17 H35COO)2Ca + 2NaCI
Получающиеся при этом соли высших жирных кислот образуют липкие осадки.
Учащиеся определяют жесткую и мягкую воду при помощи раствора мыла.
В той пробирке, где удалось сбить растворенное мыло в пену, – мягкая вода.
СМС (синтетические моющие средства) – Основой синтетических моющих средств (детергентов) является Na-cольалкансульфокислоты,доля которой достигает 30%.
Общая формула синтетических моющих средств:

Производство этих веществ основано на продуктах переработки нефти.
Синтетические моющие средства – сложная композиция, содержащая отбеливатели (ультрамарин, перборат натрия) и пенообразователи (аминоспирты). Они одинаково хорошо моют как в мягкой, так и в жесткой воде.
В то же время детергенты очень медленно подвергаются биоразложению. Накапливаясь в водоемах, они ведут к сильному разрастанию зеленых растений, что вызывает заболачивание.
Эксперимент:
Можно сравнить мыла и СМС (стиральный порошок) проверив с помощью индикаторов, какая среда характерна для наших моющих средств.
При добавлении лакмуса в раствор мыла и в раствор СМС он приобретает синий цвет, а фенолфталеин – малиновый, то есть реакция среды щелочная. Кстати, если моющее средство предназначено для стирки хлопчатобумажных тканей, то реакция среды должна быть щелочной, а если для шелковых и шерстяных тканей – нейтральной.
А что происходит с мылом и СМС в жесткой воде?
Добавим в одну пробирку раствор мыла, а в другую раствор СМС, взболтаем их. Что вы наблюдаете? В эти же пробирки добавим хлорид кальция и взболтаем содержимое пробирок. Что вы наблюдаете теперь? Раствор СМС пенится, а в растворе мыла образуются нерастворимые соли:
2С17Н35СООNa + СаСI2 =(C17 H35COO)2Ca + 2NaCl
СМС образуют растворимые соли кальция, которые также обладают поверхностно-активными свойствами.
Использование чрезмерного количества этих средств приводит к загрязнению окружающей среды.
Многие ПАВ трудно поддаются биологическому разложению. Поступая со сточными водами в реки и озера, они загрязняют окружающую среду. В результате образуются целые горы пены в канализационных трубах, реках, озерах, куда попадают промышленные и бытовые стоки. Использование некоторых ПАВ приводит к гибели всех живых обитателей в воде. Почему раствор мыла, попадая в реку или озеро, быстро разлагается, а некоторые ПАВ нет? Дело в том, что мыла, полученные из жиров, содержат неразветвленные углеводородные цепи, которые разрушаются бактериями. В то же время в состав некоторых СМС входят алкилсульфаты или алкил(арил)сульфонаты с углеводородными цепями, имеющими разветвленное или ароматическое строение. Такие соединения бактерии «переварить» не могут. Поэтому при создании новых ПАВ необходимо учитывать не только их эффективность, но и способность к биологическому распаду – уничтожению некоторыми видами микроорганизмов.
Вывод: моющая способность моющих средств зависит от строения молекулы, мыло способно резко снижать поверхностное натяжение воды, вызывает смачивание поверхностей и способствует образованию эмульсий.
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Что такое жиры?
Что такое мыла?
Почему раствор мыла в воде имеет щелочную реакцию?
Что такое жесткость воды?
Какие способы умягчения воды вам известны?
Что эффективнее использовать при стирке: мыло или СМС? Ответ обоснуйте.
Почему СМС загрязняют окружающую среду? Ответ обоснуйте?
ЛАБОРАТОРНАЯ РАБОТА № 10
Тема. Удаление загрязнений с поверхности тканей.
Цель: научиться удалять с поверхности ткани загрязнения (пятна) разного происхождения.
Задание. Проработайте теоретический материал:
Основные виды загрязнений ткани
К жирным пятнам относятся непосредственно жирные и масляные пятна от пищи, пот и остатки отшелушенной кожи, собирающие на себе частички пыли и образующие масляную пленку; масла минеральные и синтетические, сажа и др. Эти пятна составляют примерно 70% от общего числа загрязнений. Свежее пятно всегда темнее ткани, а с течением времени приобретает матовый оттенок. Жировые пятна имеют размытые контуры.
Это окрашенные небелковые пятна растительного или животного происхождения – кофе, чай, какао, овощи, фрукты, вино и т.д. Пятна составляют около 10-20% от общего числа загрязнений. Они имеют контуры четкие и более темные, чем само пятно. Цвет их от желтоватого до коричневого.
Белковые – около 10% (молоко, кровь, яйца, мороженое и т.д.). Жир, входящий в эти продукты, проникает глубоко в ткань, а само пятно остается на поверхности.
Многие пятна от пищи являются смешанными, так, например, пятно от щей.
Под действием света и кислорода воздуха многие пятна окисляются и по прошествии времени меняют оттенок от желтого до красно-коричневого. Окисляются пятна от фруктов, ягод, вина, кофе, чая, косметики. Жирные, масляные, крахмальные и белковые (частично) загрязнения изначально не окрашены, либо имеют слегка желтоватый оттенок. Однако со временем пятна становятся желтыми и, абсорбируя на себе все пигментные загрязнения пыли и сажи, резко проявляются на поверхности ткани. Частицы грязи располагаются между отдельными нитями и волокнами ткани, а также на свободной поверхности волокон. И чем они меньше, тем глубже проникают в ткань. Следовательно, чем плотнее ткань и ровнее ее поверхность, тем меньше она загрязняется.
Прочность удержания загрязнений зависит также и от «природы» грязи. Сухие пигментные загрязнения наиболее прочно удерживаются полиамидными и полиэфирными волокнами, а слабее всего – шерстяными. Жировые загрязнения также наиболее прочно удерживаются синтетической тканью, а наименее – шерстью. При стирке белья такие загрязнения, как соли, частицы пыли, и мочевина могут быть просто смыты чистой водой. Иначе обстоит дело с клейкими или нерастворимыми в воде веществами. Обычно они состоят из жиров и белков, имеющих твердые грязевые включения. При их удалении, а также при выведении трудно отстирываемых пятен (от чая, кофе, сока, вина, травы, косметики и т.д.) без синтетических моющих средств не обойтись.
Распознавание видов пятен
Важным условием успешного удаления пятен является определение их происхождения. Необходимо также знать материал, на котором образовалось пятно. Если вид материала неизвестен, от скрытого места одежды (подгиб или шов) отрежьте небольшой кусок и исследуйте его. Есть смысл сделать на этом куске материала такое же пятно и проверить действие пятновыводителя. Такое испытание особенно важно, когда обрабатываются аппретированные или цветные материалы. Если аппрет или краситель неустойчив к действию используемых реактивов, после обработки останутся следы, которые часто хуже, чем сами пятна.
В отношении загрязнений действует несколько аксиом:
Свежие пятна отстирываются легче «выдержанных».
При стрике очень грязных вещей следует использовать большее количество порошка и применять предварительное замачивание.
Такие вещи лучше стирать отдельно от относительно чистых, иначе сильные загрязнения могут равномерно распределиться по всему белью и тем самым испортить не очень грязные вещи.
С разных тканей одни и те же пятна могут отстирываться по-разному, что определяется природой волокна и его структурой. Волокна шерсти, например, имеют зазубрины, а волокна натурального шелка, искусственные и синтетические волокна имеют гладкую и ровную поверхность, оттого отстирываются легче.
Хлопчатобумажные и льняные ткани прочнее других удерживают загрязнения. Это объясняется тем, что поверхность волокон, из которых они сделаны, рыхлая, бугристая, а на такой поверхности частицы грязи удерживаются прочнее, чем на гладкой.
Общие правила при выведении пятен любого происхождения
Используя тот или иной растворитель, важно запомнить, что:
Спирты и кислоты разрушают некоторые краски.
Ацетон и уксусная кислота разрушают ткани из ацетатного шелка.
Хлорная известь разрушают хлопчатобумажные ткани.
Щелочи и отбеливающие вещества применяются только для обработки белых тканей.
Перед обработкой пятна, обязательно тщательно вычистить вещь от пыли.
Перед обработкой пятен проверять устойчивость окраски – обязательно. Можно воспользоваться лоскутком, пришитым к вещи. А если он срезан и потерян – на скрытой детали.
Обрабатывать пятно надо по направлению от краев к середине.
К пятну подкладывают с изнанки чистую белую тряпку, сложенную в несколько слоев.
Чтобы не появились разводы и ореол, ткань вокруг пятна надо смочить водой, бензином или присыпать тальком, крахмалом.
Пятновыводители на небольшие пятна удобно наносить пипеткой или деревянной палочкой. При чистке пользуются ватой, тканью, жесткой кистью или щеткой.
При сдаче работы преподавателю, будьте готовы ответить на следующие
вопросы:
Какие виды загрязнений ткани вы знаете?
На чем основывается удаление загрязнений (пятен) с поверхности ткани?
Объясните, чем может отличаться друг от друга удаление с поверхности свежих загрязнений от застаревших?
С различных тканей удаление пятен происходит одинаково или нет? Чем это обусловлено? Ответ обоснуйте.
ЗАКЛЮЧЕНИЕ
Данные указания являются актуальными при проведении лабораторных и практических работ по химии в средних специальных учебных заведениях. Их применение существенно облегчает задачу преподавателя и облегчает работу студентов.
В разработке рассмотрены лабораторные работы по всем основным темам курса органической и общей химии в соответствии с рабочей программой по химии на 2007 год.
Работы составлены на доступном уровне для понимания учащихся. Выдержан единый стиль в оформлении и содержании, а так же логичности изложения материала.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Комплект лабораторных работ по органической химии для учащихся 10 класса с углубленным изучением химии. Составитель: А.И.Малышев. ОТИ МИФИ, 1991.
Методические разработки к лабораторным работам по курсу органической химии. Составитель: Н.Ф.Минеева. ЮУПК, 1999.
Некрасов В.В. Руководство к малому практикуму по органической химии. М.: Химия, 1975.
Кузьменко Н., Еремин В., Попков В. Химия для школьников старших классов и поступающих в вузы. М.: Дрофа, 1997.
Сорокин В.В., Свитанько И.В., Сычев Ю.Н., Чуранов С.С. Химия. Сборник задач с решениями и ответами. 10-11 классы. М.: Астрель, 2001.
Артеменко А.И. Органическая химия. Теоретические основы. Углубленный курс. М.: Просвещение, 1997.
Для заметок
Для заметок


 Получите свидетельство
Получите свидетельство Вход
Вход









 ; 2)
; 2) 








 Методические рекомендации и инструкции к лабораторным работам по химии (0.53 MB)
Методические рекомендации и инструкции к лабораторным работам по химии (0.53 MB)
 0
0 1346
1346 149
149 Нравится
0
Нравится
0


