
Тема урока:

ЦЕЛИ УРОКА :
- ЗАКРЕПИТЬ И УГЛУБИТЬ ЗНАНИЯ О СУЩНОСТИ ОВР;
- ПОЗНАКОМИТЬСЯ С МЕТОДОМ ПОЛУРЕАКЦИЙ И ЕГО ПРИМЕНЕНИЕМ В НЕОРГАНИЧЕСКОЙ И ОРГАНИЧЕСКОЙ ХИМИИ
- НАУЧИТЬСЯ СОСТАВЛЯТЬ УРАВНЕНИЯ ОВР С ИСПОЛЬЗОВАНИЕМ МЕТОДА ЭЛЕКТРОННО-ИОННОГО БАЛАНСА;
- РАЗВИТЬ НАВЫКИ В ИСПОЛЬЗОВАНИИ МЕТОДА Э.И.Б. ДЛЯ РЕШЕНИЯ РАЗЛИЧНЫХ ТИПОВ ЗАДАЧ, УПРАЖНЕНИЙ, ТЕСТОВ .

Продолжите …
- Окислительно-восстановительные реакции – это реакции……
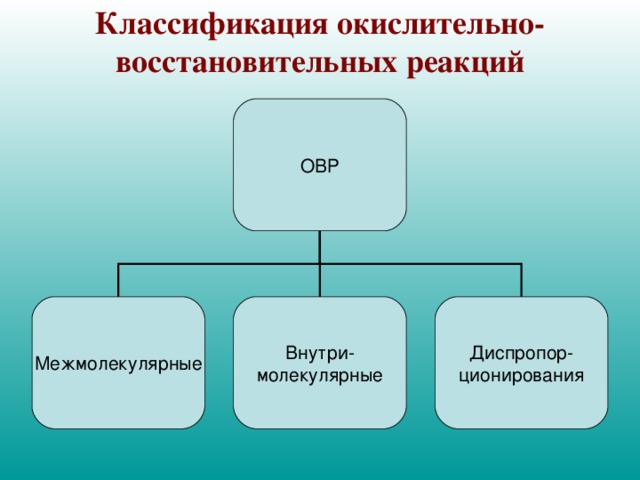
Классификация окислительно-восстановительных реакций
ОВР
Межмолекулярные
Внутри-
молекулярные
Диспропор-
ционирования

Выполните задание
- Допишите уравнения реакций, расставьте коэффициенты методом электронного баланса
С 6 C 5 CH 3 + KMnO 4 + H 2 SO 4 → C 6 H 5 COOH + ..+..+..
K 2 Cr 2 O 7 + K 2 S + H 2 O → S↓ +..+..

МЕТОДЫ СОСТАВЛЕНИЯ ОВР
- Метод электронного баланса
- Метод электронно - ионного баланса

Основное требование
Число электронов, отданных восстановителем = числу электронов, принятых окислителем

Электронно- ионный метод (МЕТОД ПОЛУРЕАКЦИЙ)
Преимущество :
при составлении полуреакций
рассматриваются
реально существующие
в растворе ионы и наглядно видна роль среды .

МЕТОД ПОЛУРЕАКЦИЙ:
Алгоритм
1. Записать в ионном виде восстановитель , окислитель и продукты их взаимодействия:
Сильные электролиты записывают в виде ионов , а
слабые электролиты -
газы↑ ,
нерастворимые вещества↓ - в виде молекул .

II . При составлении полуреакций окисления и восстановления следует учитывать следующее:
1. Если исходное вещество содержит больше атомов кислорода , чем продукт реакции, то освобождающийся кислород в форме О -2 связывается в кислых растворах ионами водорода (Н + ) - в воду в нейтральных и щелочных растворах - в гидроксид-ионы.
В кислых растворах: О -2 + 2Н + = Н 2 О
В нейтральных растворах: О -2 + Н + (НОН) = ОН -
В щелочных растворах : О -2 + Н OH = 2ОН -

Алгоритм
2. Если исходное вещество содержит меньше атомов кислорода , чем продукты реакции, то недостаток их восполняется в кислых и нейтральных растворах за счёт молекул воды , в щелочных - за счёт гидроксид-анионов .
В кислых растворах : Н 2 О = О -2 + 2Н +
В нейтральных растворах: Н 2 О = О -2 + 2 Н +
В щелочных растворах: 2ОН - = О -2 + Н 2 О
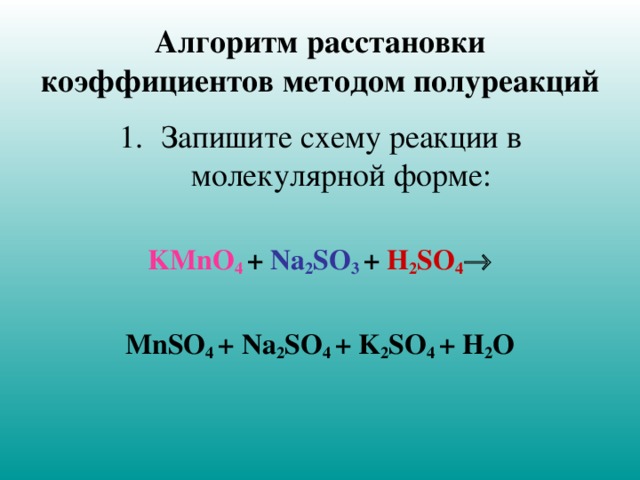
Алгоритм расстановки коэффициентов методом полуреакций
- Запишите схему реакции в молекулярной форме:
KMnO 4 + Na 2 SO 3 + H 2 SO 4
MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O

2. Составьте схему реакции в полной ионной форме, подчеркнув восстановитель и окислитель
K + + MnO 4 - + 2Na + + SO 3 2- + 2 H + + SO 4 2-
Mn 2+ + SO 4 2- +2Na + + SO 4 2- +2 K + + SO 4 2- +H 2 O
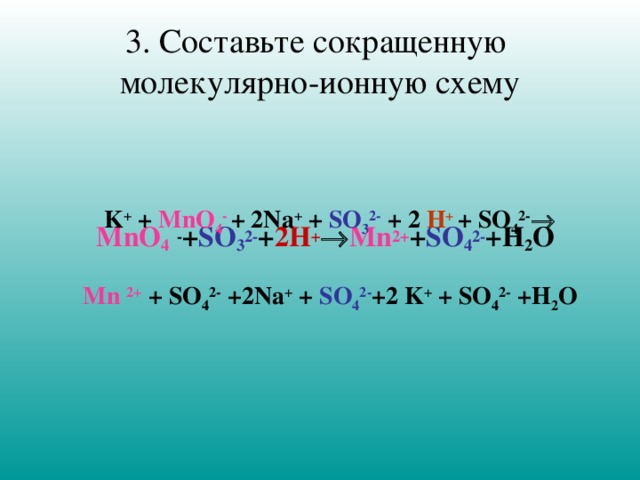
3. Составьте сокращенную молекулярно-ионную схему
MnO 4 - + SO 3 2- + 2H + Mn 2+ + SO 4 2- +H 2 O
K + + MnO 4 - + 2Na + + SO 3 2- + 2 H + + SO 4 2-
Mn 2+ + SO 4 2- +2Na + + SO 4 2- +2 K + + SO 4 2- +H 2 O

4. Определите характер среды – кислая, щелочная, нейтральная
Наличие Н + – среда кислая

5. Выписать частицы, изменившие состав и заряд:
MnO 4 - + SO 3 2- + 2H + Mn 2+ + SO 4 2- +H 2 O

6 . Составьте молекулярно-ионные уравнения для процессов окисления и восстановления с учетом характера среды
- Проверьте число атомов ( О ) в левой и правой частях уравнений
- Проверьте число атомов каждого элемента
Mn O 4 - + 8H + = Mn 2+ +4 H 2 O
S O 3 2- + H 2 O = S O 4 2- +2 H +

Проверьте суммы зарядов ионов в левой и правой частях молекулярно-ионных уравнений:
- Если сумма зарядов исходных частиц больше суммы зарядов продуктов реакции, то к левой части надо добавить соответствующее число электронов , а если меньше — вычесть
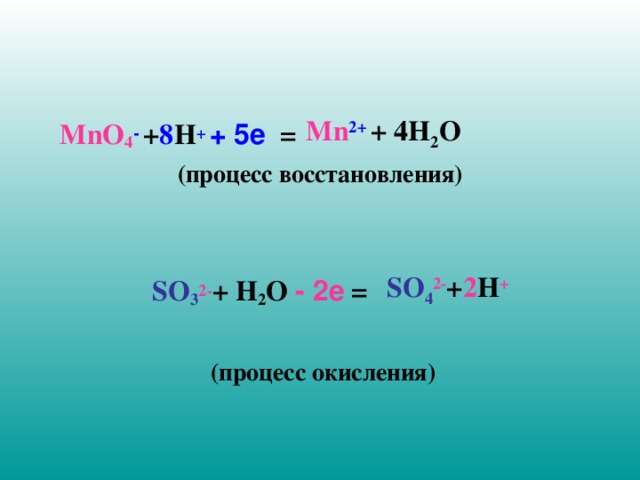
Mn 2+ + 4 H 2 O
MnO 4 - + 8 H + + 5е =
(процесс восстановления)
SO 3 2- + H 2 O - 2е =
(процесс окисления)
SO 4 2- + 2 H +

8. Найдите коэффициенты восстановителя , окислителя и продуктов их превращения. Умножьте левую и правую части обоих уравнений на найденные коэффициенты
MnO 4 - + 8 H + + 5е = Mn 2+ +4 H 2 O
SO 3 2- + H 2 O - 2е = SO 4 2- + 2 H +
2
5

Составьте сокращенное ионное уравнение окислительно-восстановительной реакции .
Для этого:
- сложите уравнения полуреакций
- сократите , если имеются, одинаковые частицы
- добавьте в левую часть уравнения необходимое число сопутствующих противоположно заряженных ионов (см. стрелки)
- то же число тех же ионов добавьте в правую часть уравнения
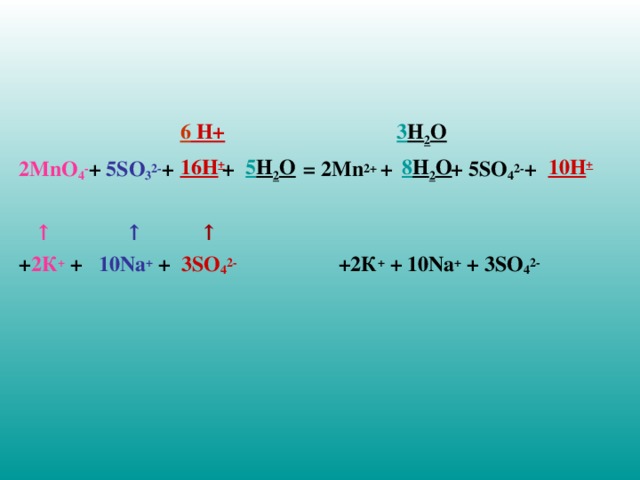
2MnO 4 - + 5SO 3 2- + + = 2Mn 2+ + + 5SO 4 2- +
↑ ↑ ↑
+ 2К + + 10 N а + + 3 SO 4 2- +2К + + 10 N а + + 3 SO 4 2-
6 H+
3 H 2 O
16H +
5 H 2 O
8 H 2 O
10H +

10. По полному молекулярно-ионному уравнению составьте полное молекулярное уравнение
2 KMnO 4 + 5 Na 2 SO 3 + 3 H 2 SO 4
2 MnSO 4 + 5 Na 2 SO 4 +K 2 SO 4 + 3 H 2 O

Пример № 2
1. Расставьте коэффициенты в уравнении реакции методом Э.И.Б.
KMnO 4 +Na 2 SO 3 + H 2 O
MnO 2 +Na 2 SO 4 + KOH

2. Составьте сокращенную молекулярно-ионную схему
MnO 4 - +SO 3 2- + H 2 O
MnO 2 +SO 4 2- + OH -
среда нейтральная

3. Составьте молекулярно-ионные уравнения для процессов окисления и восстановления с учетом характера среды
Mn O 4 - + 2 H 2 O = Mn O 2 +4 O H -
S O 3 2- + H 2 O =S O 4 2- +2H +
MnO 4 - +SO 3 2- + H 2 O
MnO 2 +SO 4 2- + OH -

4 . Проверьте суммы зарядов ионов в левой и правой частях молекулярно-ионных уравнений:
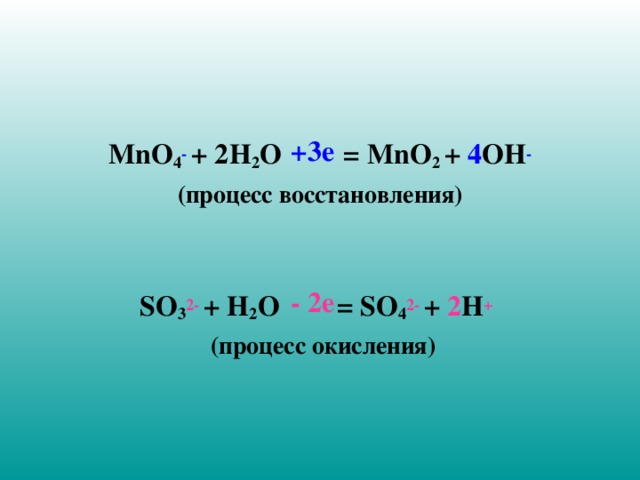
MnO 4 - + 2 H 2 O = MnO 2 + 4 OH -
(процесс восстановления)
SO 3 2- + H 2 O = SO 4 2- + 2 H +
(процесс окисления)
+3е
- 2е

5. Найдите коэффициенты восстановителя , окислителя и продуктов их превращения.
MnO 4 - + 2 H 2 O +3е = MnO 2 + 4OH - 2
SO 3 2- + H 2 O - 2е = SO 4 2- +2 H + 3

6. Составьте сокращенное ионное уравнение окислительно-восстановительной реакции.
2 MnO 4 - + 3 SO 3 2- + 4 H 2 O + 3 H 2 O = 2 MnO 2 + 8 OH - + 3 SO 4 2 + 6 H +
H 2 O
2 MnO 4 - + 3 SO 3 2- + 7 H 2 O = 2 MnO 2 + 3 SO 4 2 + 6 H 2 O + 2 OH -
↑ ↑
+2 K + +6 N а + +2 K + +6 N а +

7. По полному ионному уравнению составьте полное молекулярное уравнение
2 KMnO 4 + 3 Na 2 SO 3 +H 2 O
2 MnO 2 + 3 Na 2 SO 4 + 2 KO Н

Расставьте коэффициенты в ОВР методом полуреакций (д/з):
KMnO 4 + Na 2 SO 3 + KO Н
... + Na 2 SO 4 + …

Упражнения
1. В ОВР, схема которой
K 2 S + K 2 SO 3 + H 2 SO 4 →S + K 2 SO 4 +H 2 O ,
окислителем является вещество с формулой:
а ) K 2 S б) K 2 SO 3 в) H 2 SO 4 г) S
2. Какое из ионных уравнений процесса окисления
записано верно с учетом кислой среды раствора:
а) MnO 2 + 4H + +2e → Mn +2 +2H 2 O
б) Mn +2 + 4 H 2 O -5e → MnO 4 - + 8 H +
в) MnO 2 + 4 H 2 O -3e → MnO 4 - + 8 H +

Упражнения
3 . По приведенной электронно-ионной схеме составьте уравнение ОВР в молекулярной форме:
10 Fe 2+ -10e → 10 Fe 3+
2 MnO 4 - + 16 H + + 10e → 2 Mn 2+ +8 H 2 O
4. Определить пропущенные вещества в схеме ОВР:
K 2 Cr 2 O 7 + … + H 2 SO 4 → I 2 + Cr 2 (SO 4 ) 3 + …+ H 2 O

Домашнее задание:
- Дописать уравнение ОВР (в щелочной среде)
- Конспект


 Получите свидетельство
Получите свидетельство Вход
Вход















































 Метод полуреакций или электронно-ионного баланса (0.4 MB)
Метод полуреакций или электронно-ионного баланса (0.4 MB)
 0
0 2896
2896 220
220 Нравится
0
Нравится
0


