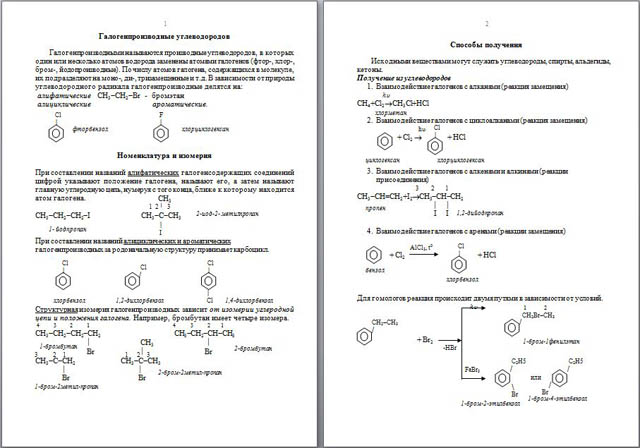
Галогенпроизводными называются производные углеводородов, в которых один или несколько атомов водорода заменены атомами галогенов (фтор-, хлор-, бром-, йодопроизводные). По числу атомов галогена, содержащихся в молекуле, их подразделяют на моно-, ди-, тризамещенные и т.д. В зависимости от природы углеводородного радикала галогенпроизводные делятся на:
- алифатические СН3-СН2-Br - бромэтан
Номенклатура и изомерия.
При составлении названий алифатических галогенсодержащих соединений цифрой указывают положение галогена, называют его, а затем называют главную углеродную цепь, нумеруя с того конца, ближе к которому находится атом галогена.
При составлении названий алициклических и ароматических галогенпроизводных за родоначальную структуру принимает карбоцикл.
Структурная изомерия галогенпроизводных зависит от изомерии углеродной цепи и положения галогена. Например, бромбутан имеет четыре изомера.
Способы получения.
Исходными веществами могут служить углеводороды, спирты, альдегиды, кетоны.
Получение из углеводородов.
1. Взаимодействие галогенов с алканами (реакция замещения)
2. Взаимодействие галогенов с циклоалканами (реакция замещения)
3. Взаимодействие галогенов с алкенами и алкинами (реакции присоединения)
4. Взаимодействие галогенов с аренами (реакции замещения)
Для гомологов реакция происходит двумя путями в зависимости от условий.
5. Взаимодействие галогенводородов с алкенами и аминами (реакции присоединения).
6. Получение из спиртов
а) взаимодействие с галогеноводородами
H2SO4(конц) связывает воду.
б) взаимодействие с галогенидами фосфора (III) и (V).
3СН3-СН2-СН + PI3 → 3 СН3-СН2-I + H3PO4
в) СН3-СН2-СН2-ОН + SOCl2 → СН3-СН2-СН2-Cl + HCl + SO2
7. Получение из альдегидов и кетонов
Физические свойства.
По числу атомов углерода:
- низшие – газы или жидкости
- средние – жидкости
- высшие – жидкости или твердые
При одинаковых радикалах температуры кипения возрастают в ряду фтор- , хлор- , бром- , йодзамещенные. Хлориды легче воды, бромиды и йодиды тяжелее воды. Низшие галогенпроизводные не растворимы в воде, растворяются в органических растворителях, токсичны, обладают наркотическим действием.
Фторпроизводные отличаются от других галогенпроизводных. Фторуглероды (углеводороды, в молекулах которых все атомы водорода замещены на фтор) устойчивы, не горючи и нетоксичны. Соединения, содержащие атомы фтора и хлора одновременно, называют фреонами. Они используются в качестве хладоагентов (холодильники, кондиционеры).
Для качественного обнаружения хлор- и бромпроизводных их вносят на медной проволоке в пламя горелки, пламя окрашивается в зеленый цвет. Это метод используется в органическом и фармацевтическом анализе.
Химические свойства.
Связь С – Hal полярна, т.к. галогены являются более электроотрицательными элементами, чем атом углерода.
1. Взаимодействие со щелочами
С2Н5-CH2 -Br + KOH → CH3-CH2-OH + KBr
2. Взаимодействие со спиртами
C2H5-OH + CH3 - I → HI + C2H5-O-CH3
3. Взаимодействие с аммиаком - NH3
NH3 + СН3-СН2-СН2-Br → [C3H7 - NH3]Br ® C3H7 - NH4.
4. Взаимодействие с солями циановодородной кислоты
СН3-СН2-Br + KCN → СН3-СН2-CN ® СН3-СН2-COOH
Правило Зайцева – атом водорода отщепляется от наименее гидрогенизированного атома углерода (от С-3, а не от С-1).
Реакции ароматических галогенпроизводных.
Галогенарены не вступают в большинство химических реакций, характерных галогенпроизводных.
Отдельные представители.
Хлорэтан – C2H5Cl – в обычных условиях газ, при t < 120С – бесцветная жидкость, огнеопасна. При попадании на кожу быстро испаряется, вызывает резкое охлаждение и понижение чувствительности кожи. Используется для местной анестезии, при травмах.
2-бром – 1,1,1-трифтор-2-хлорэтан (фторотан) – CF3CHClBr –бесцветная жидкость (tкип=510С), не горюч, наркотик, применяется для наркоза.
Тетрахлорметан (СCl4) – бесцветная жидкость, тяжелее воды. Не горюч, при соприкосновении с огнем легко испаряется, пары стелются над поверхностью пламени и ограничивают доступ кислорода, на этом основано использование CCl4 в огнетушителях.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход




 + Cl2 + HCl
+ Cl2 + HCl 









 Материал по химии "Галогенпроизводные углеводороды" (32.93 КB)
Материал по химии "Галогенпроизводные углеводороды" (32.93 КB)
 0
0 2777
2777 168
168 Нравится
0
Нравится
0




