Аммиак. Соли аммония
Элементы содержания: аммиак; соли аммония.
Требования к уровню подготовленности выпускников.
Уметь: составлять уравнения реакций с участием аммиака и солей аммония, распознавать опытным путем аммиак.
Цель: сформировать знания о строении, получении и химических свойствах аммиака; особых свойствах солей аммония (разложение, качественная реакция).
Оборудование: кристаллические ![]() конц. НСl, дихромат аммония, раствор NaOH,
конц. НСl, дихромат аммония, раствор NaOH, ![]() ; пробирки, штатив, спиртовка, кристаллизатор с водой, фенолфталеин, колба с пробкой и трубкой, фарфоровая чашка, предметный столик, керамическая пластина.
; пробирки, штатив, спиртовка, кристаллизатор с водой, фенолфталеин, колба с пробкой и трубкой, фарфоровая чашка, предметный столик, керамическая пластина.
Ход урока
I. Проверка домашнего задания.
Cтроение и свойства азота (письменно на доске), круговорот азота в природе (устно), разбор упражнений 1, 2 (на доске).
II. Изучение нового материала.
Аммиак – газ с резким характерным запахом (раствор аммиака известен как нашатырный спирт), очень хорошо растворимый в воде, tпл = –78 ºС, tкип = –33,4 ºС. Легко сжижается, значительно легче воздуха, ядовит. Жидкий аммиак бесцветный, твердый – белого цвета.
Учитель демонстрирует получение аммиака из нашатыря ![]() и гашеной извести
и гашеной извести ![]() собирает его в перевернутую вверх дном колбу; показывает растворимость аммиака (опыт «фонтанчик»): для демонстрации этого опыта можно использовать резиновую пробку с двумя отверстиями, в одно из которых вставлена прямая стеклянная трубка, по которой вода будет подниматься из кристаллизатора в колбу, во второе – короткая трубочка с резиновой грушей, через которую в колбу с аммиаком впрыскивается несколько капель воды. Далее с полученным раствором аммиака можно провести реакцию нейтрализации с кислотой.
собирает его в перевернутую вверх дном колбу; показывает растворимость аммиака (опыт «фонтанчик»): для демонстрации этого опыта можно использовать резиновую пробку с двумя отверстиями, в одно из которых вставлена прямая стеклянная трубка, по которой вода будет подниматься из кристаллизатора в колбу, во второе – короткая трубочка с резиновой грушей, через которую в колбу с аммиаком впрыскивается несколько капель воды. Далее с полученным раствором аммиака можно провести реакцию нейтрализации с кислотой.
Аммиак обладает восстановительными свойствами из-за того, что азот находится в нем в низшей степени окисления. Аммиак горит:
![]()
каталитически окисляется:
![]()
восстанавливает сложные вещества:
![]()
На примере аммиака рассматриваются оснóвные свойства с точки зрения протолитической теории: основания – частицы, способные присоединять протон Н+.
Учащимся объясняется электронное строение аммиака; у атома азота остается неподеленная электронная пара, частичный заряд на азоте – отрицательный, поэтому к нему в растворе будут притягиваться положительные ионы водорода:
![]()
Так по донорно-акцепторному механизму образуется ион аммония.
В воде аммиак ведет себя подобным образом:
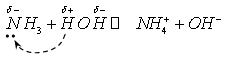
Молекулы воды диссоциируют, протоны присоединяются к молекулам аммиака, а гидроксид-анионы остаются в растворе, определяя щелочную среду.
Этим объясняется малиновая окраска фенолфталеина в растворе аммиака.
Учитель демонстрирует взаимодействие концентрированной соляной кислоты с аммиаком («дым без огня»):
![]()
Взаимодействием аммиака с кислотами получают соли аммония: все они растворимы, реагируют со щелочами (качественная реакция), разлагаются при нагревании.
Учитель демонстрирует разложение дихромата и хлорида аммония, взаимодействие хлорида аммония с гидроксидом натрия. Записывает уравнения реакций:
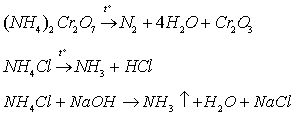
Аммиак получают:
1) прямым синтезом 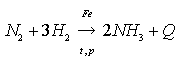
2) из нитридов ![]()
3) из солей аммония ![]()
Домашнее задание: § 25, упр. 5; § 26, упр. 4.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Конспект урока "Аммиак. Соли аммония" (45.82 KB)
Конспект урока "Аммиак. Соли аммония" (45.82 KB)
 0
0 438
438 4
4 Нравится
0
Нравится
0



