
Задание 3.4 (в КИМАх с 12-18) Химические свойства УВ

Алкены (этиленовые углеводороды)
это углеводороды, содержащие в молекуле одну двойную связь.
C n H 2 n общая формула (n = 2,3,4….)
С 2 Н 4 – этилен – эт ен СН 2 = СН 2
С 3 Н 6 – проп ен СН 2 = СН – СН 3
С 4 Н 8 - бут ен
С 5 Н 10 - пент ен
С 6 Н 12 - гекс ен
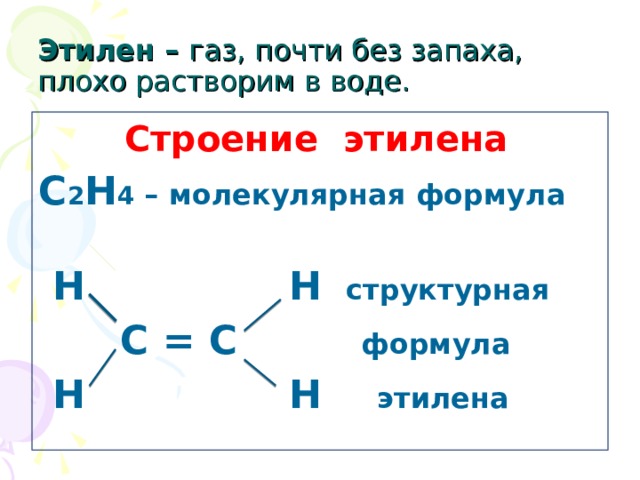
Этилен – газ, почти без запаха, плохо растворим в воде.
Строение этилена
С 2 Н 4 – молекулярная формула
Н Н структурная
С = С формула
Н Н этилена
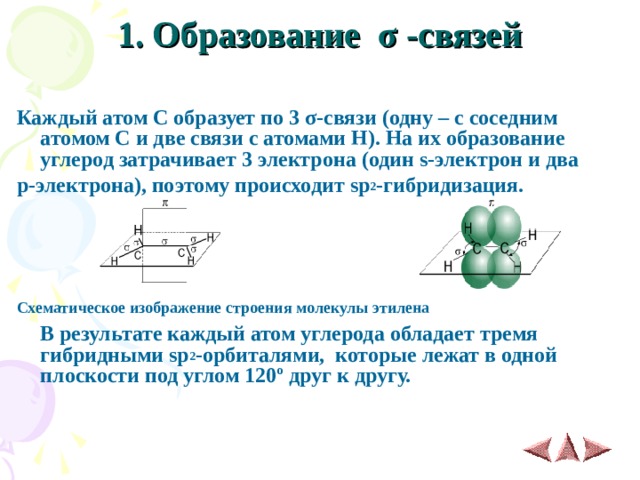
1. Образование σ -связей
Каждый атом С образует по 3 σ -связи (одну – с соседним атомом С и две связи с атомами Н). На их образование углерод затрачивает 3 электрона (один s- электрон и два
р-электрона), поэтому происходит sp 2 -гибридизация.
Схематическое изображение строения молекулы этилена
В результате каждый атом углерода обладает тремя гибридными sp 2 -орбиталями, которые лежат в одной плоскости под углом 120º друг к другу.
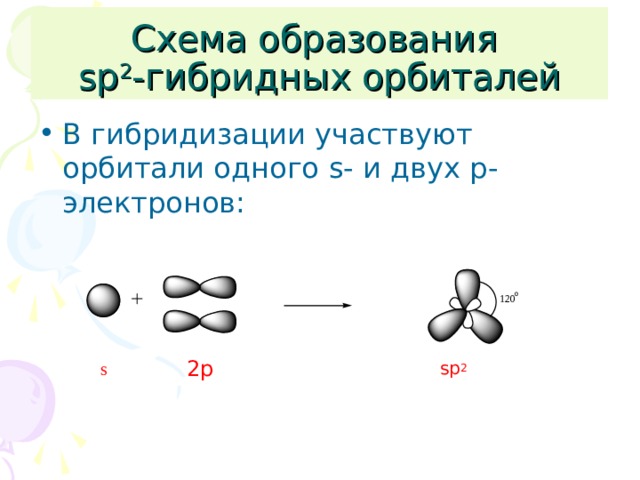
Схема образования sp 2 -гибридных орбиталей
- В гибридизации участвуют орбитали одного s - и двух p -электронов:
2p
sp 2
s

2. Образование π -связи
У каждого атома С есть ещё по одному облаку, которые в гибридизации не участвуют и сохраняют форму правильных восьмерок. Перекрываясь над и под плоскостью, они образуют π - связь , которая располагается перпендикулярно к плоскости σ - связей. Двойная связь алкенов представляет собой сочетание σ - и π - связей.
Длина двойной связи = 0,134 нм.

Запомните.
Простая (ординарная) связь – это всегда
σ -связь.
В кратных (двойных или тройных) связях –
одна σ -связь, а остальные π -связи.
σ -связи всегда образованы гибридными орбиталями (неправильными восьмерками).
π -связи образованы негибридными
p – орбиталями (правильными восьмерками).

π - связь менее прочна, чем σ - связь.
В связи с этим, π - связь легко разрывается и переходит в две новые σ - связи в результате присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ. Для алкенов наиболее типичными являются реакции присоединения.

Химические свойства алкенов
1) Горение
При сжигании на воздухе алкены образуют
углекислый газ и воду.
C 2 H 4 + 3 O 2 → 2 CO 2 + 2 H 2 O + Q
2 ) Окисление – качественная реакция на двойную связь
(растворы окислителей обесцвечиваются)
![При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли ( реакция Е.Е.Вагнера ). Реакция протекает на холоде. 3H 2 C=CH 2 + 2KMnO 4 + 4H 2 O → 2MnO 2 + 2KOH + 3CH 2 −CH 2 | | OH OH В результате реакции наблюдается обесцвечивание раствора перманганата калия. Реакция Вагнера служит качественной пробой на двойную связь. H 2 C=CH 2 + [О] + НОН → CH 2 −CH 2 этилен- | | гликоль OH OH](https://fsd.videouroki.net/html/2020/11/05/v_5fa3b3473038c/img9.jpg)
При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли ( реакция Е.Е.Вагнера ). Реакция протекает на холоде.
3H 2 C=CH 2 + 2KMnO 4 + 4H 2 O → 2MnO 2 +
2KOH + 3CH 2 −CH 2 | | OH OH
В результате реакции наблюдается обесцвечивание
раствора перманганата калия.
Реакция Вагнера служит качественной пробой на
двойную связь.
H 2 C=CH 2 + [О] + НОН → CH 2 −CH 2 этилен- | | гликоль OH OH

3 ) Реакции присоединения.
а) Присоединение галогенов - Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов.
H 2 C = CH 2 + Br 2 → BrCH 2 – CH 2 Br
С 2 Н 4 + Br 2 → С 2 Н 4 Br 2 дибромэтан
С 2 Н 4 + Cl 2 → С 2 Н 4 CI 2 дихлорэтан
Приведенная реакция - обесцвечивание этиленом бромной воды является качественной реакцией на двойную связь.

б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов ( Pt , Pd , Ni ) образуя предельные углеводороды.
CH 2 = CH 2 + H 2 → CH 3 – CH 3 С 2 Н 4 + H 2 → C 2 H 6 этан t,kat
в) Присоединение галогеноводородов - Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H 2 C = CH 2 + H С I → CH 3 – CH 2 CI
С 2 Н 4 + HCI → C 2 H 5 CI хлорэтан

Правило Марковникова
- В реакции присоединения полярных молекул к несимметричным алкенам, атом водорода преимущественно присоединяется к наиболее гидрированному атому углерода по двойной связи.
С Н 2 = С Н – СН 3 + Н CL = С Н 3 - С Н – СН 3
С L

Гидратация. В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. H+
CH 3 − C = CH 2 + H 2 O → CH 3 − CH(CH 3 ) − CH 3
| |
CH 3 OH
Как видно, направление реакций гидратации определяется правилом Марковникова.
г) Гидратация – присоединение воды
С 2 Н 4 + НОН → С 2 Н 5 ОН этиловый спирт (этанол)

4. Полимеризация - это процесс соединения многих маленьких одинаковых молекул в одну большую молекулу.
При полимеризации двойные связи в молекулах исходного непредельного соединения "разрываются", и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом. Полимеризация алкенов вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом: n CH 2 = CH 2 → (- CH 2 – CH 2 -) n
ЭТИЛЕН ПОЛИЭТИЛЕН

Вывод:
Реакции присоединения, окисления и полимеризации алкенов идут за счет разрыва двойной связи ( π -связи ).

Получение алкенов
1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором.
СН 3 – СН 3 → СН 2 = СН 2 + Н 2
С 2 Н 6 → С 2 Н 4 + Н 2 t, kat
2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия).
CH 3 – CH 2 – OH → CH 2 = CH 2 + H 2 O
С 2 Н 5 ОН → С 2 Н 4 + Н 2 О

ОВР с участием алкенов
Окисление алкенов в нейтральной среде:
C 2 H 4 + 2KMnO 4 + 2H 2 O→ CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH
Окисление алкенов в кислой среде:
CH 3 CH=CH 2 + 2 KMnO 4 + 3 H 2 SO 4 →CH 3 COOH +CO 2 + 2 MnSO 4 +K 2 SO 4 + 4 H 2 O
Окисление алкенов в щелочной среде:
CH 3 CH=CH 2 + 10KMnO 4 + 13KOH→ CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4


Понятие об алкинах
- Алкины – непредельные углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода, и соответствующие общей формуле
С n Н 2n - 2 , где n ≥ 2 .
- Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.

Характеристика тройной связи
- Вид гибридизации – sp
- Валентный угол – 180
- Длина связи − С ≡ С – 0 ,12 нм
- Строение ─ линейное
- Вид связи – ковалентная полярная
- По типу перекрывания – δ и 2 π

Схема образования sp -гибридных орбиталей

Схема образования sp -гибридных орбиталей
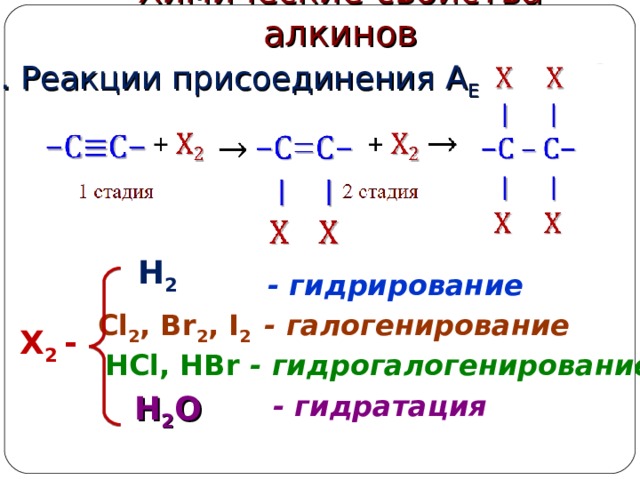
Химические свойства алкинов
1. Реакции присоединения А Е
H 2
- гидрирование
Cl 2 , Br 2 , I 2
- галогенирование
Х 2 -
HCl, HBr
- гидрогалогенирование
H 2 O
- гидратация

Химические свойства алкинов
1. Реакции присоединения А Е
а) Гидрирование(+Н 2 ) в 2 стадии:

1. Реакции присоединения А Е
б) Галогенирование (+Г 2 ) в 2 стадии:
Качественная реакция на алкины – бромная вода Br 2 (бурая жидкость) обесцвечивается.
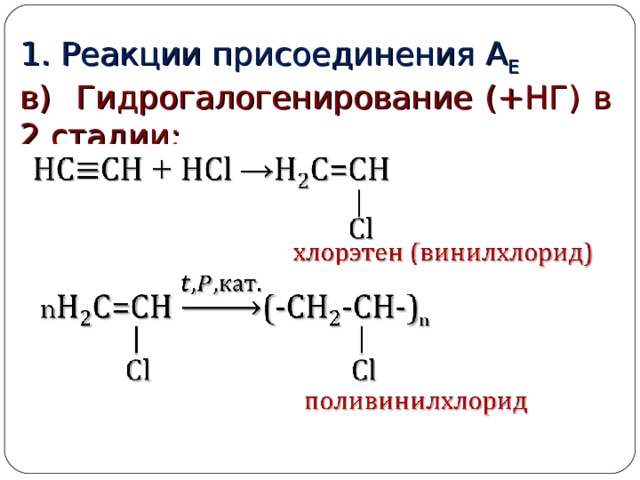
1. Реакции присоединения А Е
в) Гидрогалогенирование (+НГ) в 2 стадии:
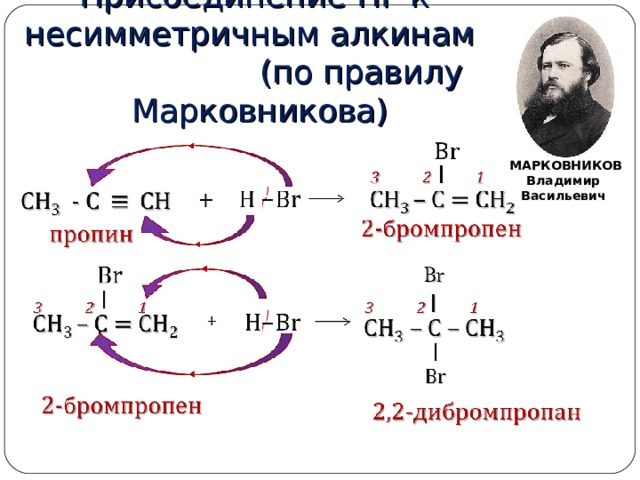
Присоединение НГ к несимметричным алкинам (по правилу Марковникова)
МАРКОВНИКОВ
Владимир
Васильевич
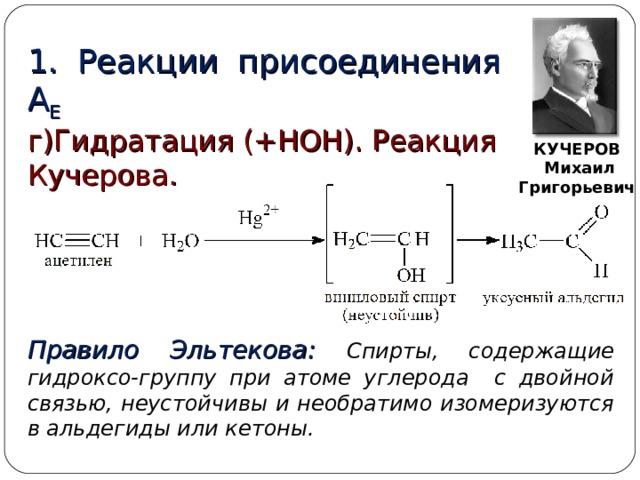
1. Реакции присоединения А Е
г)Гидратация (+НОН). Реакция Кучерова.
КУЧЕРОВ
Михаил Григорьевич
Правило Эльтекова: Спирты, содержащие гидроксо-группу при атоме углерода с двойной связью, неустойчивы и необратимо изомеризуются в альдегиды или кетоны.
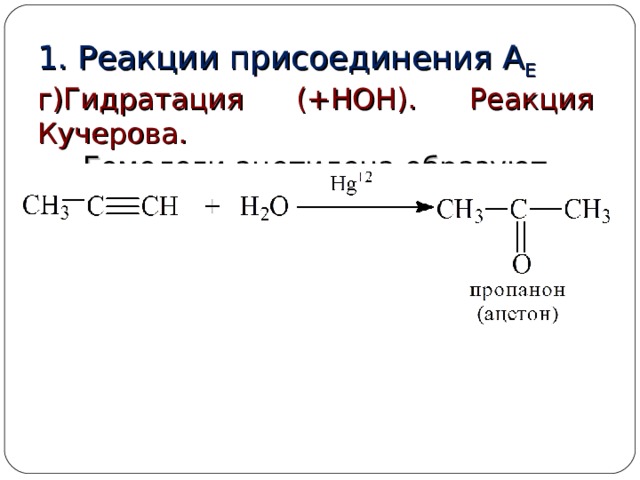
1. Реакции присоединения А Е
г)Гидратация (+НОН). Реакция Кучерова.
Гомологи ацетилена образуют кетоны:

Ацетилен образует с воздухом и кислородом взрывоопасные смеси.

2. Реакции окисления.
а) Окисление раствором водным раствором перманганата калия (качественная реакция).
В нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот; ацетилен окисляется до оксалатов (солей щавелевой кислоты):
3CH ≡ CH + 8KMnO 4 → 3KOOC – COOK + 8MnO 2 + 2KOH + 2H 2 O
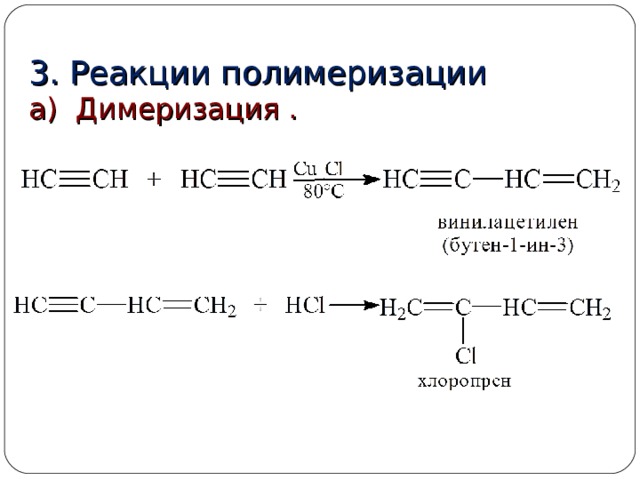
3. Реакции полимеризации
а) Димеризация .
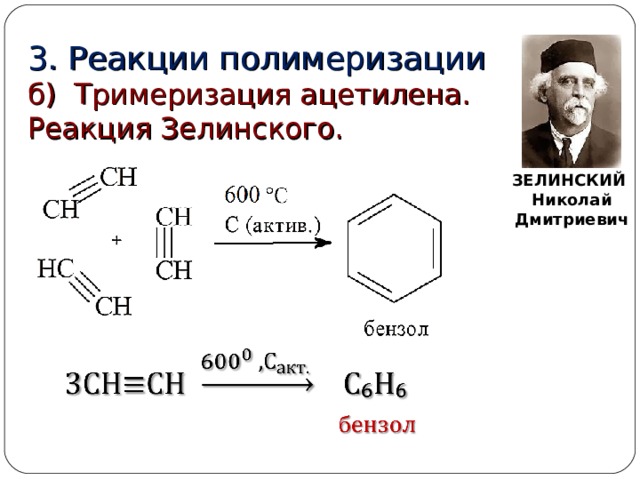
3. Реакции полимеризации
б) Тримеризация ацетилена. Реакция Зелинского.
ЗЕЛИНСКИЙ
Николай Дмитриевич

4. Реакции замещения (кислотные свойства)
HC≡CH + Ag 2 O → AgC≡CAg ↓ + H 2 O
амм. р-р ацетиленид серебра, белый
HC≡CH + 2 CuCl → CuC≡CCu ↓ + 2HCl
ацетиленид меди ( I) , коричневый
Качественная реакция на алкины с концевым положением тройной связи.

Окисление алкинов
в нейтральной среде:
3 CH ≡ CH +8 KMnO 4 →3 KOOC – COOK +8 MnO 2 +2КОН +2Н 2 О
2C -1 – 8e - → 2C +3 3
Mn +7 +3e - →Mn +4 8
в кислой среде:
5CH≡CH +8KMnO 4 +12H 2 SO 4 →5HOOC– COOH +8MnSO 4 +4 К 2 SO 4 +12 Н 2 О
CH≡CH + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4

Алкадиены или диеновые углеводороды
Имеют две двойные связи
Их общая формула
C n H 2n-2

Виды диеновых углеводородов
1). Кумулированные
CH 2 =C=CH 2
2) .С сопряжёнными связями
CH 2 =CH-C Н =CH 2
3).С изолированными связями
CH 2 =CH-CH 2 -CH=CH 2
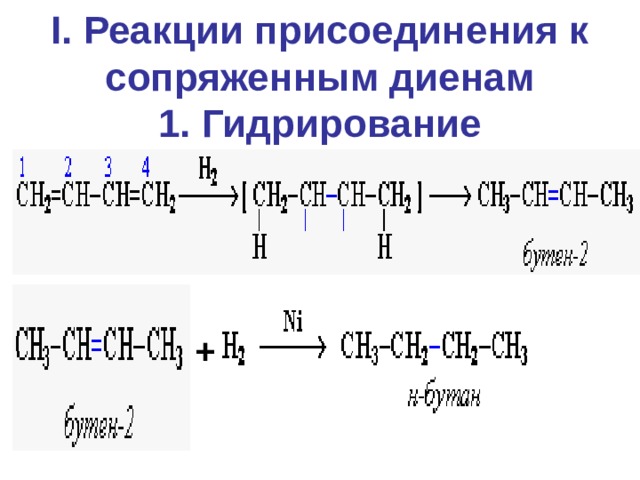
I . Реакции присоединения к сопряженным диенам 1. Гидрирование
+
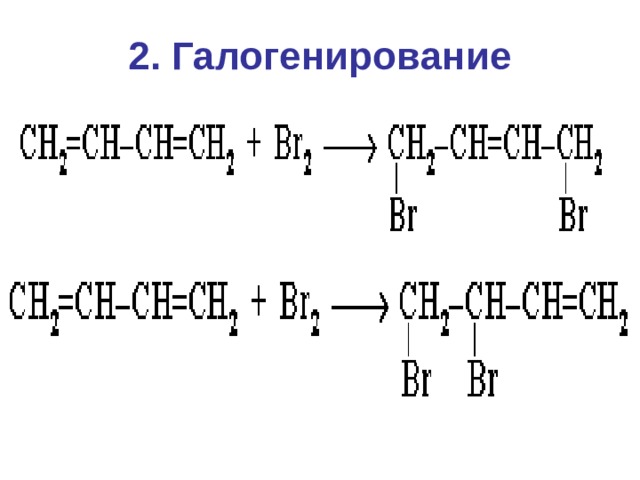
2. Галогенирование
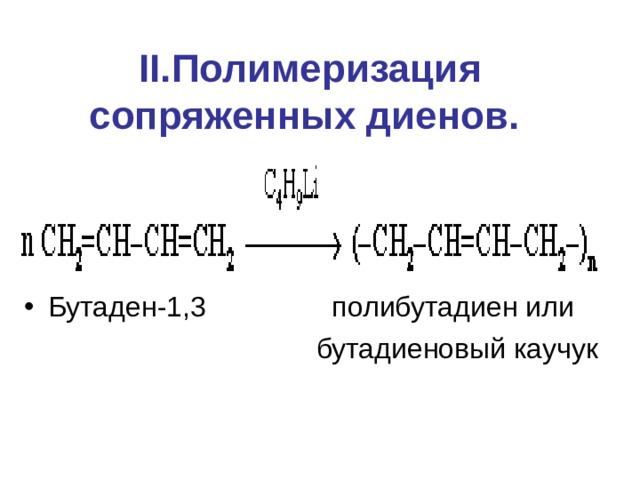
II. Полимеризация сопряженных диенов.
- Бутаден-1,3 полибутадиен или
бутадиеновый каучук
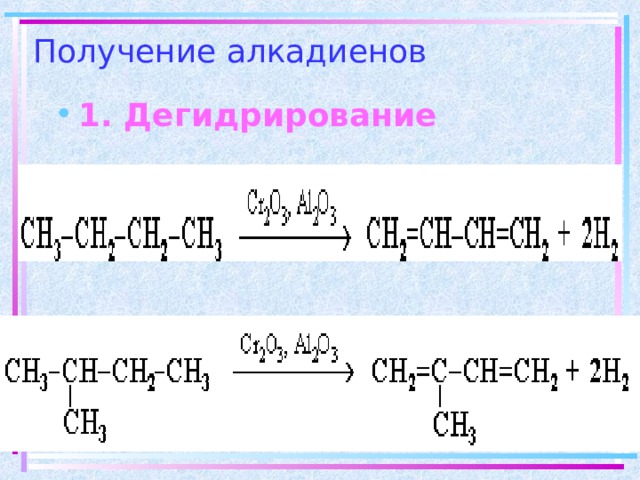
Получение алкадиенов
- 1. Дегидрирование
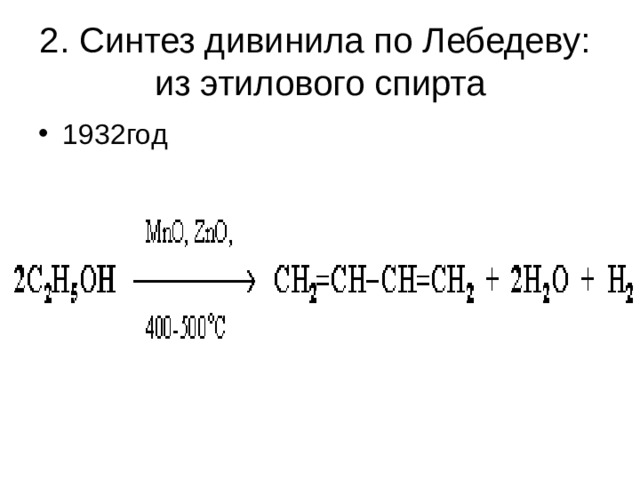
2. Синтез дивинила по Лебедеву: из этилового спирта
- 1932год
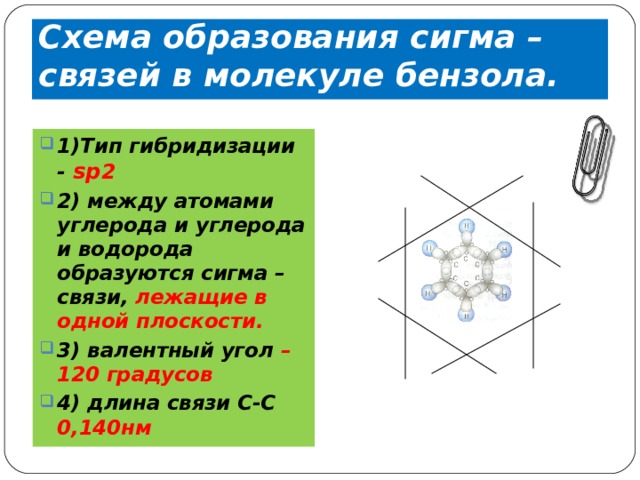
Схема образования сигма – связей в молекуле бензола.
- 1)Тип гибридизации - s р 2
- 2) между атомами углерода и углерода и водорода образуются сигма – связи, лежащие в одной плоскости.
- 3) валентный угол – 120 градусов
- 4) длина связи С-С 0,140нм

Схема образования пи – связей в молекуле бензола
За счет негибридных
р – электронных облаков в молекуле бензола перпендикулярно плоскости образования сигма - связей образуется единая
п- электронна я система, состоящая из 6 р – электронов и общая для всех атомов углерода.

Современная структурная формула бензола.
- Сочетание шести сигма – связей с единой п – системой называется ароматической связью
- Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом или бензольным ядром.
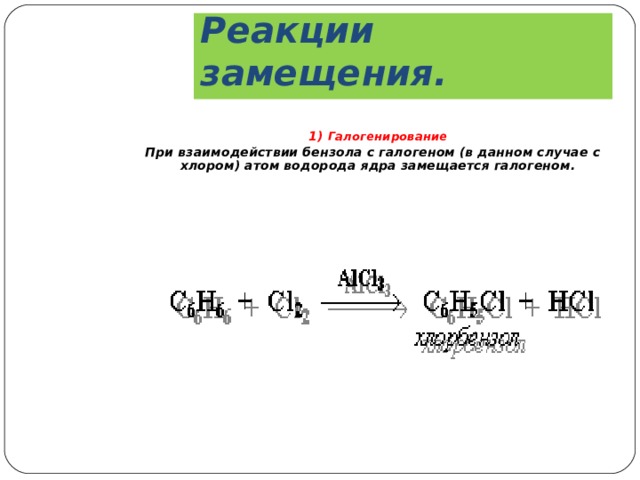
Реакции замещения.
1) Галогенирование
При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода ядра замещается галогеном.
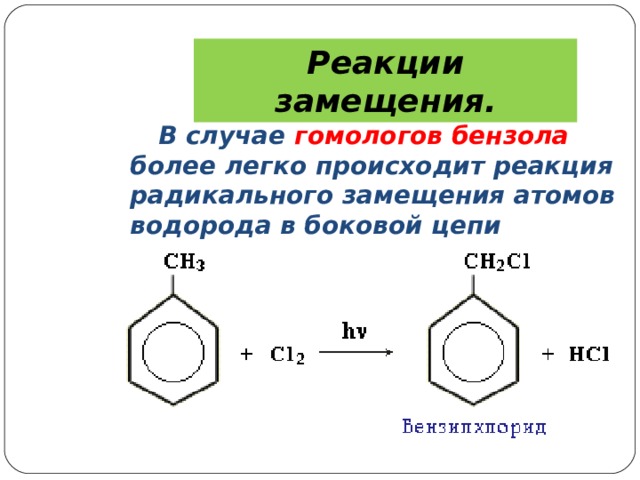
Реакции замещения.
В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи
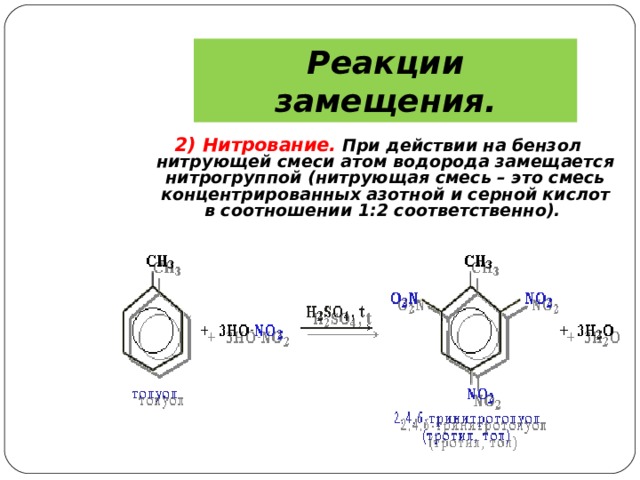
Реакции замещения.
2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это смесь концентрированных азотной и серной кислот в соотношении 1:2 соответственно).

Реакции замещения.
3 ) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В процессе реакции водородный атом замещается сульфогруппой.
C 6 H 6 + H 2 SO 4 — SO 3 C 6 H 5 – SO 3 H + H 2 O
(бензолсульфокислота)
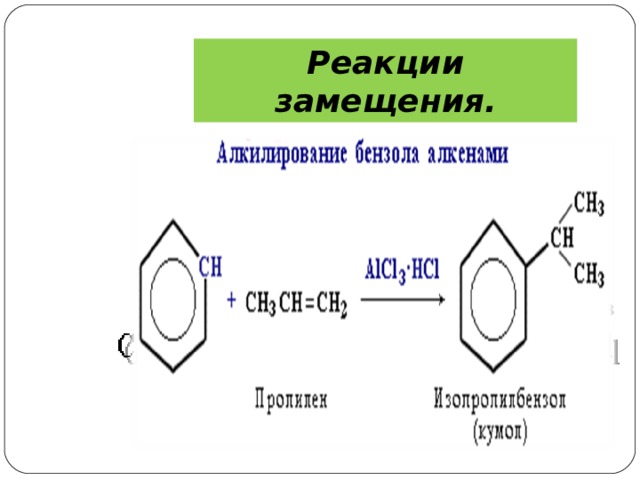
Реакции замещения.
4 ) Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов AlCl 3 , AlBr 3 , FeCl 3 (кислот Льюиса).

Реакции замещения
с гомологами бензола
Гомологи бензола (алкилбензолы) С 6 Н 5 – R более активно вступают в реакции замещения по сравнению с бензолом.
Например, при нитровании толуола С 6 Н 5 CH 3 (70 С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
CH 3 С 6 Н 5 + 3 HNO 3 CH 3 С 6 Н 2 ( NO 2 ) 3 + 3 H 2 O
2,4,6-тринитротолуол
тротил, тол)
При бромировании толуола также замещаются три атома водорода:
AlBr 3
CH 3 С 6 Н 5 + 3 Br 2 CH 3 С 6 Н 2 Br 3 + 3 HBr
2,4,6-трибромтолуол

Реакции присоединения
Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.

Реакции присоединения
5) Гидрирование.
Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре . Бензол гидрируется с образованием циклогексана, а производные бензола дают производные циклогексана.
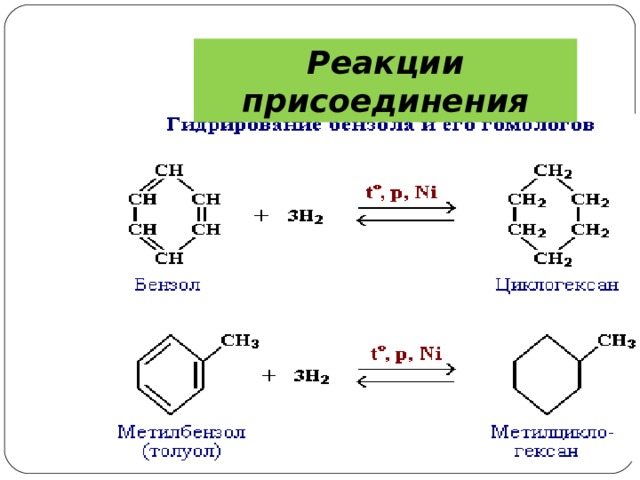
Реакции присоединения

Реакции присоединения
6) Галогенирование. Радикальное хлорирование В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. При радикальном хлорировании бензола получен "гексахлоран" (средство борьбы с вредными насекомыми).
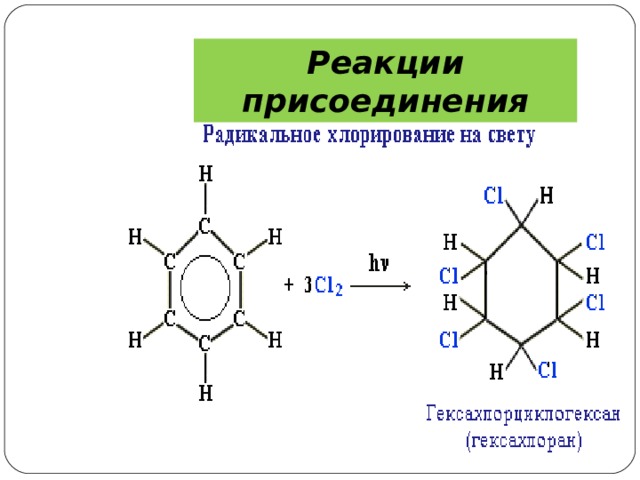
Реакции присоединения
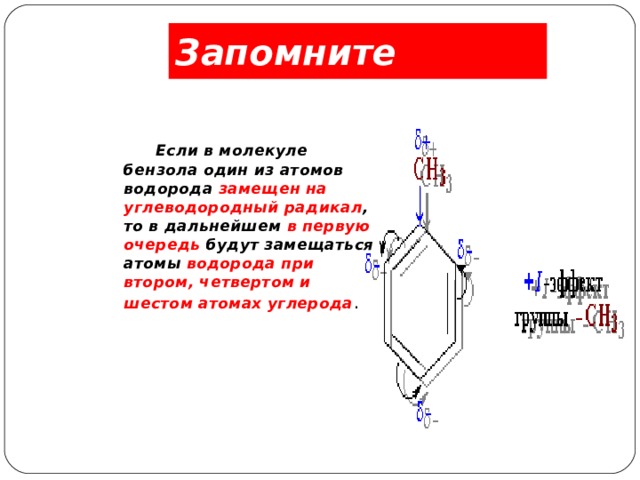
Запомните
Если в молекуле бензола один из атомов водорода замещен на углеводородный радикал , то в дальнейшем в первую очередь будут замещаться атомы водорода при втором, четвертом и шестом атомах углерода .
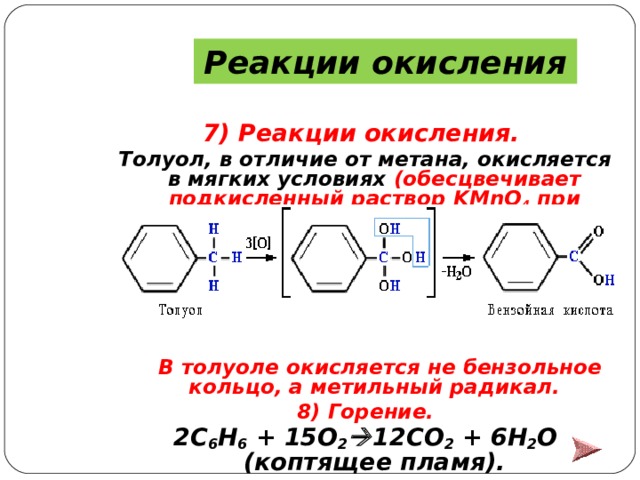
Реакции окисления
7) Реакции окисления.
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO 4 при нагревании):
В толуоле окисляется не бензольное кольцо, а метильный радикал.
8) Горение.
2 C 6 H 6 + 15 O 2 12 CO 2 + 6 H 2 O (коптящее пламя).
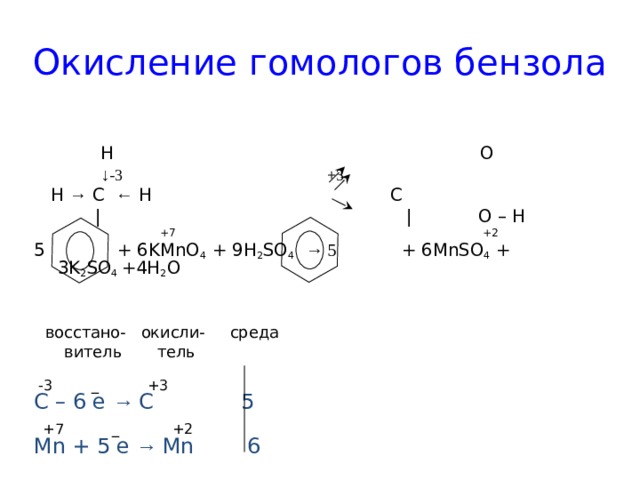
Окисление гомологов бензола
H O
↓ -3 +3
H → C ← H C
| | O – H
+7 +2
5 + 6KMnO 4 + 9H 2 SO 4 → 5 + 6MnSO 4 + 3K 2 SO 4 +4H 2 O
восстано- окисли- среда
витель тель
-3 _ +3
С – 6 e → C 5
+7 _ +2
Mn + 5 e → Mn 6

Окисление гомологов бензола
- Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа.
5C 6 H 5 -CH 2 CH 3 + 12KMnO 4 +18H 2 SO 4 →
→ 5 С 6 Н 5 СООН +CO 2 +12MnSO 4 +6K 2 SO 4 +28H 2 O
C -2 -5e - →C +3 5
C -3 -7e - →C +4
Mn +7 +5e - →Mn +2 12
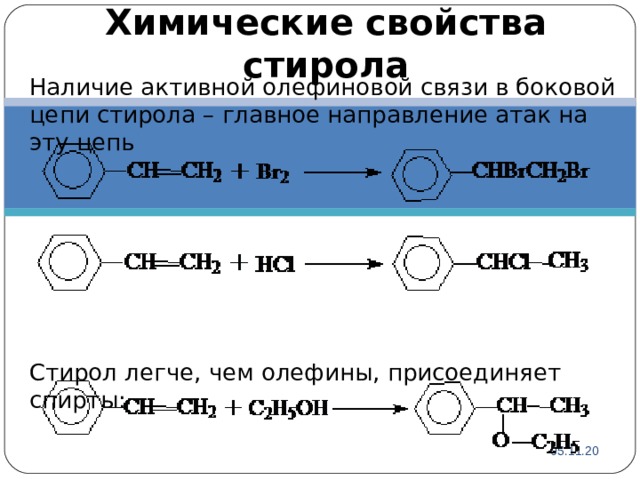
Химические свойства стирола
Наличие активной олефиновой связи в боковой цепи стирола – главное направление атак на эту цепь
Стирол легче, чем олефины, присоединяет спирты:
05.11.20
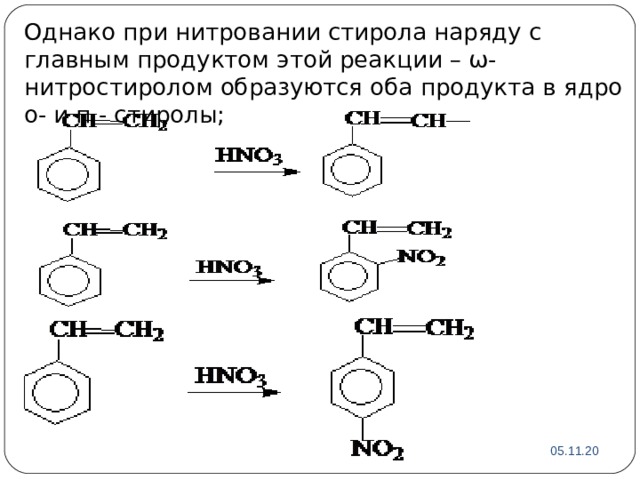
Однако при нитровании стирола наряду с главным продуктом этой реакции – ω-нитростиролом образуются оба продукта в ядро о- и п - стиролы;
05.11.20

Окисление стирола
В нейтральной среде:
3C 6 H 5 -CH =CH 2 +2 KMnO 4 + H 2 O→
3C 6 H 5 -CH(OH) -CH 2 (OH)+2MnO 2 +2KOH
В кислой среде:
C 6 H 5 -CH=CH 2 +2KMnO 4 +3H 2 SO 4 →
С 6 Н 5 СООН +CO 2 +2MnSO 4 +K 2 SO 4 +H 2 O

 Получите свидетельство
Получите свидетельство Вход
Вход











 Химические свойства углеводородов (6.87 MB)
Химические свойства углеводородов (6.87 MB)
 0
0 772
772 31
31 Нравится
0
Нравится
0





