Карбоновые кислоты
Карбоновыми называют кислоты, создающие карбоксильную группу
Карбоновые кислоты
ароматические



фталевая кислота
СООН
/

\
СООН
Бензойная кислота

СООН
/
Циклогексан-1,2-дикарбоновая кислота
Циклогексанкарболовая
кислота
\
СООН

СООН
/
алициклические

СООН
/

алифатические

НООССН2СН2СООН
Янтарная кислота
СН3СООН
Уксусная кислота
по числу групп СООН
монокарбоновые
дикарбоновые
![]()
![]()
Монокарбоновые кислоты
Номенклатура и изомерия
Заместительная номенклатура – к названию углеводорода добавляется окончание –овая.
| СН3СООН | СН3СН2СН2СООН | 3 2 1 СН3СНСООН |
| Этановая кислота 2 1 СН2СООН / |
| |
| 
2-фенилэтановая кислота   2-фенилэтановая кислота 
| Бутановая кислота СН3 2-метилпропановая  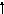 ![]() кислота кислота
изомеры |
|
|
|
|
|
|
В названиях ароматических кислот в качестве родоначальной структуры используется бензойная кислота.
СООН
СН3
/
СООН









2-метилбензойная кислота
4-метилбензойная кислота
СН3
Если – СООН не входит в родоначальную структуру, используется сочетание – карбоновая кислота (циклогексанкарбоновая кислота). Используются и тривиальные названия до кислот с С15 (муравьиная).
Структурная изомерия обусловлена разветвленностью углеродного скелета и расположением заместителей относительно карбоксильной группы в циклах.
Способы получения
Окисление первичных спиртов и альдегидов
O O
[O] // [O] //
RCH2OH RC RO
KMNO4 \ Ag2O \
H OH
кислота
альдегид
спирт
Окисление гомологов бензола
С
СН3
KMnO4, KOH, 1000
Бензойная кислота
толуол





Окисление алканов
O2
ROH2CH2R’ RCOOH R’COOH
Смесь кислот
Смесь нитрилов (цианидов)
O
//
RCN + 2H2O RC + NH3
\
OH
(нитрилы получают из алкилгалогенидов RBr + NaCN RCN+NaBr).
Физические свойства
Низшие кислоты (С1С9) – бесцветные жидкости, высшие – твердые вещества. Первые гомологи (С1С3) обладают резким запахом, при попадании на слизистые оболочки вызывают ожоги, смачиваются водой. Карбоновые кислоты образуют ассоциаты за счет водородных связей.
Н
I
С
// \
О ОН
Н
I
С
// \
О ОН
Н
I
С
// \
О ОН
Н
I
С
// \
О ОН
…. … … …. …
Ассоциат муравьиной кислоты
Химические свойства
Кислотные свойства
Влияние заместителей на кислотные свойства
|
|
|
| Cl |
|
|
|
| |
| СН3СООН | СН2СООН | Cl CHCOOH | Cl CCOOH |
| Уксусная кислота | | | |
|
| Cl | Cl | Cl |
|
| Хлоруксусная | Дихлоруксусная | Трихлоруксусная |
|
| кислота | кислота | кислота |
Увеличение кислотности

Влияние взаимного расположения заместителя и карбоксильной группы
|
| 4 3 2 1 | 4 3 2 1 | 4 3 2 1 |
| СН3СН2СН2СООН | СН2СН2СН2СООН | СН3СНСН2СООН | СН3СН2СНСООН |
| Масляная кислота | | | |
|
| Cl | Cl | Cl |
|
| 4-хлормасляная кислота | 3-хлормасляная кислота | 2-хлормасляная кислота |
Увеличение кислотности

Кислая среда в растворах карбоновых кислот обнаруживается с помощью индикатора. Карбоновые кислоты значительно слабее минеральных кислот.
СН3СООН + NaOH CH3COONa + H2O
гидролиз
Ацетат Na
Реакция замещения
Образование сложных эфиров (реакция этерификации)
С
//
СН3С
\
ОС2Н5
С
//
СН3С
\
ОН
H2SO4 (конц)
+ С2Н5ОН + Н2О
этилацетат
Образование галогенангидридов
С
СООН




+ PCl + POCl3 + HCl
фосфорилхлорид
бензолхлорид
Бензойная кислота
С
//
СН3С
\
Cl
СН3СООН + SOCl2 + SO2 + HCl
тионилхлорид
ацетилхлорид
уксусная кислота
3. Образование ангидридов кислот
С
//
СН3С
\
О
С
//
СН3С
\
ОН
P2O5

/
СН3С
\\
О
ОН
//
СН3С
\
О
О
//
СН3С
\
Cl
Уксусный ангидрид
-2HPO3
Уксусный ангидрид
/
СН3С
\\
О
С
//
СН3С
\
О
О
\\
CСН3
/
+ NaO NaCl +
Ацетат натрия
ацетилхлорид
Уксусный ангидрид используется для получения ацетатного шелка и лекарственных веществ.
Образование амидов
О
//
СН3С
\
NH2
NH3 t0
СН3СООН СН3СООNН4
Ацетамид
-H2O
Ацетат аммония
Реакции с участием радикалов кислот
Галогенирование насыщенных алифатических кислот
СН3СН2СН2СООН + Br2 СН3СН2СНСООН + HBr
2-броммасляная кислота
масляная кислота
Br
2. Реакция присоединения к ненасыщенным кислотам
О
//
СНС
\
ОH
3 2 1
СН2= + HBr СН2СН2СООН
3-бромпропановая кислота
Br
Акриловая кислота
(реакция происходит против правила Марковникова, т.к. – СООН, находясь у атома углерода с двойной связью, оттягивает электронную плотность кратной связи).
3.Реакция замещения в ароматических кислотах
3-нитробензойная кислота
Бензойная кислота
\
NO2
COOH
KNO3, H2SO4, 900



С


Отдельные представители
Муравьиная (метановая) кислота НСООН – содержится в выделениях муравьев, крапиве. Соли – формиаты. Получают при взаимодействии СО с горячим раствором NaOH под давлением.
H2SO4
СО + NaOH HCOONa HCOOH
-NaHSO4
Муравьиная кислота
Формиат натрия
Особенность муравьиной кислоты – реакция «серебряного зеркала» из-за наличия альдегидной группы
Н
\
С-ОН
//
О
НO
\
С-ОН
//
О

 + Ag2O ® +2 Ag
+ Ag2O ® +2 Ag
Н2О
СО2
угольная кислота
муравьиная кислота
Спиртовой раствор муравьиной кислоты применяется как раздражающее средство при лечении ревматизма, а так же в органическом синтезе как восстановитель.
Уксусная (этановая) кислота СН3СООН – известна с глубокой древности в виде уксуса (3-6% раствор), который обладает консервирующим действием, убивает гнилостные бактерии и плесневые грибки. Концентрированную 100% уксусную кислоту называют «ледяной», т.к. при 160С она «замерзает», и кристаллы ее похожи на лед.
В промышленности получают:
1. Каталитическое окисление бутана
о2
СН3-СН2-СН2-СН3 ® 2СН3СООН
2. Окисление этилена
O
//
СН3-С
\
ОН
O
//
СН3-С
\
Н
O2 О2
СН2=СН2 ® ®
уксусная кислота
ацетальдегид
этилен
3. Пищевую уксусную кислоту получают при окислении этанола (уксуснокислое брожение – биохимический процесс).
O
//
СН3-С
\
Н
O
//
СН3-С
\
ОН
С2Н5ОН ® ®
Из уксусной кислоты получают искусственные волокна, растворители, лекарства.
Изовалериановая кислота (3-метилбутановая кислота)
4 3 2 1
СН3- СН- СН2-СООН
ï
СН3
Содержится в корнях валерианы, применяется для получения валидола.
Бензойная кислота С6Н5СООН – содержится в природе в растительных смолах, в ягодах клюквы, брусники, черники. Получают окислением толуола.
СН3
ï
СН3
ï

 О2
О2
 ® + Н2О
® + Н2О
Применяют для получения лекарственных препаратов, душистых веществ, красителей. В медицине – как отхаркивающее средство.
Акриловая кислота СН2=СН - СООН (пропеновая) – применяется в производстве прозрачных пластмасс (плексиглас, органическое стекло)
Олеиновая (С17Н33СООН), линолевая (С17Н31СООН) кислоты в виде сложных эфиров глицерина входят в состав растительных масел (оливковое, подсолнечное, льняное).
Пальмитиновая, стеариновая – их смесь называется стеарин, применяется в производстве свечей. Глицериновые эфиры этих кислот входят в состав животных жиров.

 Получите свидетельство
Получите свидетельство Вход
Вход














 Карбоновые кислоты (методическая разработка) (34.88 КB)
Карбоновые кислоты (методическая разработка) (34.88 КB)
 0
0 663
663 89
89 Нравится
0
Нравится
0




