ФЕДЕРАЛЬНОЕ АГЕНТСТВО МОРСКОГО И РЕЧНОГО ТРАНСПОРТА
КРАСНОЯРСКИЙ ИНСТИТУТ ВОДНОГО ТРАНСПОРТА – ФИЛИАЛ
ФГБОУ ВО «СИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ВОДНОГО ТРАНСПОРТА»
Методическая разработка
Алгоритмический подход при обучении решению задач
Разработала:
Преподаватель химии Лучинина Н.Г.
Красноярск 2024
Пояснительная записка
В настоящие время использование алгоритмов стало актуальным практически на всех предметах, в том числе и химии. на уроках при обучении решению задач целесообразнее использовать алгоритмы, так как благодаря им никогда не нарушится последовательность действий, что приведет к правильному решению задачи. Более того, при использовании различных типов задач и, соответственно, при различных алгоритмах у обучающихся начинает вырабатываться свой единый алгоритм, благодаря которому обеспечивается их эффективная подготовка к участию в олимпиадах и решению более сложных задач.
Алгоритм – описание последовательности действий, строгое использование которых приводит к решению поставленной задачи за конечное число шагов.
Один из типов задач – это задачи на вывод формул соединений вещества. Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле, т. е. его простейшую формулу.
Алгоритм 1. Решение расчетных задач на вывод молекулярной формулы вещества по массовым долям элементов.
Задача 1. Найти молекулярную форму вещества, содержащего 81,8 % углерода и 18,2 % водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
Записать условие задачи.
Дано:
ω(С) = 81,8 %
ω(Н) = 18,2 %
D N2 = (CxHy) = 1.57
Найти молекулярную формулу CxHy
Вычислить относительную молекулярную массу Mr (CxHy) по относительной плотности:
Mr (CxHy) = D N2 · Mr (N2) = 1.57 · 28 = 43.96 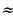 44
44
Найти индексы х и у по отношению:
х : у = 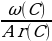 :
: 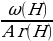 =
= 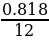 :
: 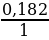 = 0,068 : 0,182 = 3 : 8
= 0,068 : 0,182 = 3 : 8
Записываем простейшую формулу: С3Н8.
Проверка:
Mr (С3Н8) = 44, следовательно С3Н8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3 %.
Решение
Записать условие задачи.
Дано:
CnH2n+2
ω(С) = 83.3 %
Найти молекулярную формулу CxHy
Найти массовую долю водорода:
ω(Н) = 100 % - 83,3 % = 16,7 %
Найти индексы и простейшую формулу для углеводорода CxHy:
х : у = 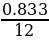 :
: 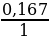 = 0,0694 : 0,167 = 2 : 5
= 0,0694 : 0,167 = 2 : 5
следовательно, простейшая формула C2H5
Найти истинную формулу. Поскольку общая формула алканов CnH2n+2, то истинная формула – С4Н10.
Агоритм 2. Решение расчетных задач на вывод молекулярной формулы вещества по массе (объему) продуктов сгорания.
Задача 3. При сгорании 29 г углеводорода образовалось 88 г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
Записать условие задачи.
Дано:
m (CxHy) = 29 г m (CO2) = 88 г
m (H2O) = 45 г Dвозд. (CxHy) = 2
Найти молекулярную формулу CxHy
Найти относительную молекулярную массу вещества:
Mr (CxHy) = Dвозд. · Mr (возд) = 2 · 29 = 58
Найти количество вещества образовавшегося оксида углерода (IV):
ν (CO2) = 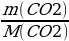 =
= 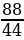 = 2 моль
= 2 моль
Найти количества вещества углерода в сожженном веществе:
ν (Н2О) = 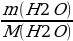
ν (С) = ν (CO2) = 2 моль
Найти количество вещества воды:
ν (Н2О) = 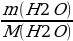 =
= 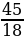 = 2,5 моль.
= 2,5 моль.
Найти количество вещества водорода в сожженном веществе:
Ν (Н) = 2,5 ·2 = 5 моль
Найти простейшую формулу углеводорода
х : у = ν (С) : ν (Н) = 2 : 5,
следовательно, простейшая формула C2H5.
Найти истинную формулу углеводорода:
Mr (C2H5) = 29
Mr (CxHy) = 58, следовательно, простейшая формула C4H10.
Задача 4. При сжигании 5,6 л (н. у.) газообразного органического вещества было получено 16,8 л (н. у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н. у. равна 1,875 г. Найти его молекулярную формулу.
Решение
Записать условие задачи.
Дано:
V (в-ва) = 5,6 л
V (CO2) = 16,8 л
m (H2O) = 13,5 г
ρ (в-ва) = 1,875 г/л
Найти молекулярную формулу вещества
Найти молекулярную массу вещества из пропорции:
1 л – 1,875 г
22,4 л – m г
M (в-ва) = 42 г, M = 42 г/моль.
Найти количество вещества углекислого газа и углерода:
ν (CO2) = 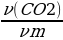 =
=  = 0,75 моль
= 0,75 моль
ν (С) = 0,75 моль.
Найти количество вещества воды и водорода:
ν (Н2О) = 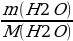 =
= 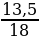 = 0,75 моль
= 0,75 моль
ν (Н) = 0,75 · 2 = 1,5 моль.
Найти сумму масс углерода и водорода:
m (C) + m (H) = ν (С) · M (C) + ν (H) · M (H) = 0,75 · 12 + 1,5 · 1 = 10,5 г.
Найти массу сожженного вещества:
m (в-ва) = 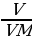 ·M =
·M = 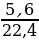 · 42 = 10,5 г.
· 42 = 10,5 г.
Следовательно, вещество содержит только углерод и водород.
Найти простейшую формулу углеводорода CxHy :
ν (С) : ν (H) = 0,75 : 1,5 = 1 : 2, следовательно, простейшая формула – СН2.
Найти истинную формулу углеводорода:
Mr (CH2) = 14
Mr (в-ва) : Mr (CH2) = 42 : 14 = 3, следовательно, истинная формула – С3Н6.
Удобнее, когда у обучающихся уже лежит алгоритм перед началом выполнения заданий или объяснения материала.
Литература
Доронькин В.Г., Бережная А.Г., Сажнева Т.В., Февральская В.А. Химия: тематические тестыдля подготовки к ЕГЭ. Задания высокого уровня сложности (С1 – С5). – Растов н/Д: Легион, 2011.
Габриелян О.С., Маскаев Ф.Н., Пономарев С.Ю., Теренин В.И. Химия: Учебник для 10 класса. Профильный уровень. – М.: Дрофа, 2008.
Кузьменкро Н.Е., Еремин В.В., Попков В.А. Химия: Для школьников старших классов и поступающих в вузы. – М.: Дрофа, 2004, - 544 с.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Алгометрический подход при обучении решению задач (23.43 KB)
Алгометрический подход при обучении решению задач (23.43 KB)
 0
0 130
130 0
0 Нравится
0
Нравится
0


