Строение атомного ядра. Ядерные силы
Цели урока:
обучающая: Познакомится со строением атомного ядра и с силами, действующими в ядре. Познакомится с величинами, которыми можно охарактеризовать ядро того или иного элемента.
развивающая: изучение истории открытия протона и нейтрона, знакомство с методами, которыми пользовались ученые того времени.
воспитывающая: воспитание дисциплины и норм поведения, творческого отношения к изучаемому предмету; стимулировать активность учащихся, повышать мотивацию к изучению физики.
Методы:
словесный — беседа;
наглядный — видеоурок;
Ход урока:
1. Организационный этап.
Добрый день. Прежде чем мы приступим к уроку, хотелось бы, чтобы каждый из вас настроился на рабочий лад.
2. Актуализация знаний.
Совсем недавно мы изучили строение атома и выяснили, что почти вся масса и весь положительный заряд атома сконцентрирован в атомном ядре. Теперь настало время изучить строение атомного ядра.
3. Объяснение нового материала.
Недавно мы познакомились с планетарной моделью атома Резерфорда, согласно которой в центре атома находится положительно заряженное ядро, вокруг которого вращаются электроны.
Резерфорд выдвинул гипотезу о том, что в состав любого атомного ядра входит ядро атома водорода. В 1919 году ему удалось доказать это: бомбардируя ядро атома азота альфа-частицами, Резерфорд получил первую искусственную ядерную реакцию, продуктами которой оказались ядра атомов кислорода и водорода. Впоследствии, подобные эксперименты были повторены для других атомных ядер, и каждый раз из атомного ядра выбивалось ядро атома водорода. Поэтому ядро атома водорода стали классифицировать как элементарную частицу — протон.
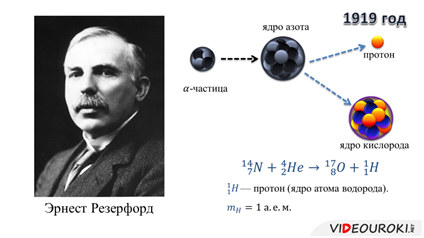
Очень скоро стало ясно, что ядра атомов не могут состоять только из протонов. В 1932 году ученик Резерфорда — Джеймс Чедвик доказал, что в состав атомного ядра входят электрически нейтральные частицы, масса которых приблизительно равна массе протона. Такую частицу называли нейтроном.

Практически сразу после открытия нейтрона, два ученых: Дмитрий Иваненко и Вернер Гейзенберг независимо друг от друга предложили протонно-нейтронную модель атома, согласно которой ядра всех атомов состоят из протонов и нейтронов. Частицы, входящие в состав атомного ядра (то есть, протоны и нейтроны) стали называть нуклонами.
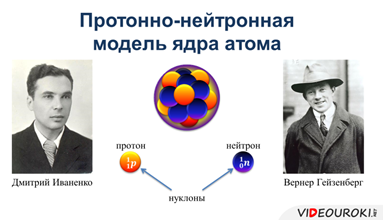
Для характеристики ядра того или иного атома вводятся такие величины, как массовое число (то есть, число нуклонов в ядре) и зарядовое число (то есть, число протонов в ядре). Число протонов и нейтронов в ядре можно узнать с помощью таблицы Менделеева. На примере ядра атома натрия мы узнаем, как это сделать.

Как выяснилось, существуют элементы, которые ничем не отличаются друг от друга по своим химическим свойствам, но, несмотря на это, имеют различные массовые числа. Такие элементы называли изотопами. В качестве примера мы рассмотрим изотопы водорода: протий, дейтерий и тритий.
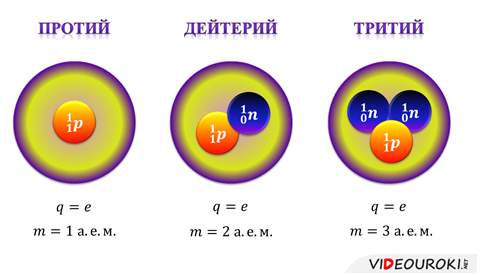
Исходя из того, что одноименно заряженные частицы испытывают электростатическое отталкивание, протоны, находящиеся в ядре должны разлететься в разные стороны, поскольку расчеты говорят о том, что кулоновские силы в данном случае значительно мощнее гравитационных. Тем не менее, этого не происходит. Дело в том, что в пределах атомных ядер действуют ядерные силы. Эти силы являются самыми мощными силами в природе и относятся к фундаментально иному типу взаимодействия — сильному взаимодействию.

4. Рефлексия
Хотелось бы услышать ваши отзывы о сегодняшнем уроке: что вам понравилось, что не понравилось, чем бы хотелось узнать еще.
5. Домашнее задание.
6. Итоги урока
Получите комплекты видеоуроков + онлайн версии
Похожие записи
 29853
29853 Нравится
0
Нравится
0

 Получите свидетельство
Получите свидетельство Вход
Вход










Жаль, что нигде не указано имя автора. Это первое.
И второе, хотелось, чтобы на сайте были такие конспекты и к другим урокам физики. Они для учеников будут весьма полезны. Большое спасибо.