Введение.
В этом столетии наряду с традиционными формами контроля в учебном процессе стали активно использоваться тесты. Главное преимущество тестов в том, что :
Тестирование является более качественным и объективным способом оценивания, его объективность достигается путем стандартизации процедуры проведения, проверки показателей качества заданий и тестов целиком.
Тестирование — более справедливый метод, оно ставит всех учащихся в равные условия, как в процессе контроля, так и в процессе оценки, практически исключая субъективизм преподавателя.
Тесты это более объёмный инструмент, поскольку тестирование может включать в себя задания по всем темам курса, в то время как на устный экзамен обычно выносится 2-4 темы, а на письменный — 3-5. Это позволяет выявить знания учащегося по всему курсу, исключив элемент случайности при вытаскивании билета. При помощи тестирования можно установить уровень знаний студентов по предмету в целом и по отдельным его разделам.
Тест это более точный инструмент, так, например, шкала оценивания теста из 20 вопросов, состоит из 20 делений, в то время, как обычная шкала оценки знаний — только из четырёх.
Тестирование более эффективно с экономической точки зрения. Основные затраты при тестировании приходятся на разработку качественного инструментария, то есть имеют разовый характер. Затраты же на проведение теста значительно ниже, чем при письменном или устном контроле. Проведение тестирования и контроль результатов в группе из 30 человек занимает полтора два часа, устный или письменный экзамен — не менее четырёх часов.
Тестирование — это более мягкий инструмент, они ставят всех учащихся в равные условия, используя единую процедуру и единые критерии оценки, что приводит к снижению предэкзаменационных нервных напряжений.
Автором предлагается разноуровневые тестовые задания по всем темам курса органической химии. По каждой теме представлены упражнения и задачи, сформулированные в виде тестов, в которых отражены основные вопросы строения, номенклатуры, изомерии,способов получения, химических свойств, генетической связи классов органических соединений.
Приведенные в тестах расчетные задачи позволяют одновременно осуществить повторение материала неорганической химии 8и 9 елассов, а также проверить умение учащихся правильно составлять химические и термохимические уравнения.
Тестовые задания,помимо осуществления контроля знаний учащихся по заданной теме, позволяет выявить глубину усвоения.
Так же очень удобно, что этот сборник выполнен в электронном варианте, в программе конструктора тестовых заданий JSTest Compiler. Данная программа сама производит интерпретацию результатов, чем очень удобна как для учащихся проводить самим самоконтроль, так для и учителей экономить время на проверку тестов.
Тема: «Альдегиды. Карбоновые кислоты»
Вариант-1
Органические соединения в молекулах которых содержится карбонильная группа, соединенная с углеводородным радикалом или атомом водорода называются:
А) карбоновые кислоты В) альдегиды С) сложные эфиры
D) одноосновные предельные карбоновые кислоты
Е) многоатомные спирты
2. Дайте название соединению по исторической номенклатуре:
![]()
СН3-СН-СООН
СL
А) хлорэтановая кислота В) хлорвалериановая кислота
С) хлоруксусная кислота D) хлормасляная кислота
Е) хлорпропионовая кислота
3. Укажите виды изомерии характерные для альдегидов:
А) изомерия углеродного скелета и межклассовая изомерия
В) изомерия углеродного скелета и местоположения функциональной группы
C) изомерия углеродного скелета и местоположения кратной связи
D) межклассовая изомерия и изомерия положения кратной связи
E) изомерия местоположения функциональной группы
4. При отщеплении воды от двух атомов уксусной кислоты, образуются…
А) оксид уксусной кислоты В) ангидрид уксусной кислоты
С) эфир уксусной кислоты D) масляная кислота Е) метилпропионат
5. Дайте название уравнению реакции:
С2Н2 +Н2О →СН3-СОН
А) гидролиз ацетилена В) реакция М.Г. Кучерова
С) гидрирование ацетилена D) реакция А.М. Бутлерова Е) гидратация этилена
6. Молекулярная масса 2-метилбутаналя составляет:
А) 94 г/моль В) 86 г/моль С) 78 г/моль D) 92 г/моль Е) 66 г/моль
7. Массовая доля углерода в молекуле муравьиной кислоты составляет:
А) 26,08% В) 33,71% С) 25,5% D) 43,03% Е) 34,23%
8. Вычислите количество вещества уксусной кислоты, которое можно получить из 112 л ацетилена (н.у.):
А) 6 моль В) 5 моль С) 2 моль D) 4 моль Е) 4,5 моль
9. Масса ацетальдегида, который может быть получен из ацетилена, объем которого при нормальных условиях равен 56 л, составляет:
А) 87 г В) 96 г С) 110 г D) 112 г Е) 78 г
10. Рассчитайте массу масляной кислоты, которая образуется при окислении бутанола-1 массой 40,7 г?
А) 12,6 г В) 29,5 г С) 36,2 г D) 48,4 г Е) 53,1 г
11. При окислении пропаналя аммиачным раствором оксида серебра, образовалось 43,2 г серебра. Вычислите массу пропаналя.
А) 11,6 г В) 15,9 г С) 23 г D) 18,1 г Е) 33,8 г
12. Рассчитайте массу, бензойной кислоты, которая может быть получена при окислении толуола массой 7,36 г. Массовая доля выхода кислоты равна 55%.
А) 6,87 г В) 9,81 г С) 4,36 г D) 1,92 г Е) 5,37 г
13. Рассчитайте массу метанола, который нужно окислить для получения 600 г формалина.
А) 256 г В) 323 г С) 489 г D) 283 г Е) 518 г
14. Вычислите массу соли, которая образуется при взаимодействии уксусной кислоты массой 12 г с гидроксидом натрия:
А) 12,5 г В) 18,3 г С) 16,4 г D) 24,8 г Е) 21 г
15. Из этилена объемом 280 л (н.у.) получили этаналь массой 330 г. Рассчитайте массовую долю выхода продукта.
А) 50 % В) 60 % С) 70 % D) 80 % Е) 90 %
Тема: «Альдегиды. Карбоновые кислоты»
Вариант-2
1. Укажите общую формулу карбоновых кислот:
А) R-COOH В) R-COH
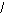
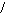 С) О D) R-OH Е) R-СH2-СОН
С) О D) R-OH Е) R-СH2-СОН
 R-C
R-C
Н
2. Согласно систематической номенклатуре названия альдегидов образуются путем прибавления к соответствующему углеводороду суффикса …
А) – ол В) –аль С) – ил D) – ин Е) –илен
3. В результате взаимодействия уксусной кислоты с магнием образуется…
А) формиат магния В) ацетат магния С) пропионат магния
D) сложный эфир Е) триглицерид
4. Назовите по систематической номенклатуре следующее вещество:
![]() СН3 –СН2-СН-СООН
СН3 –СН2-СН-СООН
СН3
А) 2-метилбутановая кислота В) 3-этилпропановая кислота
С) 3-метилбутановая кислота D) валериановая кислота
Е) масляная кислота
5. 40% раствор муравьиного альдегида в воде называется ?
А) формальдегид В) формалин
С) форманаль D) пропаналь Е) ацетальдегид
6. Молекулярная масса энантовой кислоты равна:
А) 140 г/моль В) 150 г/моль С) 130 г/моль D) 120 г/моль Е) 160 г/моль
7. Массовая доля углерода в молекуле хлоруксусной кислоты составляет:
А) 33,54% В) 28,69% С) 41,34% D) 25,39% Е) 18,86%
8. Вычислите количество вещества муравьиного альдегида, если его масса сотавляет 320 г:
А) 10,6 моль В) 15 моль С) 12,5 моль D) 4,8 моль Е) 4,5 моль
9. При каталитическом гидрировании 55 г этаналя образовался спирт. Рассчитайте массу спирта.
А) 23,4 г В) 57,5 г С) 65,8 г D) 34,2 г Е) 47,9 г
10. Органическое вещество содержит 54,55 % углерода, 9,09 % водорода и 36,36 % кислорода. Относительная плотность паров по водороду равна 22. Определите молекулярную формулу альдегида.
А) С3Н6О В) СН2О С) С2Н4О D) С4Н8О Е) С5Н10О
11. Масса формальдегида, который может быть получен окислением метанола, объем которого при нормальных условиях равен 28 л, составляет:
А) 27,5 г В) 36 г С) 18,9 г D) 37,5 г Е) 25,6 г
12. Вычислите массу альдегида, который был получен при взаимодействии 13,8 г этанола с оксидом меди (II).
А) 13,2 г В) 15 г С) 16,1 г D) 18,7 г Е) 21 г
13. В результате взаимодействия муравьиной кислоты с аммиачным раствором оксида серебра, образовалось 5,4 г серебра. Рассчитайте массу муравьиной кислоты.
А) 1,23 г В) 1,15 г С) 2,45 г D) 5,2 г Е) 4,23 г
14. При взаимодействии 18 г пропионовой кислоты с гидроксидом натрия, образовалась соль. Вычислите массу этой соли.
А) 18,9 г В) 28,16 г С) 23,35 г D) 31,23 г Е) 11,46 г
15. При окислении 8,8 г уксусного альдегида аммиачным раствором оксида серебра, образовалось 10 г уксусной кислоты. Рассчитайте теоретический выход уксусной кислоты.
А) 66,6 % В) 45,8 % С) 70 % D) 29,9 % Е) 83,3 %
Тема: «Альдегиды. Карбоновые кислоты»
Вариант-3
1. В зависимости от строения радикала карбоновые кислоты классифицируют на…
А) предельные, ароматические, одноосновные
В) предельные, непредельные, ароматические
С) предельные, непредельные, циклические
D) предельные, циклические, одноосновные
Е) непредельные, многоосновные, ароматические
2. Молекулярной формулой какого альдегида является СН2О:
А) муравьиный альдегид В) уксусный альдегид
С) пропионовый альдегид D) масляный альдегид Е) валериановый альдегид
3. Укажите вещество, которое образуется в результате следующей реакции: 2СН3-СООNa +Н2SO4 →Na2 SO4 + …
А) этановая кислота В) пропановая кислота
С) капроновая кислота D) масляная кислота Е) муравьиная кислота
4. Реакция «Серебряного зеркала» означает взаимодействие альдегида с…
А) атомом серебра В) оксидом серебра
С) гидроксидом серебра D) хлоридом серебра Е) сульфидом серебра
5. Для карбоновых кислот характерны такие же виды изомерии, что и для …
А) спиртов В) альдегидов С) ароматических углеводородов
D) диеновых углеводородов Е) сложных эфиров
6. Молекулярная масса стеарата натрия равна:
А) 285 г/моль В) 346 г/моль С) 209 г/моль D) 332 г/мольЕ) 306 г/моль
7. Массовая доля кислорода в молекуле гексаналя равна:
А) 22% В) 16% С) 18% D) 24% Е) 38%
8. Вычислите массу муравьиной кислоты количеством вещества 2 моля.
А) 98 В) 92 С)99 D) 81 Е) 86
9. Определите количество вещества масляной кислоты, если ее объем составляет 224л.
А) 17моль В) 42 моль С) 10 моль D) 35 моль
Е) 11 моль
10. При дегидрировании 20 г метанола образуется муравьиный альдегид массой.
А) 18,75 г В) 23,17 г С) 13,65 г D) 23 г Е) 11,1 г
11. В результате реакции «Серебряное зеркало» с муравьиным альдегидом, образовалось 102 г муравьиной кислоты. Какая масса формальдегида вступила в реакцию.
А) 56,8 г В) 47 г С) 86,5 г D) 66,5 г Е) 32 г
12. При окислении масляного альдегида гидроксидом меди (II) образовалась масляная кислота массой 49 г. Вычислите массу альдегида.
А) 33г В) 48,5г С) 42,08 г D) 39 г Е) 40,09 г
13. Вычислите массу жидкого мыла, которое образуется при взаимодействии 580 г стеариновой кислоты с гидроксидом калия.
А) 657,6 г В) 533 г С) 456,5 г D) 386,9 г Е)441 г
14. Вычислите массу формальдегида при окислении, которого образовалось 27 г муравьиной кислоты.
А) 15,2 г В) 12,7 г С) 17,6 г D) 16,5 г Е) 18 г
15. При окислении этанола, объемом 180 л получили ацетальдегид. Определите массу ацетальдегида, если его выход составляет 90 %.
А) 248,5 г В) 313,8 г С) 415,68 г D) 318,15 г Е) 455,4 г
Тема: «Альдегиды. Карбоновые кислоты»
Вариант-4
1. Функциональная группа карбоновых кислот называется:
А) гидроксильная В) карбонильная С) карбоксильная
D) аминогруппа Е) нитрогруппа
2. Этаналь по исторической номенклатуре называется:
А) валериановый альдегид В) уксусный альдегид
С) пропионовый альдегид D) масляный альдегид
Е) муравьиный альдегид
![]()
![]() 3. Дайте название по систематической номенклатуре следующему веществу: Н3С-СН2-СН-СН-СН2-СООН
3. Дайте название по систематической номенклатуре следующему веществу: Н3С-СН2-СН-СН-СН2-СООН
СН3 С2Н5
А) 4-метил,3-этил гексановая кислота
В) 3-метил,4-этил гексановая кислота
С) 4-метил,3-этил капроновая кислота
D) 3-этил, 4-метил гексановая кислота
Е) 3-метил,4-этил капроновая кислота
4. Укажите продукты реакции: СН3 –СОН + Аg2О → …
А) СН3 –СОАg +Н2О В) СН3 –СООН + 2Аg
С) СН3 –СООАg + О2 D) СН3 –СОН + АgОН
Е) СН3 –СООН + Аg2О
5. Альдегид, содержащий 8 атомов водорода, называется:
А) уксусный В) пропионовый С) масляный
D) муравьиный Е) валериановый
6. Молекулярная масса пентаналя составляет:
А) 76 г/моль В) 99 г/моль С) 86 г/моль
D) 67 г/моль Е) 55 г/моль
7.Массовая доля кислорода в молекуле энантовой кислоты составляет:
А) 24,6 % В) 17,8 % С) 23,2 % D) 14,7 % Е) 18 %
8. Вычислите массу бутаноле, количеством вещества 4 моль.
А) 313 г В) 288г С) 136 г D) 465 г Е) 220 г
9. При взаимодействии масляной кислоты с этиловым спиртом образовалось 48,6 г сложного эфира. Определите массу масляной кислоты.
А) 13,86 г В) 29,5 г С) 33,75 г D) 42,7 г Е) 36,86 г
10. При окислении 40 % - го раствора этилового спирта объемом 0,5 л (ρ= 0,92 г/моль) образовалась уксусная кислота массой:
А) 240 г В) 145 г С) 320 г D) 215 г Е) 150 г
11. Вычислите количество вещества 2,2 – диметилпропаналя, если его масса составляет 142 г.
А) 2 моль В) 1,65 моль С) 2,85 моль D) 1 моль Е) 4 моль
12. Определите альдегид, который содержит 54,54 % - углевода, 9,1 % -водорода, 36,36 – кислорода.
А) муравьиный В) пропионовый С) уксусный
D) валерьяновый Е) масляный
13. Какой объем метана потребуется чтобы синтезировать 30 т муравьиной кислоты, если ее выход составляет 90 % (н.у.)
А) 15681,13 м3 В) 14568,3 м3 С) 12213,65 м3
D) 10745,55 м3 Е) 16230,26 м3
14. При окислении бутанола образовалось 24 г масляного альдегида. Рассчитайте массу бутанола.
А) 18,7 г В) 34,5г С) 17,8 г D) 24,6 г Е) 12 г
15. При взаимодействии карбоновой кислоты со спиртом образовался пропилацетат массой 33,15 г. Вычислите массу кислоты, если выход сложного эфира составляет 65 %.
А) 15 г В) 25 г С) 40 г D) 30 г Е) 22,1 г
Тема: «Альдегиды. Карбоновые кислоты»
Вариант-5
1. К высшим предельным карбоновым кислотам относится:
А) энантовая В) стеариновая С) линолевая D) нонановая Е) капроновая
2. Межклассовая изомерия, характерная для альдегидов связывает их с классом:
А) карбоновых кислот В) спиртов
С) сложных эфиров D) кетонов Е) аренов
3. Каким способом нельзя получить карбоновые кислоты?
А) окисление альдегидов В) окисление спиртов
С) из солей карбоновых кислот D) окисление бутана
Е) гидратация ацетилена
4. Дайте название веществу по систематической номенклатуре:
![]() Н3С – СН2- СН –СОН
Н3С – СН2- СН –СОН
Вr
А) 3-бром бутаналь В) броммасляный альдегид
С) дибромбутан D) 2-бромбутановая кислота Е) 2-бромбутаналь
5. Наибольшее практическое значение имеет кислота:
А) муравьиная В) уксусная С) пропионовая
D) масляная Е) капроновая
6. Молекулярная масса масляной кислоты составляет:
А) 58 г/моль В) 88 г/моль С) 56 г/моль
D) 48 г/моль Е) 25 г/моль
7. Вычислите массу метаналя количеством вещества 1,6 моль
А) 48 г В) 67 г С) 35 г D) 45 г Е) 52 г
8. При взаимодействии уксусной кислоты с метанолом, образовалось 54 г сложного эфира. Определите массу уксусной кислоты:
А) 42,5 г В) 43,78 г С) 34,6 г D) 56 г Е) 32,95г
9. Органическое вещество, в котором массовая доля углевода составляет 62,06 %, водорода – 10,32, кислорода – 27,58 %, имеет плотность паров по воздуху 2. Выведите молекулярную формулу вещества.
А) С5Н8О В) С2Н4О С) С6Н12О D) С3Н6О Е) СН20
10. Определите массовую долю уксусной кислоты в растворе, полученном растворением в воде массой 45 г уксусной кислоты массой 15 г.
А) 5% В) 17 % С) 25% D) 11 % Е) 50 %
11. Массовая доля углевода в молекуле олеиновой кислоты составляет
А) 23 % В) 42 % С) 55% D)45,6 % Е) 76,6 %
12. При взаимодействии муравьиной кислоты массой 63 г с метанолом, образовался сложный эфир, массой:
А) 82,17 г В) 79,25 г С) 52,21 г D) 85,32 г Е) 86,31 г
13. При взаимодействии 25 г бутанола-1 с оксидом меди (I) образовался альдегид массой
А) 32,8 г В) 26,7 г С) 18,6г D) 24,3 г Е) 23,4 г
14. При взаимодействии стеариновой кислоты с гидроксидом калия образовалось жидкое мыло массой 340 г. Вычислите массу кислоты
А) 184,2 г В) 299,8 г С) 356,8 г D) 123,6 г Е) 320 г
15. При взаимодействии 8,8 г уксусного альдегида с аммиачным раствором оксида серебра, образовалось 10 г уксусной кислоты. Рассчитайте теоретический выход уксусной кислоты.
А) 70 % В) 66,3 % С) 83,3 % D) 18,7 % Е) 86,2 %
Тема: «Альдегиды. Карбоновые кислоты»
Вариант-6
1. Органические соединения, в молекулах которых содержится одна карбоксильная группа, соединенная с ароматическим радикалом, называется:
А) одноосновные предельные карбоновые кислоты
В) одноосновные непредельные карбоновые кислоты
С) одноосновные ароматические карбоновые кислоты
D) многоосновные ароматические карбоновые кислоты
Е) многоосновные непредельные карбоновые кислоты
2. Валериановому альдегиду соответствует формула:
А) С5Н10О В) С4Н8О С) С5Н10О2 D) С6Н10О Е) С5Н12О
3. Реакция взаимодействия карбоновых кислот со спиртами называется:
А) гидролиз В) окисления С) изомеризации
D) этерификации Е) гидрирования
4. Уксусный альдегид иначе можно назвать:
А) формалин В) ацетальдегид С) формальдегид
D) метаналь Е) пропионовый альдегид
5. Определите вещество Х в цепочке превращений:
С2Н6 → С2Н2→ Х→СН3СООН
А) С6Н6 В) СН3СОН С) С2Н4 D) СН4 Е) Н-СООН
6. Молекулярная масса гептаналя составляет
А) 165 В) 112 С) 114 D) 144 Е) 313
7. Рассчитайте массовую долю углерода в пропилформиате.
А) 54,5 % В) 68,7 % С) 42,6 % D) 40 % Е) 56,2 %
8. Вычислите массу капроновой кислоты количеством вещества 0,8 моль
А) 102,6 г В) 81,4 г С) 98,7 г D) 96,5 г Е) 92,8 г
9. Органическое вещество, в котором массовая доля углерода составляет 66,66 %, водорода – 11,11%, кислорода-22,22 %, имеет плотность по водороду 36. Выведите молекулярную формулу вещества.
А) С4Н8О В) С2Н4О С) С6Н12О D) С3Н6О Е) СН20
10. При взаимодействии уксусной кислоты с кальцием, получили ацетат кальция массой 80 г. Определите массу уксусной кислоты.
А) 53,75 г В) 60,75 г С) 46,75 г D) 42,75 г Е) 34,75 г
11. Вычислите массу пропионовой кислоты в 210 г раствора, если ее массовая доля составляет 68 %.
А) 144 г В) 156,2 г С) 138,6 г D) 142,8 г Е) 140 г
12. Какой объем оксида углерода (IV) образуется при горении пропаналя массой 2,3 г
А) 2 л В) 1,4 л С) 3,8 л D) 5л Е) 2,6 л
13. При окислении гептаналя массой 1,8 г, образовалась энантовая кислота массой.
А) 2,05 г В) 4,05 г С) 1,05 г D) 6,05 г Е) 3,05 г
14. Какая масса раствора с массовой долей гидроксида натрия 4 % расходуется на нейтрализацию уксусной кислоты массой 18 г
А) 250 г В) 400 г С) 300 г D) 700 г Е) 100 г
15. Определите массу уксусной кислоты, которая расходуется для синтеза уксусно-этилового эфира, если полученная масса 70,4 г составляет 80 % от теоретического.
А) 20 г В) 60 г С) 80 г D) 120 г Е) 70 г
ответы
АЛЬДЕГИДЫ. КАРБОНОВЫЕ КИСЛОТЫ.
|
| -
| -
| -
| -
| -
| -
| -
| -
| -
| -
| -
| -
| -
| -
| -
|
| 1В | B | E | A | B | B | B | A | B | C | D | A | E | A | C | B |
| 2В | A | B | B | A | B | C | D | A | B | C | D | A | B | C | E |
| 3В | B | A | A | B | B | E | B | B | C | A | D | E | A | C | D |
| 4В | C | B | A | B | C | C | A | B | E | A | B | C | E | D | D |
| 5В | B | D | E | E | B | B | A | B | D | C | E | A | D | B | C |
| 6В | C | A | D | B | B | C | A | E | A | B | D | E | A | C | B |

 Получите свидетельство
Получите свидетельство Вход
Вход



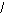
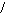 С) О D) R-OH Е) R-СH2-СОН
С) О D) R-OH Е) R-СH2-СОН R-C
R-C








 Тесты по химии "Альдегиды и карбоные кислоты" (57.2 КB)
Тесты по химии "Альдегиды и карбоные кислоты" (57.2 КB)
 0
0 11328
11328 1058
1058 Нравится
0
Нравится
0



