Вы помните, что все вещества клетки делятся на неорганические и органические. Сегодня рассмотрим более подробно неорганические вещества. А конкретно – воду. Вдумайтесь в это древнегреческое изречение: «Самое лучшее – это вода: лучше, чем Олимпийские игры, лучше, чем золото».
Человек может продержаться без воды несколько дней. Космические аппараты, которые всё чаще направляют к другим планетам, преследуют главную цель – поиск воды. Потому что наличие оксида водорода на планете – непременное условие существования жизни. По крайней мере, той формы жизни, к которой принадлежим мы и все окружающие нас живые организмы.
Именно
вода стала колыбелью зарождения первых живых организмов на Земле. И вот уже 4
миллиарда лет вода – основное вещество, из которого состоит живая природа. Так
почему именно вода? Ведь на Земле миллионы других химических соединений!
Вначале более подробно поговорим о содержании воды в живых организмах. В
среднем оно составляет 60–75 % их массы, но может значительно
колебаться. Рекордсмены здесь – медузы, которые ну просто одна
вода – 98 %. Не отстаёт и растительный мир – в листьях и сочных
плодах наших зелёных собратьев содержание воды также может достигать
фантастических 98 %.
У человека количество воды неодинаково в разных тканях и органах. В сером
веществе головного мозга её содержание составляет 85 %, в костях
– 22, а в эмали зуба всего 2–3 %. При
этом наибольшее содержание воды в организме наблюдается в эмбриональный
период, когда мы по водоносности практически не уступаем медузам – 95
%. Но с возрастом содержание воды в теле человека неуклонно уменьшается.
Задумайтесь, кстати, почему.
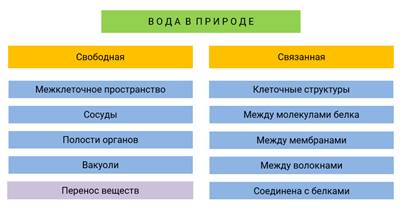
Вы помните из химии, что вода в природе находится в двух формах: свободной и связанной. В живых организмах свободная вода находится в межклеточных пространствах, сосудах, полостях органов, вакуолях. В основном она служит для переноса веществ из окружающей среды в клетку и наоборот. Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами, и соединена с некоторыми белками.
Мы
уже сказали в начале, что вода выполняет уникальные функции в живой природе.
Это значит, что она обладает и уникальными свойствами. А функции и свойства
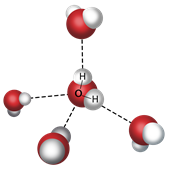
всегда зависят от строения. Вспомним строение молекулы воды.
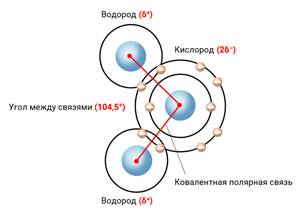
H2O. Эта формула известна любому
ребёнку. А вот как соединяются атомы водорода и кислорода между собой, вы могли
подзабыть. Связи Н-О-Н ковалентные полярные и располагаются под углом
104,5°. Как известно, кислород обладает более
высокой электроотрицательностью, чем водород, поэтому атом кислорода
притягивает к себе общие электронные пары и приобретает частично отрицательный
заряд. Ну а атомы водорода, от которых отодвинули их электроны, становятся
частично положительными.
Таким образом, молекула воды поляризована и является диполем. Этот факт – первая ступенька к раскрытию тайны воды.
Далее
обратим внимание на размеры молекулы воды. Приблизительно это 3·10-10 м.
То есть молекула оксида водорода очень мала. Она самая маленькая из всех
известных оксидов, что логично – в её состав входит два самых маленьких по
диаметру атома. Например, другой ключевой оксид живых организмов – оксид
углерода четыре – образован молекулами диаметром уже 3,3·10 -10 м.
Итак, маленькие размеры молекулы – вторая составляющая уникальных
свойств воды. К ним и перейдём.
1. Вода – универсальный растворитель.
В
ней прекрасно растворяются ионные соединения (кислоты, основания, соли) и некоторые
неионные, но полярные соединения. То есть те, в молекуле которых присутствуют
заряженные (полярные) группы, например, сахара (вы сталкиваетесь с этим каждый
день, правда?), а также простые спирты, аминокислоты.
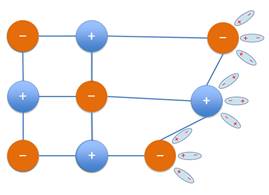
Почему же вода так хороша в этом отношении? А потому что её молекулы, как мы
говорили, тоже полярны. Между молекулами воды и растворяемого вещества
тут же возникает электростатическое притяжение, которое приводит к образованию
так называемых водородных связей. И вода просто разрывает растворяемое
вещество.
Вы
же помните, что молекулы находятся в постоянном движении. И чем больше
температура, тем выше скорость их движения, поэтому справиться с сахаром в
утренней чашке чая нам легче кипятком.
Вещества, хорошо растворимые в воде, называются гидрофильными (от
греческого hygros – «влажный» и philia –
«дружба», «склонность»).
Зачем же вещества вообще растворять и почему это так важно? Когда вещество
переходит в раствор, значительно увеличивается его площадь соприкосновения,
молекулы или ионы могут двигаться более свободно и, следовательно, реакционная
способность вещества резко возрастает. Вот почему вода является основной
средой, в которой протекает большинство химических реакций. А все реакции
гидролиза и многочисленные окислительно-восстановительные реакции идут при
непосредственном участии воды.
Но способности воды к растворению не безграничны. Нам не удаётся отмыть жирные
руки без мыла. Потому что жиры, а также нуклеиновые кислоты и некоторые белки,
а это неполярные вещества, в воде не растворяются и называются гидрофобными
(от греческого phobos – «страх»). Но наличие таких веществ
– это не недостаток и не минус воде. Гидрофобные вещества могут образовывать с
водой поверхности раздела, на которых протекают многие химические реакции.
Поэтому тот факт, что вода не растворяет неполярные вещества, для живых
организмов также очень важен.
Ещё физиологически важным свойством воды является её способность растворять
газы. Например, растворённым в воде кислородом дышит большинство водных
обитателей. Ну вы знаете.
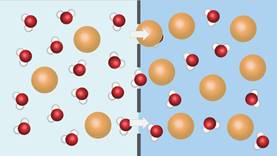
Как растворитель, вода принимает участие в явлениях осмоса, играющих важнейшую
роль в жизнедеятельности клеток организма. Запомните, осмос – это
направленное движение молекул
воды через полупроницаемую мембрану из области с меньшей концентрацией
растворённых веществ в область с более высокой концентрацией этих веществ. То есть вода движется туда, где её меньше. Вот как это
происходит.
Полупроницаемая мембрана, например плазмалемма, способна пропускать маленькие
молекулы воды, а крупные молекулы, например сахаров, – задерживать. Если
разделить два раствора с разной концентрацией растворённых веществ, то через
некоторое время их концентрация выравняется. Но не за счёт перемещения молекул
растворённых веществ – они останутся на своих местах, а за счёт перемещения
молекул воды. Движение воды в сторону более высокой концентрации растворённых
веществ создаёт давление. Такое давление называется осмотическим. Чем
выше разность концентраций растворов, тем выше осмотическое давление.
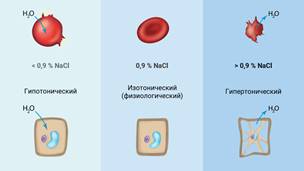
Растворы, осмотическое давление которых такое же, как в
клетках, называются изотоническими. Такие растворы, не вызывающие
изменение осмотического давления, относят к физиологическим. Вы, наверное,
встречались с водным раствором поваренной соли, в котором массовая доля NaCl составляет 0,9 %. Это и есть физиологический раствор,
который применяют в медицине.
Если концентрация раствора больше, чем у изотонического (то есть больше, чем
0,9 % NaCl), то такой раствор будет являться гипертоническим
(от греческого hyper – «сверх», «чрезмерно»). Соответственно, растворы с
более низкой концентрацией будут называться гипотоническими (от
греческого hypo – «под», что означает «ослабление»).
Почему в медицине применяют изотонические растворы? Как мы сказали, они не
изменяют осмотическое давление. Но что же произойдёт, если вместо
физиологического раствора применить раствор с другой концентрацией соли?
Давайте представим. Мы сделали инъекцию какого-либо препарата в кровь. Если мы
использовали при этом физиологический раствор, то концентрация соли в плазме не
изменится, и останется такой же, как в эритроцитах. Если же мы применим
гипертонический раствор, то повысим концентрацию соли в плазме, и вода начнёт выходить
из эритроцита, чтобы уравнять осмотическое давление.
Ну а введённый гипотонический раствор, наоборот, приведёт к поступлению воды в
эритроцит, что может привести к его разрыву. Эритроцит не выдержит давления
воды изнутри, так как этого не выдержит его клеточная мембрана.
А вот растительные клетки, покрытые толстой клеточной оболочкой, при увеличении
содержания воды остаются невредимыми, но становятся более упругими за счёт
осмотического давления воды на них изнутри. Если же воды перестаёт хватать –
растения увядают.
Давление цитоплазмы на клеточную стенку называется тургорным.
Второе
важнейшее свойство воды – высокая теплоёмкость.
Теплоёмкость – это отношение количества теплоты, полученного телом, к соответствующему
приращению его температуры. Количество тепла, необходимого для нагревания 1
г воды на 1°, достаточно, чтобы нагреть на 1° 9,25 г железа, 10,3
г меди. То есть вода обладает аномально высокой теплоёмкостью. В
чём секрет? В её строении. Мы с вами уже сказали, как происходит растворение в
воде полярных веществ: с образованием водородных связей между частично
положительными и частично отрицательными зарядами. Точно такие связи возникают
и между молекулами самой воды. Каждая из них стремится соединиться с четырьмя
соседними молекулами. Образуется сложная и прочная структура. Можно сказать –
монолитная, так как молекулы маленькие, связей очень много и держится всё это
очень прочно. Вот почему вода до последнего противится любому воздействию. В том
числе нагреванию. Ведь повышение температуры – это повышение скорости движения
молекул. А как её увеличишь, если все молекулы связаны по рукам и ногам
водородными связями.
Таким
образом вода, в большом количестве содержащаяся в живых организмах, помогает им
избегать резких перепадов температур в клетках и организме в целом, даже когда
колебания в окружающей среде достаточно велики. А как вы понимаете, это очень
важно для поддержания гомеостаза.
При испарении воды, когда между её молекулами также разрушаются водородные
связи, тратится много
теплоты – это позволяет регулировать температуру тела растениям при
транспирации, а животным при потоотделении.
3.
Высокая теплопроводность воды.
Благодаря этому свойству обеспечивается
равномерное распределение тепла по всему организму. Если бы в нашем организме
не было воды, то зимой нам нужно было бы надевать на руки не одни варежки, а
несколько.
4.
Высокое поверхностное натяжение воды.
Наверное, вы пробовали класть монетку на воду и добиваться того, чтобы она не
тонула. Это происходит из-за крепкого сцепления молекул воды водородными
связями с молекулами других веществ. В живых организмах благодаря высокому
поверхностному натяжению воды обеспечивается капиллярный кровоток, восходящий и
нисходящий токи в растениях.
На
этом всё. Секрет того, почему именно вода из миллионов других химических
соединений играет ключевую роль в живых организмах, раскрыт.
У оксида водорода маленькие и полярные молекулы, соединённые водородными
связями, – таково строение. Оксид водорода – универсальный растворитель,
у него высокая теплоёмкость, теплопроводность, теплота парообразования и
поверхностное натяжение – таковы свойства, основанные на его строении. И благодаря этим свойствам
вода выполняет уникальные функции в живых организмах. А её процентное
содержание зависит от интенсивности обмена веществ. У человека с возрастом
обмен веществ замедляется, соответственно клеткам не нужно прежнее количество
воды.
И закончим цитатой древнекитайского философа Лао Цзы: «Чтобы быть сильным, надо быть как вода. Нет препятствий – она течёт; плотина – она остановится; прорвётся плотина – она снова потечёт; в четырёхугольном сосуде она четырёхугольна; в круглом – кругла. Оттого, что она так уступчива, она нужнее всего и сильнее всего».

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 15332
15332

