Как и другие тела, жидкости могут являться проводниками, полупроводниками и диэлектриками. Например, дистиллированная вода является диэлектриком. Это легко подтверждается с помощью опыта. Поместим два электрода в ванну с водой. Эти электроды мы подсоединим к источнику тока, а также включим в цепь лампочку и выключатель. Как и всегда, с помощью выключателя мы можем замыкать и размыкать цепь, ну а лампочка будет служить индикатором того, что по цепи протекает электрический ток.

Итак, если мы замкнем цепь, то никакого электрического тока мы не получим: ведь дистиллированная вода является диэлектриком. Разомкнем цепь и насыплем в ванну некоторое количество самой обычной поваренной соли. Подождав, пока соль растворится, снова замкнем цепь. В этом случае, лампочка загорится, что будет означать протекание электрического тока по всей цепи. Давайте разберемся, как же соль могла повлиять на проводимость воды.
После того, как мы насыпали соль в ванну, там образовался солевой раствор. Как вы знаете из курса химии, молекулы воды являются полярными, так же, как и молекулы поваренной соли. Центр распределения положительного заряда в поваренной соли приходится на ион натрия, а центр распределения отрицательного заряда приходится на ион хлора. В результате, молекулы воды ориентируются таким образом, что вокруг иона натрия скапливаются отрицательные полюса молекул воды, а вокруг иона хлора — скапливаются положительные полюса молекул воды.
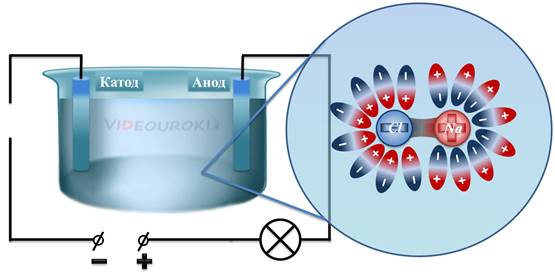
В этом случае, действие кулоновских сил достаточно велико, чтобы расщепить молекулу поваренной соли. То есть, молекула распадается на ион натрия и ион хлора.
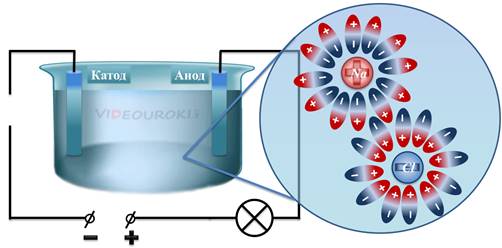
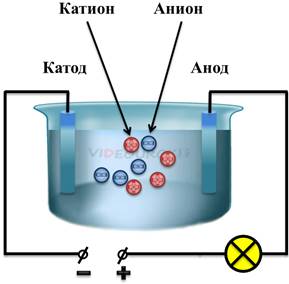
Таким образом, в растворе возникают заряженные частицы — ионы. В результате, отрицательные ионы (в данном случае ионы хлора), начинают двигаться к аноду, а положительные ионы (в данном случае ионы натрия) начинают двигаться к катоду. Это есть не что иное, как упорядоченное движение заряженных частиц, то есть электрический ток.
Процесс расщепления молекулы на ионы называется электролитической диссоциацией. То есть при электролитической диссоциации полярные молекулы распадаются под влиянием кулоновских сил. После распада молекулы, положительные ионы электролитов называются катионами, а отрицательные — анионами. Конечно, не все молекулы распадаются. Процент распавшихся молекул будет зависеть от концентрации раствора, температуры и, конечно, свойств самого электролита.
Таким образом, в водных растворах и расплавах электролитов возникает ионная проводимость. То есть, ионная проводимость — это проводимость, возникающая в результате переноса электрического заряда ионами. С ионной проводимостью связано понятие электролиза. Электролиз — это процесс выделения вещества на электроде в результате окислительно-восстановительных реакций.
Изучением данных вопросов активно занимался уже известный нам ученый Майкл Фарадей. Именно Фарадей впервые ввел такие термины, как электролиты, катионы и анионы, катод и анод.
Фарадей задался вопросом о том, как вычислить массу вещества, выделившегося на электроде в результате протекания электрического тока через электролит. Эту массу можно вычислить:
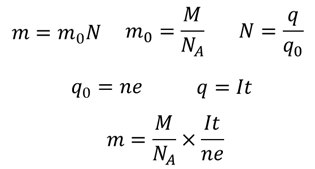
Именно к такому выводу и пришел Фарадей, установив, что масса вещества, выделившегося на электроде прямо пропорциональна силе тока, протекающего через электролит и времени протекания тока. Этот закон получил название закона Фарадея или закона электролиза. Как мы видим, в формуле есть несколько констант, которые было решено заменить на одну константу: 𝑚=𝑘𝐼𝑡. Эта константа называется электрохимическим эквивалентом.
Если мы выразим электрохимический эквивалент из формулы, описывающей закон электролиза, то убедимся, что он измеряется в килограммах на кулон:
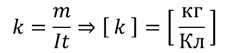
Иногда электрохимический эквивалент разделяют на две константы: число Фарадея (равного произведению элементарного заряда и числа Авогадро) и химический эквивалент (равный отношению молярной массы вещества к его валентности):
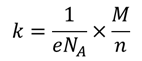
Электрохимические эквиваленты сведены в таблицы:
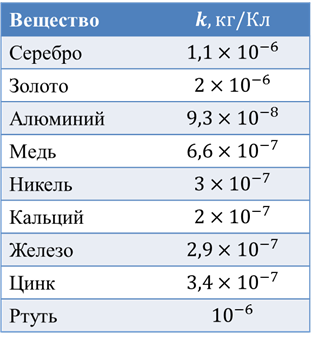
Но, даже если у вас нет этой таблицы, вы все равно сможете вычислить электрохимический эквивалент любого элемента, используя таблицу Менделеева. Для примера возьмем серебро:
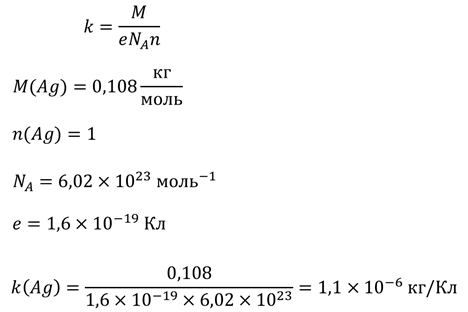
Кстати говоря, закон электролиза можно использовать, для экспериментального определения заряда электрона. Силу тока, протекающего через электролит, мы можем измерить, так же как и время протекания тока. Массу выделившегося на электроде вещества измерить тоже несложно. Таким образом, закон электролиза позволяет определить элементарный заряд:
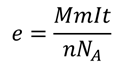
Электролиз широко используется в промышленности. Например, он используется для очистки металлов от примести, или, наоборот, для покрытия поверхности каким-то металлом. Такие процессы, как никелирование, хромирование, оцинковка или омеднение осуществляются благодаря открытию электролиза.
Пример решения задачи.
Задача. Для никелирования детали площадью 0,3 м2, на деталь требуется нанести слой толщиной 0,08 мм. Плотность никеля равна 8900 кг/м3. Какой ток нужно пустить через электролитическую ванну, чтобы полностью закончить никелирование за 3 часа?


 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 7978
7978

