Положение химического элемента зависит от заряда ядра атома, или от числа протонов. И, если изменить число протонов в ядре, то будет образовываться совсем другой химический элемент. Эти процессы называются ядерными.
Ядерные процессы протекают с выделением большого количества энергии, как, например, на Солнце, когда ядра атомов водорода соединяются и образуют ядра атомов гелия. Но если не изменять число протонов, т.е. заряд ядра, а только число нейтронов, то другого химического элемента не образуется, образуется тот же элемент, но с другой массой. Эти разновидности элементов с разной массой называют изотопами.
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разное массовое число. Слово изотоп состоит из двух греческих слов: изос – «одинаковый» и топос – «место».
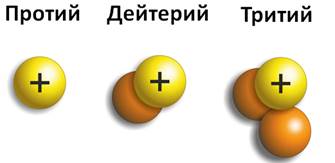
Химические элементы, встречающиеся в природе, являются смесью изотопов. Например, у водорода есть три изотопа, каждый из которых отличается не только массовым числом, но и имеет свое название. Первый изотоп – это протий, с массовым числом равным единице, второй изотоп – это дейтерий, у которое массовое число равно двум, третий называется тритием и массовое число его равно трем. Но число протонов одинаково, т.е. в ядре каждого из них содержится один протон.
Относительная атомная масса имеет дробное значение. В природе один и тот же химический элемент представляет собой смесь изотопов, тогда относительная атомная масса является средним значением атомных масс природной смеси изотопов данного химического элемента с учетом содержания их в природе.
Разберём это на примере. Атомы хлора состоят из смеси двух изотопов с массовым числом 35, их в природе 75% и с массовым числом 37, которых в природе встречается 25%. Следовательно, относительная атомная масса хлора вычисляется таким образом:
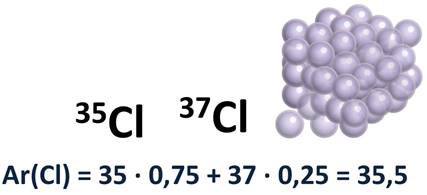
На основании знаний о строении атома, существования изотопов, можно дать более точное определение химического элемента – это совокупность атомов с одинаковым зарядом ядра.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 19578
19578


