Электронная конфигурация атомов химических элементов изменяется периодически с ростом зарядов их ядер, поэтому и все свойства, которые определяются электронным строением, закономерно изменяются по периодам и группам. К этим свойствам относятся: атомные и ионные радиусы, электроотрицательность и другие.

Условно форму атома или иона можно представить шарообразной, поэтому количественной характеристикой их размера служит радиус.
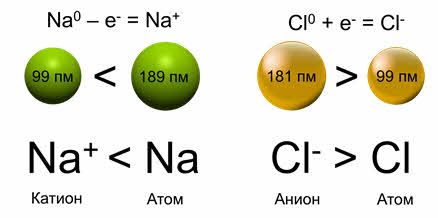
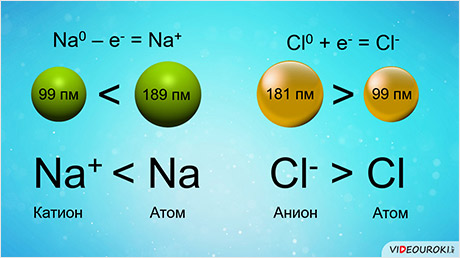
Различают атомные и ионные радиусы. Радиусы положительно заряженных ионов (катионов) всегда меньше радиусов атомов соответствующих элементов, так они отдают электроны, чтобы превратиться в катионы, а радиусы отрицательно заряженных ионов (анионов) больше радиусов атомов, потому что они образовались путём присоединения электронов к атомам.
Например, радиус атома натрия 189 пикометров, а иона натрия – 99 пикометров, радиус атома хлора 99 пикометров, а иона хлора – 181 пикометр.
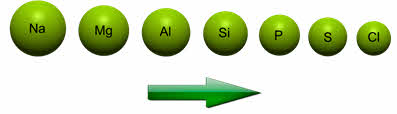
В периодах с увеличением зарядов ядер атомов, электроны сильнее притягиваются к ядру, что приводит к уменьшению радиусов атомов.
Например, у элементов третьего периода атомные радиусы уменьшаются от натрия к хлору.
Сравним строение атомов элементов, находящихся во втором периоде. Порядковый номер лития – три, азота – семь, фтора – девять, а неона – десять. Заряды ядер данных атомов, соответственно равны: у лития – плюс три, у азота – плюс семь, у фтора – плюс девять, у неона – плюс десять. Число электронов для каждого атома химического элемента равно значению заряда ядра, порядковому номеру и числу протонов в ядре. Значит у лития три электрона, у азота – семь, у фтора – девять, у неона – восемь.
Строение атомов элементов второго периода
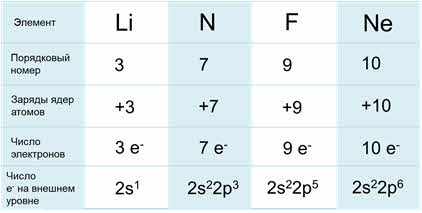
А чтобы определить, сколько электронов находится на внешнем уровне, необходимо посмотреть в какой группе Периодической системы находится данный химический элемент. Например, у лития на внешнем слое находится один электрон, так как он располагается в первой А группе. У азота на внешнем слое находится пять электронов, у фтора – семь электронов и у неона – десять электронов.
К концу второго периода количество электронов на внешнем энергетическом уровне возрастает.
Важно также знать, что число энергетических уровней атомов химических элементов равно номеру периода, в котором они находятся. У лития, азота, фтора и неона число энергетических уровней равно двум.
Атомный радиус к концу периода уменьшается, так как происходит взаимопритяжение ядра атома и электронов внешнего энергетического уровня.
В группах сверху вниз увеличивается число электронных слоёв, поэтому увеличиваются и радиусы атомов, и радиусы ионов. Например, в первой A группе идёт увеличения радиусов атомов: у лития – 155 пикометров, у натрия – 189 пикометров, у калия – 236 пикометров, радиус иона лития 68 пикометров, иона натрия – 99 пикометров, ионов калия – 138 пикометров.
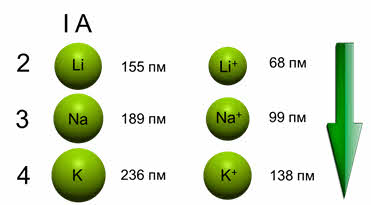
Рассмотрим изменение свойств для элементов второй группы главной подгруппы. Порядковый номер бериллия – четыре, у кальция – двадцать и у стронция – тридцать восемь. Сверху вниз по группе заряды ядер атомов увеличиваются. Количество электронов на внешнем энергетическом уровне остаётся неизменны, так как у всех химических элементов второй группы главной подгруппы на внешнем слое находится два электрона. К концу второй группы главной подгруппы количество энергетических уровней у атомов данных химических элементов постепенно возрастает, соответственно возрастает и атомный радиус.

Способность атомов отдавать электроны при увеличении атомного радиуса усиливается, а способность принимать электроны ослабевает. Значит, сверху вниз по группе металлические свойства увеличиваются.
Проявление металлических и неметаллических свойств связано со способностью присоединять или отдавать электроны.
Способности отдавать электроны количественно характеризуется энергией ионизации.
Энергия ионизации – это минимальная энергия, необходимая для отрыва от атома наиболее слабо связанного с ним электрона. Энергия ионизации выражается в килоджоулях на моль.
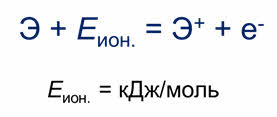
Наименьшую энергию ионизации имеют щелочные металлы, наибольшую – элементы седьмой A группы. Поэтому в периодах слева направо энергия ионизации увеличивается, так как увеличиваются заряды ядер и уменьшаются радиусы атомов.

В группах А сверху вниз энергия ионизации уменьшается, так как увеличивается расстояние между электронами внешнего слоя и ядром атома.

Вы знаете, что при отдаче электрона атом превращается в катион, поэтому энергия ионизации характеризует проявление металличности.
Для неметаллов, наоборот, характерна способность присоединять электроны, поэтому количественной характеристикой неметалличности является энергия сродства к электрону.
Энергия сродства к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому.
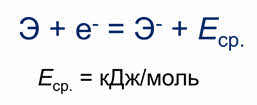
Следовательно, чем больше энергия сродства к электрону, тем легче атом присоединяет электрон. Эта величина также выражается в килоджоулях на моль.
Наибольшую энергию сродства к электрону имеют элементы седьмой A группы. Поэтому в периодах слева направо энергия сродства к электрону увеличивается, а в группах сверху вниз уменьшается.


Разберём, как же изменяется электроотрицательность по периодам и группам.
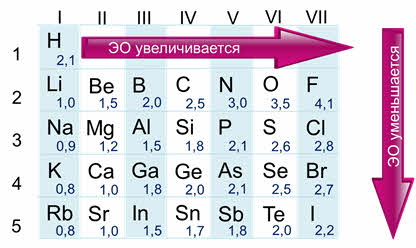
Электроотрицательность – это условная величина, характеризующая способность атомов в химических соединениях притягивать к себе электроны от других атомов.
Величина электроотрицательности зависит от энергии ионизации и от энергии сродства к электрону.

Для оценки этой способности принята условная шкала относительных электроотрицательностей. Здесь видно, что самым электроотрицательным является фтор, а наименее электроотрицательным рубидий.
Шкала электроотрицательности (Л. Полинг)
Как правило, у элементов А групп в периоде слева направо электроотрицательность возрастает, а в группах сверху вниз уменьшается. По величине электроотрицательности можно определить принадлежность элемента к металлам или неметаллам. Все неметаллы имеют большое значение электроотрицательности (больше двух), а у металлов это значение гораздо меньше (меньше двух). Элементы, у которых значение электроотрицательности близко к двум являются полуметаллами. Например, бор, кремний, германий, мышьяк, сурьма и тэллур.
Чтобы понять, в чем причина периодичности, сравним атомы элементов второй А группы. Порядковый номер бериллия четыре, номер двенадцать – у магния, номер двадцать – у кальция, номер тридцать восемь – у стронция.
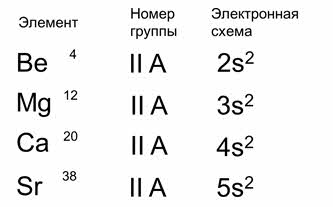
Во-первых, все эти элементы располагаются во второй группе главной подгруппе, имеют одинаковое строение внешнего энергетического уровня. Так, на внешнем энергетическом уровне у них по два электрона. Но электроны, которые находятся на внешнем энергетическом уровне расположены на разном удалении от их ядер. Поэтому активность у них разная, а свойства сходны. Это и есть причина периодичности – изменение строения внешнего и предвнешнего энергетических уровней и повторение числа электронов внешнего энергетического уровня.
А теперь, рассмотрим, как периодичность химических элементов сказывается на образуемых ими соединениях: оксидах и гидроксидах.
В качестве примера, рассмотрим второй период и проследим, как изменяются «металличность и неметалличность» по периоду. Во втором периоде располагаются: литий, бериллий, бор, углерод, кислород и неон.
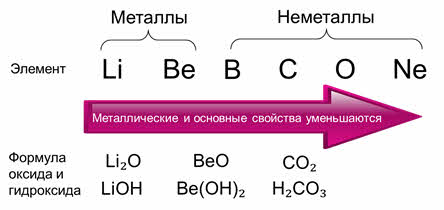
Литий и бериллий – это металлы, а бор, углерод, кислород и неон – это неметаллы. Значит, металлические свойства по периоду слева направо уменьшаются, а неметаллические усиливаются.
Литию соответствует оксид лития, который проявляет основные свойства, бериллию соответствует оксид бериллия, который проявляет амфотэрные свойства, углероду соответствует оксид углерода четыре, который проявляет кислотные свойства. Аналогично и гидроксиды: гидроксид лития проявляет основные свойства, гидроксид бериллия – амфотэрные свойства, а гидроксид углерода – угольная кислота – проявляет кислотные свойства.
Значит, по периоду кислотные свойства увеличиваются, а основные уменьшаются слева направо.
Рассмотрим, как изменяются «металличность и неметалличность» на примере пятой А группы. К элементам этой группы относятяся: азот, фосфор, мышьяк, сурьма и висмут.
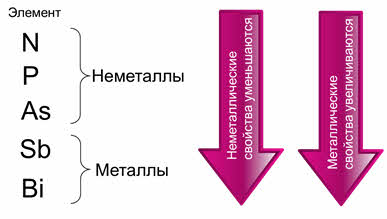
Азот, фосфор и мышьяк являются неметаллами, а сурьма и висмут – металлами. Сурьма и висмут считаются полуметаллами, так как находятся на границе с неметаллами. Значит, неметаллические свойства атомов химических элементов уменьшаются сверху вниз по группе, а металлические – увеличиваются.
Таким образом, в периоде при переходе от одного элемента к другому происходит ослабление основных и усиление кислотных свойств высших оксидов и гидроксидов.
Элементы, расположенные в одной группе, имеют одинаковое строение внешних электронных оболочек и поэтому проявляют схожие химические свойства.
Характер изменения свойств элементов и их соединений повторяется во всех периодах (кроме первого), поэтому такое изменение свойств называется периодическим.

 Получите свидетельство
Получите свидетельство Вход
Вход




 9759
9759

