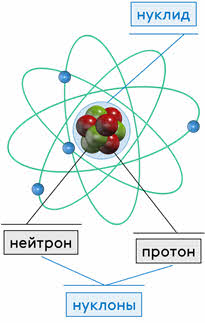
Практически сразу после открытия нейтрона советским физиком Дмитрием Иваненко и немецким учёным Вернером Гейзенбергом была предложена протонно-нейтронная модель атомного ядра. Согласно ей, ядра всех химических элементов (за исключением водорода) состоят из двух видов частиц: протонов и нейтронов. Протоны и нейтроны называют нуклонами (от латинского «нуклеус» — ядро), а ядра атомов — нуклидами.
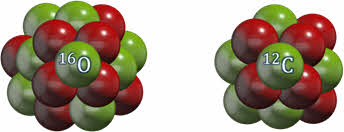
Общее число нуклонов в ядре называют массовым числом и обозначают буквой А. Оно ставится вверху перед буквенным обозначением химического элемента.
Например, массовое число кислорода равно 16, а углерода — 12.
Мы уже говорили о том, что массовое число принято выражать в атомных единицах массы (сокращённо, а. е. м.) и округлять до целых чисел. Напомним также, что атомную единицу массы выражают через массу атома углерода; она равна 1/12 части массы атома углерода:
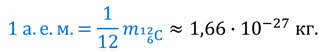
Число протонов в ядре соответствует порядковому или атомному номеру элемента в таблице Менделеева и называется зарядовым числом, поскольку оно определяет заряд ядра. Обозначается зарядовое число буквой Z.
В наших примерах, зарядовое число кислорода равно восьми, а углерода — 6.
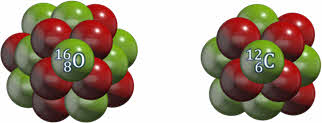
Как видно из приведённых примеров, зарядовое число ставится внизу перед буквенным обозначением элемента.
Напомним, что заряд протона положителен и равен элементарному электрическому заряду. Следовательно, зарядовое число численно равно заряду ядра, выраженному в элементарных электрических зарядах.
Так как атом в целом электрически нейтрален, то зарядовое число определяет одновременно и число электронов в атоме.
Число нейтронов в ядре обозначают большой буквой N. Нетрудно догадаться, что оно равно разнице между массовым и зарядовым числом:
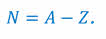
Таким образом, ядро любого атома обозначается буквенным символом элемента. Вверху указывается значение его массового числа, а внизу — зарядового.
В общем случае любой химический элемент периодической таблицы Дмитрия Ивановича Менделеева можно представить в виде:
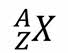
где под X подразумевается символ химического элемента.
Ещё раз уточним, каким образом определяется число протонов, электронов и нейтронов в ядре атома любого химического элемента. Во-первых, необходимо посмотреть в таблице Менделеева порядковый номер интересующего нас химического элемента. Таким образом мы найдём зарядовое число, то есть количество протонов и электронов в ядре. Затем, всё в той же таблице, необходимо посмотреть атомную массу этого элемента и округлить её до целых. Тем самым мы найдём массовое число, то есть общее количество нуклонов в ядре. И наконец, чтобы определить количество нейтронов в ядре атома, мы должны будем вычесть из массового числа зарядовое.
На основе новой, протонно-нейтронной модели строения атомных ядер, было дано объяснение многим экспериментальным фактам. Так, например, ещё в 1906—1907 годах учёными было выявлено, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. При этом атомы обладали одинаковыми химическими свойствами, а отделить их друг от друга было невозможно никакими химическими методами. Впервые, на существование таких атомов обратил внимание Фредерик Содди в 1910 году. Он предложил называть такие разновидности атомов одного и того же химического элемента изотопами (что по-гречески означает «равноместные»), так как по своим химическим свойствам они должны быть помещены в одну и ту же клетку таблицы Менделеева.
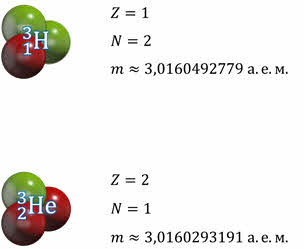
На основании многих экспериментов, было установлено, что изотопы одинаково вступают в химические реакции и образуют одинаковые соединения. Это говорило о том, что число электронов в электронных оболочках, а, значит, и заряд ядра у изотопов одинаковы. Следовательно, ядра изотопов различаются только числом нейтронов. Иными словами, химические свойства элементов определяются не атомной массой, а зарядовым числом ядра. Действительно, например, нуклиды водорода-три и гелия-три имеют близкие по величине атомные массы, но принципиально разные химические свойства.
Из всех известных на сегодняшний день изотопов (а они есть у всех химических элементов) только изотопы водорода имеют названия:
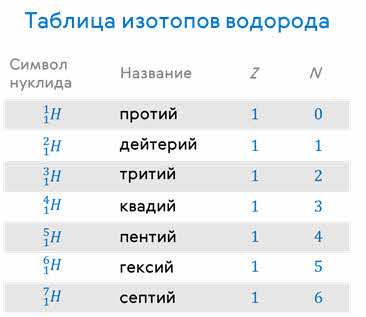
Протий является самым распространённым изотопом в природе, а его ядро содержит только один протон. Изотоп дейтерия (его ещё называют тяжёлой водой), содержит в своём ядре один протон и один нейтрон. Соответственно, у трития — один протон и два нейтрона. В настоящее время в лабораториях получены изотопы водорода и с большим числом нейтронов: тремя, четырьмя, пятью и даже шестью.
Следует отметить, что у разных атомов существует разное количество изотопов. Например, у урана их 26, но самыми распространёнными в природе являются два — это уран-235 (около 0,7 %), и уран-238 (чуть более 99 %). Вы, наверное, обратили внимание на то, что мы не называли зарядового числа изотопов урана. Дело в том, что обычно изотопы называют по их массовым числам, так как зарядовые числа у них одинаковые.
Отметим, что изотопы бывают устойчивые (или стабильные) и неустойчивые (то есть радиоактивные). Стабильные изотопы сохраняются сколь угодно долго.
А нестабильные изотопы со временем превращаются в другие химические элементы в результате радиоактивных превращений.
В настоящее время известно около 280 стабильных изотопов химических элементов и более 2 тыс. радиоактивных изотопов.
Как правило, природные элементы представляют собой смесь нескольких изотопов, поэтому возникает задача их разделения. Как мы уже знаем, магнитное поле искривляет траекторию движения заряженных частиц. На этом свойстве магнитного поля основано действие устройства, называемого масс-спектрографом, который используется для разделения изотопов по массовому числу.
Закрепления материала.

В заключении отметим, что предложенная Иваненко и Гейзенбергом протонно-нейтронная модель строения ядра впоследствии полностью была подтверждена экспериментально. Однако оставался нерешённым ещё один вопрос: почему ядра атомов не распадаются на отдельные нуклоны? Действительно, ведь мы знаем, что ядра атомов являются весьма устойчивыми образованиями, хотя в их состав входят одинаково заряженные частицы — протоны. А поскольку размеры ядер очень малы, то между протонами должны существовать огромные силы электрического отталкивания — порядка 230 ньютонов, что для частиц с массой порядка 10–27 степени килограмм является очень большой силой. Поэтому возникает вопрос: какое взаимодействие препятствует взаимному отталкиванию между одноимённо заряженными частицами?
Мы знаем, что, кроме электромагнитных сил, в природе существуют также гравитационные силы. Может быть, стабилизирующую роль в ядрах играет именно гравитационное взаимодействие между нуклонами?
Нет, так как расчёты показывают, что сила гравитационного притяжения между двумя протонами в ядре пренебрежимо мала по сравнению с силой электростатического отталкивания. Этот результат позволяет сделать вывод о том, что между ядерными частицами, по-видимому, действуют силы особой природы, радикально отличающиеся от гравитационных и электромагнитных сил. Эти силы принято называть ядерными силами. А так как ядерное взаимодействие во много раз превосходит электромагнитное, то его ещё называют сильным взаимодействием.
Другой особенностью ядерных сил является то, что они очень быстро убывают с увеличением расстояния между ядерными частицами. Проще говоря, они действуют на расстояниях, сравнимыми с размерами самих ядер.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 21547
21547

