Напомним, что в одном из прошлых уроков мы вывели уравнение состояния идеального газа (или уравнение Менделеева-Клапейрона):

Рассматривая случаи, когда масса и один из макроскопических параметров постоянны, можно вывести количественные зависимости между двумя другими макропараметрами. Такие зависимости называют газовыми законами.
Процессы, протекающие при постоянном давлении, постоянном объеме или постоянной температуре, называют изопроцессами.
Надо сказать, что это, опять же, идеализированные модели реальных процессов, поскольку поддерживать постоянство того или иного параметра с высокой точностью достаточно сложно. Тем не менее, в лабораторных условиях это возможно.
Итак, существует три изопроцесса: изотермический, изобарный и изохорный. Изотермический процесс — это процесс, происходящий при постоянной температуре.
Изобарный процесс — это процесс, происходящий при постоянном давлении.
Изохорный процесс — это процесс, происходящий при постоянном объеме.
Начнем с изучения изотермического процесса. Итак, рассмотрим уравнение состояния идеального газа при постоянной массе и температуре:

Сразу заметим, что постоянная масса означает постоянное количество вещества. Тогда, правая часть уравнения становится константой.
Из этого вытекает следующий закон: для газа данной массы при постоянной температуре произведение давления газа и его объема постоянно:

Этот закон был открыт двумя учеными: Робертом Бойлем и Эдмом Мариоттом, которые пришли к такому выводу, работая независимо друг от друга. Но, свое открытие они совершили приблизительно в одно и то же время, поэтому, закон стал называться законом Бойля-Мариотта.
Из уравнения, описывающего закон Бойля-Мариотта, выразим давление через объем, чтобы построить график:

Чисто логически, вы понимаете, что если произведение объема и давления остается постоянным, то это значит, что во сколько раз уменьшится объем, во столько же раз увеличится и давление. И наоборот: во сколько раз увеличится объем, во столько же раз уменьшиться давление. График зависимости давления от объема при постоянной температуре представляет собой гиперболу:
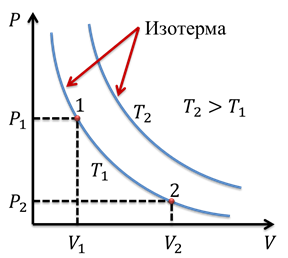
Кривая, отображающая этот график, называется изотермой. Изотерма, соответствующая более высокой температуре, будет лежать выше на графике зависимости давления от объема, поскольку при повышении температуры при постоянном объеме, повышается давление. Отметим на графике две произвольные точки 1 и 2. Точке 1 будут соответствовать давление Р1 и объем V1. Аналогично, точке 2 будут соответствовать давление Р2 и объем V2. Тогда мы можем записать, что

Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изотерме.
Надо сказать, что для осуществления изотермического процесса, сжатие или расширение газа должно происходить очень медленно.
Теперь поговорим об изобарном процессе. Запишем снова уравнение состояния идеального газа и рассмотрим его при условии, что давление и количество вещества постоянно:

Соответственно, следующий газовый закон звучит так: для газа данной массы при постоянном давлении отношение объема к температуре постоянно. Этот закон открыл Жозеф Гей-Люссак, поэтому, газовый закон, соответствующий постоянному давлению, называется законом Гей-Люссака.
Если мы выразим объем через температуру, то придем к линейной зависимости:

Поэтому, график зависимости объема от температуры при постоянном давлении является прямой линией. Эта линия называется изобарой.
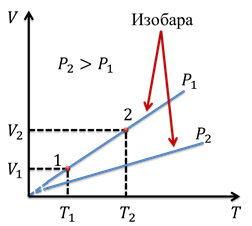
Изобара, соответствующая бо́льшему давлению, лежит ниже изобары, соответствующей меньшему давлению, поскольку с ростом давления объем газа уменьшается при постоянной температуре. Опять же, если мы отметим на графике две произвольные точки 1 и 2, то им будут соответствовать значения V1, T1 и V2, T2. Тогда можем записать, что

Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изобаре. Обратите внимание, что точки изобары вблизи абсолютного нуля обозначаются пунктиром. Дело в том, что, во-первых, абсолютный ноль недостижим, а во-вторых, при таких низких температурах, данный газовый закон перестает выполняться.
Для осуществления изобарного процесса, нужно нагревать газ, помещенный в цилиндр с подвижным поршнем (при условии, что внешнее давление постоянно).
Наконец, давайте поговорим об изохорном процессе. В этом случае, мы рассматриваем уравнение состояния идеального газа при постоянной массе и объеме:

Исходя из этого, можно заключить следующее: для газа данной массы при постоянном объеме отношение давления к температуре постоянно. Этот закон был открыт Жаком Шарлем и, соответственно, называется законом Шарля. Если теперь мы выразим давление через температуру, то опять же придем к линейной зависимости:

То есть, график зависимости давления от температуры будет являться прямой линией. Эта линия называется изохорой.
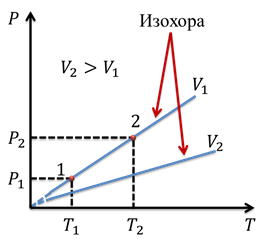
Изохора, соответствующая большему объему, лежит ниже изохоры, соответствующей меньшему объему, поскольку с ростом объема падает давление при постоянной температуре. Мы снова можем взять произвольные точки на графике. Тогда

Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изохоре. Изохоры вблизи абсолютного нуля обозначаются пунктиром, опять же из-за того, что данный закон перестает выполняться при абсолютном нуле.
Изохорный процесс проще всего осуществить технически: нужно взять какую-либо герметичную емкость. С нагреванием газа в этой емкости давление будет увеличиваться прямо пропорционально температуре. Именно этот закон лежит в основе создания газового термометра.
Как вы видите, все газовые законы являются частными случаями уравнения состояния идеального газа. На самом деле, сначала был открыт закон, соответствующий изотермическому процессу. В 1662 году его открыл Роберт Бойль и независимо от него в 1676 году этот закон заново открыл Эдм Мариотт. Спустя более ста лет, а точнее, в 1787 году, Жак Шарль открыл закон, соответствующий изохоному процессу. Позднее, в 1802 году Гей-Люссак открыл закон, соответствующий изобарному процессу. Наконец, в 1834 году, КлапейрОн, основываясь на газовых законах, вывел свое уравнение состояния идеального газа для постоянной массы. А через 40 лет, в 1874 году, Менделеев преобразовал это уравнение для произвольной массы газа. Но сегодня мы, так сказать, пошли в обратном направлении: от общего к частному.
Примеры решения задач.
Задача 1. Газ изотермически расширяется от объёма, равного 1 л до объёма, равного 3 л. Если начальное давление газа было равно 360 кПа, то каким станет его давление, когда газ закончит расширяться?

Задача 2. На графике показан некий процесс, происходящий с кислородом, масса которого 20 г. Определите объём газа, соответствующий указанной на графике точке.


 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 19062
19062



