Исследования спектров излучения разрежённых газов (то есть спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Наиболее изученным является спектр самого простого атома — атома водорода. Впервые Иоганн Якоб Бальмер в 1885 году, изучая спектры атома водорода, обнаружил, что расположение четырёх цветных линий в видимой части спектра подчиняются определённой закономерности, которую можно описать с помощью математической формулы:

В этой формуле m — целое число, больше двух, а R — постоянная величина, называемая постоянной Ри́дберга.

Эти четыре линии в спектре атома водорода составляют так называемую серию линий Бальмера. Позже серии линий были установлены и в других частях спектра. В частности, Теодором Лайманом была обнаружена серия линий в ультрафиолетовой области спектра — серия Лаймана:

А в инфракрасной области было обнаружено сразу три серии:
серия Па́шена:

серия Брэ́ккета:

И серия Пфу́нда:

Как видим, формулы, описывающие разные серии, очень похожи. Поэтому Йоханес Риберг свёл их в одну, которую называют обобщённой формулой Бальмера или формулой Бальмера — Ридберга:

В ней n имеет в каждой данной серии постоянное целочисленное значение от единицы до бесконечности, a k принимает целочисленные значения начиная с (n + 1).
Таким образом, излучаемый разрежёнными газами свет концентрируется в узких спектральных интервалах вблизи определённых частот, характерных для атомов данного вещества, в результате чего мы и наблюдаем линейчатые спектры испускания или поглощения. Поэтому линейчатые спектры атомарных газов являются своеобразным ключом к пониманию внутреннего строения атома, так как излучение и поглощение света атомами есть результат внутриатомных процессов, то есть процессов, в которых могут принимать участие только частицы, входящие в состав атома. Но вот что такое атом?
Мы знаем, что атомы представляют собой очень прочные системы, несоизмеримо более устойчивые, чем составленные из них молекулы. А такие внешние воздействия, как нагрев, изменение давления, мощные электрические разряды приводят лишь к незначительным изменениям атомов: они могут ионизоваться. Поэтому до конца XIX века атомы считали простейшими неделимыми частицами вещества. Однако в последнее десятилетие XIX века произошло ряд крупнейших открытий в физике. В частности, французским физиком Антуаном Анри Беккерелем было открыто явление естественной радиоактивности некоторых веществ. А в 1896 году английским физиком Джозефом Джоном Томсоном был открыт электрон.
Также Эрнестом Резерфордом было установлено, что радиоактивное излучение содержит в себе положительно и отрицательно заряженные частицы. Поэтому естественно было предположить, что эти частицы входят в состав атомов.
После открытия электрона Томсон построил модель атома для объяснения установленных в то время экспериментальных фактов:
атомы электрически нейтральны и любые атомы независимо от их природы содержат электроны;
электроны являются лёгкими относительно масс атомов отрицательно заряженными корпускулами с малым и равным зарядом;
при возбуждении атомов они излучают только на определённых частотах, порождая линейчатые оптические спектры.
В статье, опубликованной в марте 1904 года, Томсон рассмотрел три правдоподобные варианта возможного строения атома, объясняющие его электрическую нейтральность и другие свойства.

Однако тут же в статье учёный говорит о том, что наиболее вероятно строение атома по третьей модели. Томсон писал: «атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд».
То есть по Томсону, атом состоит из электронов, помещённых в положительно заряженный «суп», компенсирующий электрически отрицательные заряды электронов, образно — подобно отрицательно заряженным «изюминкам» в положительно заряженном «пудинге». Именно поэтому модель атома Томсона была названа «Пу́динговой».

В модели Томсона электроны могли свободно вращаться по кольцевым орбитам, которые стабилизировались взаимодействиями между электронами, а линейчатые спектры объясняли разницей энергий при движении по разным кольцевым орбитам.
Используя модель атома Томсона, можно было объяснить ряд известных к тому времени физических явлений, таких как электризация, электрическая проводимость твёрдых тел, жидкостей и газов. Но в то же время она имела ряд существенных недостатков. Во-первых, она не могла объяснить наличие большого числа линий в спектрах атомов. Во-вторых, модель не позволяла объяснить спектральные закономерности в спектре атома водорода. Но самый главный фактор, заставившим отказаться от модели Томсона, состоял в том, что «Пудинговая модель» оказалась в полном противоречии с опытами Ганса Гейгера и Эрнеста Марсдена под руководством Эрнеста Резерфорда, проведёнными в 1909 году.
Суть опыта была достаточно проста. Резерфорд с помощниками брал свинцовый сосуд, внутри которого находился радиоактивный элемент, испускающий через узкое отверстие в сосуде альфа-частицы (ионизированные атомы гелия, масса которых примерно в 8000 раз больше массы электрона).
Скорость вылетающей альфа-частицы была очень велика — порядка 1/15 скорости света. Для регистрации этих самых частиц учёный использовал сцинтилляционный экран с микроскопом. Чтобы устранить рассеяние альфа-частиц на молекулах воздуха, Резерфорд поместил всю установку в сосуд, из которого был откачан воздух. Если на пути частиц нет никаких препятствий, то они попадают на экран узким пучком, а возникающие вспышки сливаются в одно небольшое световое пятно.

Однако если на пути альфа-частиц поместить тонкую золотую фольгу, то при взаимодействии с ней, площадь пятна увеличивалась. Это свидетельствовало о рассеянии альфа-частиц на атомах золота.
Но самое удивительное произошло, когда экран был поставлен с обратной стороны (говорят в результате ошибки лаборанта). Но и тогда на экране наблюдались вспышки, то есть альфа-частицы рассеивались на углы больше 90о. Такой результат предвидеть было очень сложно, поскольку расчёты говорили о том, что электрическое поле положительного заряда, распределённого по всему атому, не может быть достаточно сильным, чтобы отбросить альфа-частицу назад. А поскольку масса электрона почти в восемь тысяч раз меньше массы альфа-частицы, то и они не могли существенно поменять траекторию альфа-частиц. При этом резкие отклонения наблюдались весьма редко (примерно одна из 20 000 альфа-частиц испытывала отклонение на угол больше 90°; одна из 40 000 — на угол больше 120°, а одна из 70 000 — на угол больше 150°).
Легенда гласит, что Резерфорд выбежал из лаборатории с криком: «Теперь я знаю, как устроен атом!»
Из результатов экспериментов следовало то, что внутри атома имеется очень сильное электрическое поле, которое создаётся положительным зарядом, сконцентрированным в очень малом объёме. Название «ядро» для этого заряда было предложено Резерфордом.
Размер ядра мал, но в нём сосредоточена практически вся масса атома — около 99,96 %. При сближении альфа-частицы и ядра в соответствии с законом Кулона между ними возникают большие силы отталкивания, которые существенно изменяли траекторию альфа-частиц.
В модели атома Томсона электрическое поле соответствует электрическому полю равномерно заряженного по объёму шара, и при приближении к центру атома модуль его напряжённости стремится к нулю. В этом случае не было бы альфа-частиц, рассеянных на большие углы.
На основании своих опытов Резерфорд смог оценить размеры атома и его ядра. Выяснилось, что диаметр ядра составляет порядка 10–14 — 10–15 м, в то время как диаметр атома составляет порядка 10–10 м. В 1911 году все эти данные привели Резерфорда к созданию ядерной модели атома.
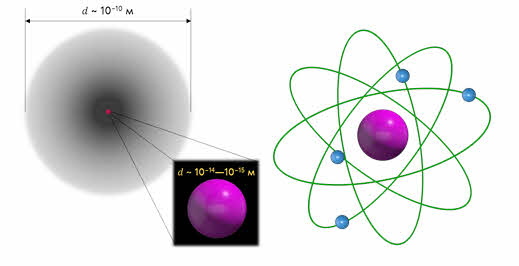
Итак, согласно этой модели в центре атома расположено положительно заряженное ядро, диаметром около 10–15 м, в котором сосредоточена основная масса атома. Заряд ядра равен произведению порядкового номера элемента в таблице Менделеева и модулю заряда электрона: 𝑞 = +𝑍𝑒.
Ядро атома окружают электроны, образуя электронную оболочку атома, причём число электронов равно порядковому номеру элемента в таблице Менделеева, а их суммарный заряд равен заряду ядра, поэтому атом в целом электрически нейтрален: 𝑞 = 𝑍(−𝑒).
Внутри атома электроны не могут покоиться, так как под действием сил Кулона они упали бы на ядро, и атом прекратил бы своё существование. Поэтому они вращаются вокруг ядра по определенным орбитам.
Такую модель атома называют также планетарной, поскольку она напоминает нашу Солнечную систему, где планеты вращаются вокруг массивного центра — Солнца, масса которого составляет около 99,87 % массы всей Солнечной системы.
При всей своей убедительности планетарная модель атома оказалась внутренне противоречивой. По законам электродинамики движущийся ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением энергии электрона в поле ядра. Следствием этого должно явиться уменьшение скорости движения и частоты вращения электронов вокруг ядра. Если частота непрерывно изменяется, то спектр излучения атома должен быть сплошным. Уменьшение скорости электрона должно привести к тому, что электрон будет двигаться по спирали к ядру и в течение короткого времени упадёт на него. То есть в этой модели атом должен быть неустойчивым.
Это находится в полном противоречии с экспериментальными фактами, которые свидетельствуют о том, что:
· атом является достаточно устойчивой системой;
· атом излучает электромагнитные волны лишь при определенных условиях, а не непрерывно;
· а спектры излучения атомов являются линейчатыми.
Эти противоречия возникли потому, что к электронам в атомах применяли законы классической физики, а, как мы уже с вами знаем, в микромире действуют свои законы, отличные от законов макромира.
Первым признал невозможность применения законов классической физики к атомам датский учёный Нильс Бор. Он ввёл элементы квантовой теории в модель атома Резерфорда и в 1913 году создал неклассическую теорию атома. В основе этой теории лежала идея связать в единое целое три результата, полученные в физике к тому времени.

 Получите свидетельство
Получите свидетельство Вход
Вход




 7765
7765

