«Не бойтесь быть независимыми мыслителями!...».
Джозеф Томсон
В прошлой теме говорилось о трудностях планетарной модели атома Резерфорда. Выход из этого крайне затруднительного положения нашел Нильс Бор, благодаря своей невероятной интуиции.
В результате проведения опытов по рассеянию альфа-частиц, Эрнест Резерфорд установил, что почти вся масса и весь положительный заряд атома сконцентрированы в очень малой области – атомном ядре. Основываясь на своих экспериментах и расчетах, Резерфорд смог вычислить размеры атома и размеры атомного ядра. Выяснилось, что ядро в десятки или даже сотни тысяч раз меньше самого атома. На основании всего выше перечисленного, Резерфорд предложил планетарную модель атома, согласно которой, вокруг положительно заряженного ядра вращаются электроны. Трудности в этой модели возникли почти сразу же, потому что она противоречила законам электродинамики Максвелла и законам механики Ньютона. В соответствии с ними, атом не мог просуществовать и 1 мкс, поскольку электроны должны были бы очень скоро упасть в ядро. Поэтому, необходимо было составить какую-то новую теорию, подходящую для описания процессов, происходящих внутри атома.
Сегодня такая теория называется квантовой механикой. Начало этой теории ещё в 1913 году положил Нильс Бор. Конечно, ему не удалось сразу разработать последовательную теорию атома. Однако, он сформулировал основные положения новой теории в виде постулатов.
Первый постулат Бора (или постулат стационарных состояний) гласит следующее: существуют особые, стационарные состояния атома, находясь в которых, атом не излучает энергию, при этом, электроны в атоме движутся с ускорением.
Второй постулат Бора (или правило частот) говорит нам о том, что излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний. Здесь необходимо отметить, что данный постулат распространяется не только на видимый свет. То есть, атом может излучать энергию и в инфракрасной области спектра, и в ультрафиолетовой.
Второй постулат Бора описывается следующей формулой

Если разделить всё уравнение на постоянную Планка, то получим выражение, с помощью которого можно вычислить частоту излучения.

Таким образом, первый постулат Бора гласит, что электрон может находиться только в особых стационарных состояниях. То есть, существуют определенные орбиты, каждая из которых соответствует определенному энергетическому уровню. Обратите внимание, что в атомной физике энергия измеряется в эВ (электрон-вольтах).
1 эВ – это энергия приобретаемая электроном при прохождении им разности потенциалов в 1 В.
1 эВ = 1,6×10–19 Дж
В данном примере числовые значения энергий соответствуют атому водорода.
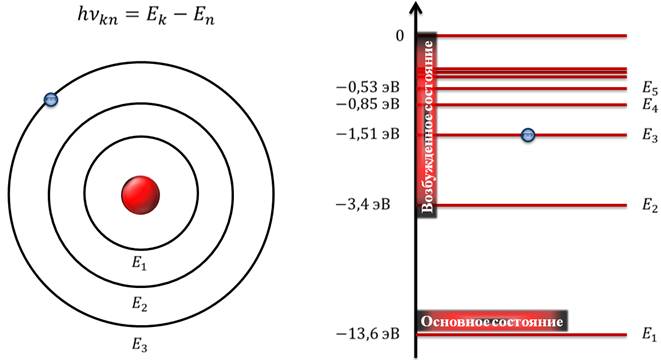
Электрон может обладать одной из указанных энергий и находится на соответствующей орбите. Никаких промежуточных стадий в стабильных атомах быть не может. Если электрон переходит с более высокого энергетического уровня на менее высокий, то он излучает свет, и энергия излученного фотона может быть вычислена в соответствии со вторым постулатом Бора. И, наоборот, при переходе с низкого энергетического уровня на высокий, происходит поглощение света. Важно понимать, что энергия излучается или поглощается дискретными порциями (то есть квантами). Разумеется, электрон не может излучить или поглотить дробное число фотонов.
Отметим, что состояние атома, которому соответствует наименьшая энергия, называется основным, а все остальные состояния – возбужденными. В возбужденном состоянии электрон может находиться очень недолго (не более, чем 10–8 с), а в основном состоянии – неограниченно долго.
Простейшая атомная система – это атом водорода. Именно для построения теории атома водорода Бор и применил свои постулаты. Основной задачей являлось нахождение частот электромагнитных волн, которые излучал атом водорода. Для решения этой задачи, Бору пришлось сформулировать третий постулат, который также называется правилом квантования. Анализируя данные, полученные в результате своих исследований излучения атома водорода, Нильс Бор заметил следующее: произведение импульса электрона и длины его орбиты всегда кратно постоянной Планка.

В модели Бора электрон двигался по круговой орбите, поэтому длину его окружности можно найти по формуле


Если
перенести  в
правую часть, то
в
правую часть, то

где ħ – квантовая постоянная Планка.
Очевидно, что скорость движения электрона зависит от того, по какой орбите он вращается. Полученное уравнение называется правилом квантования орбит, то есть из этого уравнения можно найти стационарные электронные орбиты.
Несмотря
на свои постулаты, Нильс Бор, конечно, не отказывался полностью от классической
механики. Он также рассмотрел движение электрона как равномерное криволинейное
движение. Итак, электрон движется по круговой орбите с некоторой скоростью  .
Электрон обладает элементарным отрицательным зарядом, а ядро обладает
положительным зарядом, кратным элементарному.
.
Электрон обладает элементарным отрицательным зарядом, а ядро обладает
положительным зарядом, кратным элементарному.

Из курса физики 9 класса известно, Z – это зарядовое число. Именно на него и умножается элементарный заряд, чтобы найти заряд ядра данного атома. В результате электромагнитного взаимодействия, электрон притягивается к ядру с силой, которая вычисляется в соответствии с законом Кулона. Исходя из второго закона Ньютона, можно приравнять эту силу к произведению массы электрона и центростремительного ускорения.

Можно преобразовать полученное уравнение, домножив его на радиус в квадрате.

Используя это уравнение, и правило квантования орбит, можно составить систему из двух уравнений.

В этой системе уравнений всего два неизвестных – это скорость электрона и радиус орбиты. Если разделить второе уравнение на первое, то можно получить выражение, с помощью которого вычисляется скорость электрона, вращающегося на n орбите.

Коэффициент пропорциональности k, квантовая постоянная Планка и заряд электрона – всё это физические константы, которые известны. Остается только подставить в данное выражение порядковый номер элемента (то есть зарядовое число) и номер орбиты (который называется главным квантовым числом). Если теперь выражение для скорости подставить в первое уравнение, то можно вывести формулу, по которой рассчитывается радиус орбиты.

Известно, что зарядовое число водорода равно единице. Если подставить единицу вместо Z и вместо n, то убедимся, что скорость электрона в атоме водорода на первой орбите равна

а радиус орбиты (то есть радиус атома) водорода равен

Согласно теории Бора, энергия электрона в атоме водорода зависит только от того, на каком энергетическом уровне он находится.

В представленной формуле n – это номер орбиты, а все остальные величины являются физическими константами. Эту формулу можно вывести, если вспомнить, что кинетическая энергия равна половине произведения массы и квадрата скорости.

Если подставить выражение для вычисления скорости электрона на n орбите в формулу для кинетической энергии и подставить единицу вместо Z, то можно получить исходную формулу.

Имеется знак минус в этой формуле, поскольку первый энергетический уровень принимается за самый низкий.
Было рассмотрено применение теории Бора только к атому водорода. Дело в том, что разработать теорию для других атомов, на основе представлений Бора, не удалось. В этом нет ничего удивительного. Ведь для создания своей теории Бор использовал как классическую физику, так и совершенно новые постулаты, противоречащие классической физике, в то время как требовалось разработать фундаментально новый подход к механике и электродинамике. Такой подход был разработан в конце двадцатых годов прошлого столетия: были разработаны такие теории, как квантовая механика и квантовая электродинамика. Как выяснилось, первые два постулата Бора абсолютно правильные, но третий постулат применим далеко не всегда.
Упражнения.
Задача 1. Определите частоту волны света, испускаемого атомом водорода при его переходе с пятого энергетического уровня на третий энергетический уровень.

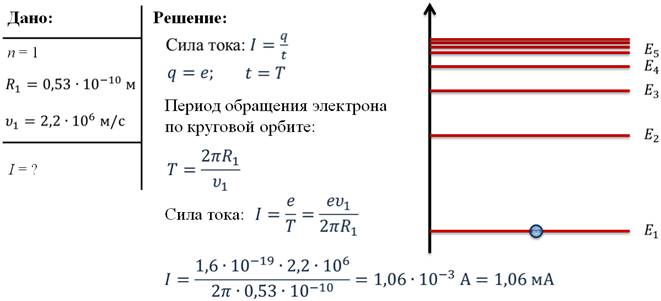
Задача 2. Найдите силу тока, который вызывает электрон, двигаясь в атоме водорода, находящемся в основном состоянии.
Основные выводы:
– Первый постулат или постулат стационарных состояний гласит: существуют особые, стационарные состояния атома, находясь в которых, атом не излучает энергию, при этом, электроны в атоме движутся с ускорением.
– Второй постулат или правило частот Бор сформулировал так: излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.

– Энергия электрона атома водорода, находящегося на n энергетическом уровне:

– Радиус n-ой орбиты электрона:

– Скорость электрона на n-ой орбите:

– Модель Бора не в состоянии описать движение электронов в других атомах. Для полного понимания, процессы, происходящие внутри атомов, нужно рассматривать с точки зрения квантовой механики.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 16664
16664

