Когда вы только начинали изучать физику, мы говорили о том, что все тела состоят из мельчайших частиц — атомов и молекул. Такое предположение было высказано ещё древнегреческим философом Демокритом около двух с половиной тысяч лет назад. Он предположил, что если делить вещество на всё более мелкие части, то в конце концов останется частица, которая сохраняет свойства данного вещества, но поделить её уже было бы нельзя. Вот эту самую маленькую частицу Демокрит и назвал атомом, что в переводе с греческого означает «неделимый».
Но примерно с середины 19 века стали появляться экспериментальные факты, которые ставили под сомнение представления о неделимости атомов. Одним из первых таких доказательств стало открытие в тысяча восемьсот девяносто шестом году Анри Беккерелем естественной радиоактивности. Это открытие оказалось случайным, поскольку на самом деле Беккерель изучал воздействие солнечного излучения на различные соли и минералы.
В это время уже было известно такое явление, как фосфоресценция, то есть свечение некоторых веществ, возникающее после их облучения солнечными лучами. Так вот, экспериментируя с солями урана, Беккерель завернул фотопластинку в плотную чёрную бумагу, положил на неё сверху маленький кусочек урановой соли и выставил всё это на солнечный свет. После проявления фотопластинки на ней обнаружилось тёмное пятно на том месте, где лежала крупинка соли. Беккерель полагал, что это следствие явления фосфоресценции. Но однажды из-за облачной погоды опыт пришлось отложить, и пластинка с солью урана была помещена в светонепроницаемый ящик стола. Несколько дней спустя Беккерель на всякий случай проявил фотопластинку и с удивлением обнаружил на ней тёмное пятно. Учёный понял, что соли урана самопроизвольно без всякого освещения излучают какие-то неизвестные лучи.
Многие учёные стали повторять опыты Беккереля, и прежде всего супруги Пьер и Мария Кюри. Они пытались проверить, нет ли среди веществ, не исследованных Беккерелем, таких, которые обладают таинственными свойствами урана.
В первых экспериментах поиски велись с помощью электроскопа. Вам уже известно, что воздух — это изолятор, поэтому положение листочков заряженного электроскопа не должно меняться. Но если воздух подвергнуть действию излучения, тогда он становится проводником.

Этим свойством излучения и воспользовались учёные для поиска новых радиоактивных элементов. Мария Кюри подносила к заряженному электроскопу различные минералы и смотрела, как ведут себя его листочки. В 1898 году было обнаружено, что подобные лучи испускает ещё один элемент — торий. В том же году супруги Кюри выделили из урановой смоляной руды два новых химических элемента — радий и полоний. Именно от радия и произошёл термин «радиоактивность».
Радиоактивность — это способность атомов некоторых химических элементов к самопроизвольному излучению.
Такую радиоактивность ещё называют естественной радиоактивностью.
В 1899 году английский физик Эрне́ст Резерфорд провёл серию опытов, в результате которых было обнаружено, что радиоактивное излучение имеет сложный состав. Суть его опытов такова. Резерфорд построил установку, которая представляла собой толстостенный свинцовый ящик с прорезью. Внутрь ящика помещались крупицы радия.

Из ящика сквозь узкое отверстие выходил направленный и сфокусированный пучок радиоактивного излучения и попадал на фотопластинку. После проявления фотопластинки на ней обнаруживалось одно тёмное пятно в том месте, куда попадал пучок.
Затем всю установку Резерфорд поместил в сильное магнитное поле. Он рассуждал так: если радиоактивное излучение является потоком частиц с положительным зарядом, то под действием сил магнитного поля поток частиц отклонится вверх. Если радиоактивное излучение — это поток частиц, имеющих отрицательный заряд, то он отклонится вниз. Ну а если это поток частиц, не имеющих заряда, то пучок не будет отклоняться.

Каково же было удивление Резерфорда, когда после проявления на фотопластинке были обнаружены три пятна: центральное, которое было и раньше, и два дополнительных — по разные стороны от центрального. Отсюда следовало, что в пучке излучения действительно присутствовали частицы, обладающие зарядами противоположных знаков.
Положительно заряженные частицы были названы α-частицами, а отрицательно заряженные — β-частицами. Центральный поток, очевидно, представлял собой излучение, не содержащее заряженных частиц. Это излучение получило название γ-излучения.
Также Резерфорду удалось доказать, что α-излучение является потоком атомов гелия, потерявших оба своих электрона. При этом путь α-частиц в воздухе не велик, и он полностью задерживается простым листом бумаги.

В том же году Беккерель доказал, что β-лучи являются потоком электронов. Этот поток имеет большую проникающую способность и задерживается лишь цинковой пластинкой толщиной несколько миллиметров.

В 1900 году французский физик Поль Виллар установил, что третья составляющая радиоактивного излучения представляет собой электромагнитное излучение с очень малой длиной волны. Гамма-лучи легко проходят через вещество, и чтобы их остановить, нужна либо свинцовая пластинка, толщиной в 5 сантиметров, либо 30 сантиметров бетона, или же 60 сантиметров грунта.

Явление радиоактивности, то есть самопроизвольное излучение веществом α-, β- и γ-излучений, наряду с другими экспериментальными фактами, послужило основанием для предположения о том, что атомы вещества имеют сложный состав. И что скорее всего, в состав атома входят отрицательно и положительно заряженные частицы. Кроме того, было известно, что атом в целом электрически нейтрален.
Опираясь на эти и некоторые другие факты англичанин Джозеф Джон Томсон в тысяча девятьсот третьем году предложил одну из первых моделей атома. Согласно его модели, атом представляет собой однородный шар из положительно заряженного вещества, внутри которого находятся электроны.

Причём число электронов полностью компенсирует суммарный положительный заряд атома. Эта модель чем-то напоминала булочку с изюмом. Отсюда и произошёл термин «пудинговая модель атома».
Однако модель строения атома по Томсону нуждалась в проверке, в частности важно было проверить, действительно ли положительный заряд распределён по всему объёму атома.
Поэтому в тысяча девятьсот одиннадцатом году Эрнестом Резерфордом была проведена серия опытов по изучению состава и строения атома. Суть опыта достаточно проста. Резерфорд брал свинцовый сосуд, внутри которого находился радиоактивный элемент, испускающий α-частицы через узкое отверстие в сосуде.
Для регистрации этих самых частиц учёный использовал экран, на который была нанесена тонкая плёнка специального вещества. α-частицы, взаимодействуя с этим веществом, вызывали кратковременные вспышки, которые можно было наблюдать в микроскоп. Такой метод регистрации частиц называется методом сцинциляций (то есть вспышек).
Итак, чтобы устранить рассеяние альфа-частиц на молекулах воздуха, Резерфорд поместил всю установку в сосуд, из которого был откачан воздух. Если на пути частиц нет никаких препятствий, то они попадают на экран узким пучком, а возникающие вспышки сливаются в одно небольшое световое пятно.

Однако если на пути α-частиц поместить тонкую золотую фольгу, то при взаимодействии с ней, площадь пятна увеличивалась. Это свидетельствовало о рассеянии α-частиц.

Но Резерфорд на этом не остановился. Он немного модифицировал исходную установку, с целью выяснить: могут ли α-частицы отклоняться на ещё большие углы. Для этого, он окружил фольгу экранами и повторил опыт. К его великому удивлению, некоторые частицы отклонились на углы, превышающие 90о. То есть, фактически небольшое число частиц были отброшены назад.

Действительно, такой результат предвидеть было очень сложно, поскольку расчёты говорили о том, что электрическое поле положительного заряда, распределённого по всему атому, не может быть достаточно сильным, чтобы отбросить α-частицу назад. А поскольку масса электрона почти в 8000 раз меньше массы α -частицы, то и они не могли существенно поменять траекторию α -частиц. Это навело учёного на мысли о том, что более 99,9 % массы и весь положительный заряд атома сосредоточены в чрезвычайно малой области в его центре. Эта область была названа ядром атома.

И только те немногие частицы, которые пролетают рядом с ядром атома, отклоняются на большие углы.
На основании своих опытов Резерфорд смог оценить размеры атома и его ядра.

Все эти данные привели Резерфорда к созданию ядерной (или планетарной) модели атома, о которой вы уже не раз слышали. Напомним, что в этой модели в центре атома находится положительно заряженное ядро, а вокруг него, подобно планетам вокруг Солнца, вращаются электроны.
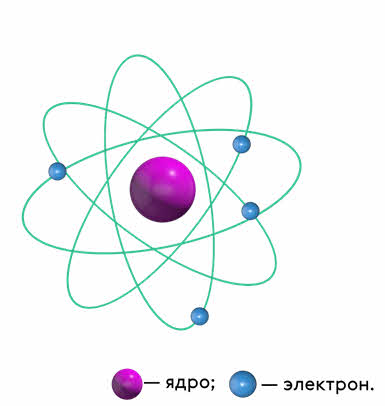
После открытия Резерфордом атомного ядра многочисленные эксперименты подтвердили, что атомные ядра, так же, как и сами атомы, имеют сложную структуру.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 18666
18666

